ADVIA XPT全自动生化分析仪的性能验证
张长军
按照《医学实验室质量和能力认可准则》和《医疗机构临床试验室管理方法》的规定[1-2],对临床实验室的全自动生化分析仪进行安装后,因其对安装和使用环境有特殊的要求,故应对所开展项目的性能进行分析评价,以保证检验结果的可靠性[3]。同时,生化项目性能评价也是实验室认可的重要内容及要求[4]。结合本实验室的情况,选取天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转移酶(gamma-glutamyl transpetidase,GGT)、载脂蛋白A1(apolipoprotein A1,ApoA1)、载脂蛋白 B(ApoB)、血钙(calcium,Ca)、总胆固醇(total cholestero,TC)、甘油三酯(triglyceride,TG)、尿酸(uric acid,UA)、低密度脂蛋白(low densith lipoprotein,LDL)、高密度脂蛋白(high densith lipoprotein,HDL)、总胆红素(total bilirubin,TBil)、直接胆红素(direct bilirubin,DBil)、肌酐(creatinine,Cr)、尿素(urea,Ure)、葡萄糖(glucose,Glu)、血磷(P)、脂蛋白 a(lipoprotein a,LPa)、前白蛋白(prealbumin,PA)共20个生化检验项目,对上述项目的精密度、准确性、参考范围和线性范围的性能进行评价,现报告如下。
1 材料
1.1 仪器与试剂 采用德国西门子公司生产的ADVIA XPT全自动生化分析仪及其配套试剂,试剂均在有效期内。
1.2 标本 选取本院健康体检者当天新鲜血清标本作为正常血清标本,要求血样采集后尽快离心处理,且标本溶血指数、黄疸指数和脂血指数均符合要求。收集各项目的异常高值及低值标本,以2017年卫生部临床检验中心第1次发放的室间质评标本的数据作为评价依据。健康体检者的纳入条件:经健康体检,发育、精神均正常,无任何器质性疾病;3个月内无输血史和手术史;无不良嗜好;近期无用药或特殊饮食治疗史;女性不在经期、妊娠期或哺乳期;近1个月内无任何疾病[5]。
1.3 校准品和质控品 采用西门子原装试剂的配套校准物检测 AST、ALT、GGT、ALP、ApoA1、ApoB、Ca、TC、TG、UA、LDL、HDL、TBil、DBil、Cr、Ure、Glu、P、LPa、PA共20个生化项目,质控采用美国伯乐生化质控水平1、质控水平2和质控水平3共3种质控血清。
2 方法
2.1 精密度验证 根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)EP5-A2文件[6]要求,对全自动生化分析仪进行安装调试,于每天的室内质控符合要求后进行验证试验。使用高、中、低3个水平的室内质控,每个水平各分装5管,每天各解冻其中的1管进行上机检测,连续检测4次,共检测5 d。利用生化仪中的软件计算批内不精密度和总精密度值,判断标准为批内变异系数(coefficient of variation,CV)不超过临床实验室管理要求的最大允许误差(total error,TE%)的1/4。CV总不超过临床实验室管理要求的1/3TE%。
2.2 正确度验证 根据CLSI EP15-A2文件[7],精密度符合评价标准要求后,本实验室以2017年第1次卫生部临床检验中心回报的生化室间质评结果作为评价指标,以每个项目的5个标本中结果最大偏倚作为该生化项目的正确度,判断依据为不超过卫生部临床检验中心室间质量评价标准(National Center Clinical Laboratories,NCCL)允许最大误差的1/3。
2.3 线性范围验证 参考CLSI EP6-A2文件[8],至少检测6个浓度水平。选择高值浓度标本(H,高值标本浓度尽量接近线性范围的上限)和低值浓度标本(L)各1份,浓度范围要覆盖仪器说明书给出的线性范围。将高值浓度标本与低值浓度标本分别按L、1H+4L、2H+3L、3H+2L、4H+1L、H 的比例混合,配成6份不同浓度的标本,随机排列,每份混合血清标本测定2次,记录结果。将实测值与预期值进行回归分析。若所有实验点在坐标纸上呈明显直线趋势,用直线回归对数据进行统计,得直线回归方程Y=aX+b,同时计算相关系数 r。若 r2≥0.95,a为0.97~1.03,b与0无显著差异,则可判断其呈线性,同时需满足测定值与理论值偏差<1/2TE%。
2.4 参考区间验证 参考CLSI C28-A2文件[9],从本院体检人群标本中选取20份体检合格的健康人标本,其中男性、女性各10例。在ADVIA XPT全自动生化分析仪上测定所选取的项目(默认稀释倍数),并对结果进行统计分析。针对西门子厂家提供的参考范围进行验证,要求20份参考标本中,观测值在引用厂家的参考区间以外的标本≤2份(10%的结果)。计算比率R,计算公式为R=检测值在引用厂家的参考区间之内的个数/20。R≥90%表示可以接受,验证通过;否则,为验证未通过。
2.5 统计学处理 采用Excel 2010表格软件进行数据统计,计算相关系数和回归方程等。
3 结果
3.1 精密度验证结果 20个生化项目中,各项目的批内精密度值均<1/4TE%;各项目总精密度≤1/3TE%。表明上述20个生化项目在ADVIA XPT全自动生化分析仪上的精密度良好,可满足性能评价要求。见表1。
3.2 正确度验证结果 20个生化项目检测结果的平均偏差为0.05~5.36,小于该项目1/3NCCL的要求,各项正确度性能符合要求,评价均通过。见表1。
3.3 线性范围验证结果 相关系数r2为0.994 1~1.000 7,r2≥0.95,评价结果均通过。见表2。
3.4 参考区间验证结果 20个生化项目中,各项目的观测值在引用厂家的参考区间之外的个数均≤2个(10%的结果),评价结果均通过。见表3。
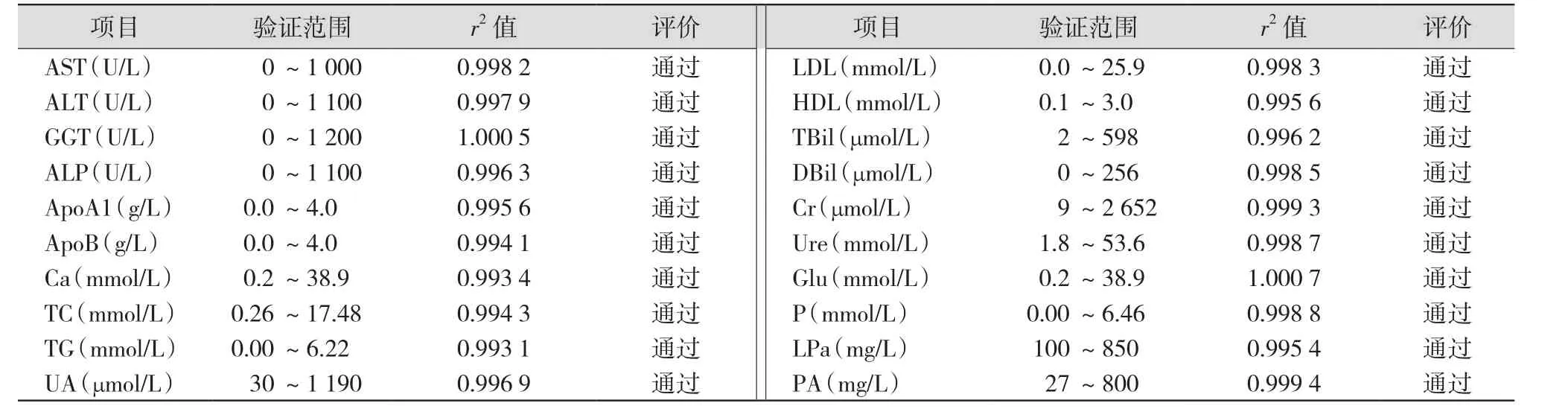
表2 ADVIA XPT全自动生化分析仪线性范围验证结果
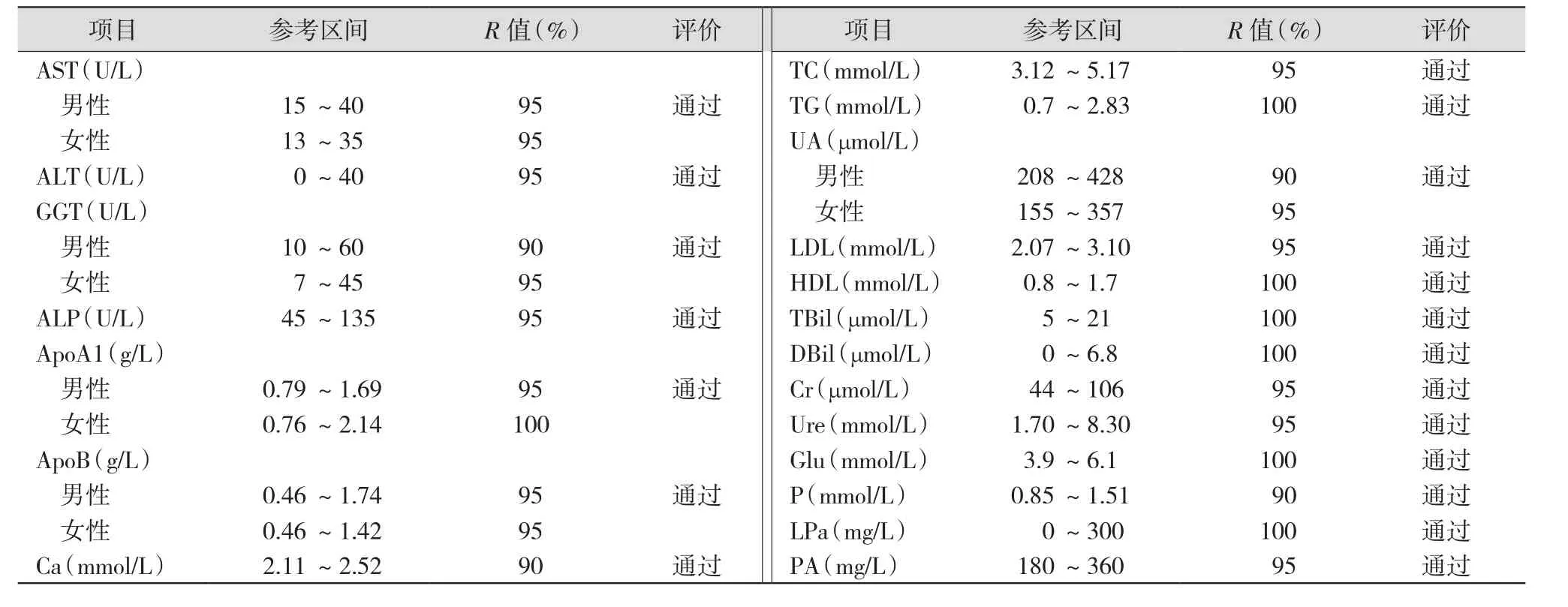
表3 ADVIA XPT全自动生化分析仪参考区间验证结果
4 讨论
设备的硬件及测量系统的良好分析性能是保证检验结果准确可靠的前提,而检测系统的性能验证是评价检测系统能否用于临床检验工作的前提[10-11]。CNAS-CL02《医学实验室质量和能力认可准则》(ISO 15189:2012)中也规定,实验室在设备安装和使用前应验证其性能,对制造商提供的相关方法学分析性能等信息资料要予以验证确认[12]。本研究对20个生化检验项目(包括AST、ALT、GGT、ALP、ApoA1、ApoB、Ca、TC、TG、UA、LDL、HDL、TBil、DBil、Cr、Ure、Glu、P、LPa、PA)进 行 了 精密度、准确性、参考范围和线性范围的性能验证,结果均可靠。
精密度即多次重复测定同一量时各检测结果的一致性,包括批内精密度和批间精密度[13],是检测系统分析性能的重要指标之一[14]。对检测的20个生化项目的实验数据进行统计分析发现,各项目的批内精密度均不超过临床实验室管理要求的1/4TE%的质量要求,各项目总精密度不超过临床实验室管理要求的1/3TE%的质量要求,表明20个生化项目在ADVIA XPT全自动生化分析仪上的精密度良好,符合性能评价要求。
正确度是指大量测定的均值与真值的接近程度[15],参照 EP15-A2 文件[7],对 2017 年卫生部临床检验中心第1次提供的生化室间质评的样本进行检测,以回报的生化室间质评结果作为评价指标。本研究在ADVIA XPT全自动生化分析仪上检测的20个生化项目结果的平均偏差均小于该项目1/3NCCL的要求,表明其正确度性能符合要求。
线性范围是评价试剂检测性能的重要指标之一[16],可报告范围即检测线性范围。本研究中各项结果经统计分析显示,相关系数r2均≥0.95,表明20个生化项目的线性范围验证结果良好。
临床检验项目参考区间的制订是实验室开展的前提[17-18]。临床实验室应建立符合中国人群特点的参考范围,在应用该参考范围之前先对其进行必要的验证[19]。本研究通过检测20例健康体检者的20个生化项目,每个生化项目观测值在引用厂家的参考区间以外的个数均≤2个(10%的结果),说明本实验室拟开展的20个生化项目所引用的的参考区间满足临床需求。
综上所述,本院使用ADVIA XPT全自动生化分析仪及其配套试剂开展检测的20个生化检验项目(包括AST、ALT、GGT、ALP、ApoA1、ApoB、Ca、TC、TG、UA、LDL、HDL、TBil、DBil、Cr、Ure、Glu、P、LPa、PA)的精密度、正确度、线性范围和参考区间均验证合格,达到质量标准的要求,可以用于临床标本的检测。
1 中国国家标准化管理委员会.GB/T 22576—2008 医学实验室质量和能力的专用要求[S].北京:中国标准出版社,2008.
2 中华人民共和国国家卫生和计划生育委员会.卫医发[2006]73医疗机构临床实验室管理办法.北京,2006.
3 刘卫兵.如何保证分析前的检验质量探讨[J].实用检验医师杂志,2017,9(2):71-72.
4 中国合格评定国家认可委员会.CNAS-CL02.医学实验室质量和能力认可准则(ISO15189:2007)[S].北京:中国计量出版社,2008:22-25.
5 陈海明,王前明,赵元勋.日立7600全自动生化分析仪的分析性能验证[J].国际检验医学杂志,2015,(20):2983-2986.
6 Clinical and Laboraytory Standards Institute.EP5-A2.Evaluation of precision of performance of quantitative measurement meth-ods[S].Wayne,PA:CLSI,2004.
7 Clinical and Laboratory Standards Institute.EP15-A2.User demonstra- tion of performance for precision and accuracy[S].Wayne,PA:CLSI,2004.
8 Clinical and Laboratory Standards Institute.EP6-A2.Evaluation of thelinearity of quantitative measurement procedures[S].Wayne,PA:CLSI,2003.
9 Clinical and Laboratory Standards Institute.C28-A2.How to defineand determine reference intervals in the clinical laboratory[S].Wayne,PA:CLSI,2000.
10 吴宗勇,贾德强,李佳,等.自动生化分析仪的能力验证[J].临床和实验医学杂志,2011,10(7):524-525.
11 陈文祥.临床检验参考测量系统与临床检验分析质量保证[J].中华检验医学杂志,2007,30(4):478-480.
12 中国合格评定国家认可委员会.CNAS-CL02 医学实验室质量和能力认可准则(ISO15189:2012)[S].北京:中国计量出版社,2012.
13 徐江霞,龚淑琪,万振华,等.新型乙肝定量PCR试剂检测性能验证[J].实验与检验医学,2016,34(2):149-151.
14 王丽馨,杨沛,殷勤,等.强生Vitros 5.1 FS生化分析仪上乳酸脱氢酶的性能验证[J].国际检验医学杂志,2016,37(17):2382-2383,2386.
15 王治国.临床检验方法确认与性能验证[M].北京:人民卫生出版社,2009:164.
16 卢旭.贝克曼库尔特AU5800全自动生化分析仪性能验证[J].医疗卫生装备,2016,37(5):107-110.
17 徐传华.AU640检测系统测定胱抑素C的分析测量范围和临床可报告范围的验证[J].检验医学与临床,2010,7(22):2501-2502.
18 赵建忠.生化分析仪精密度、准确性以及线性范围性能验证[J].国际检验医学杂志,2011,32(10):1111-1112.
19 张路,王薇,王治国.全国血气和酸碱分析检测项目参考区间现状调查[J].中华危重病急救医学,2015,27(10):816-820.

