传统酱油酿造过程中优势细菌的筛选及功能分析
庞 超,耿 涵,姚汐雨,石叶帆,朱 丹,赵 莹,于 海*,朱 龙,梁永正
(1.扬州大学 食品科学与工程学院,江苏 扬州 225000;2.江苏天之香食品有限公司,江苏 宿迁 223800;3.江苏康旺食品有限公司,江苏 扬州 225000)
我国传统发酵的酱油主要利用微生物发酵,发酵周期为2~4个月,到现在已经有两千多年的历史。人类利用微生物进行食品发酵与酿造已有数千年的历史,直到19世纪中叶,巴斯德(Pasteur)经过长期而细致的研究后,才有说服力地宣告发酵是微生物作用的结果[1]。传统酱油的发酵利用制曲过程中产生的蛋白酶来分解豆中的蛋白质,形成一定量的氨基酸、糖类等物质,赋予酱油独特的风味。现在国内不少科研单位通过对中国传统酱油酿造技术的改良,培育酱油生产优势菌株,创造独具特色的现代酱油生产工艺以此来缩短酱油的发酵周期并改善其风味。在酱油发酵过程中,微生物对酱油的风味和品质起着至关重要的作用,自然发酵的酱油中主要的微生物菌群为霉菌和细菌[2]。霉菌主要为米曲霉,米曲霉具有复杂的酶系,包括蛋白酶、淀粉酶、果胶酶、纤维素酶、谷氨酰胺酶等,因而它在发酵过程中可通过分解淀粉和蛋白质原料,为其他微生物的代谢作用提供物质基础[3-4]。细菌中,芽孢杆菌在发酵过程中不但数量突出,而且含有大量形成酱油风味的酶类物质,在发酵过程中发挥非常重要的作用[5],乳酸菌能产生多种有机酸,这些有机酸既是酱油的风味成分,又是其他酯香类物质的前体[6],乳酸菌繁殖可以促进酱醪pH值下降到酵母活动的最适pH,促进酵母繁殖进而提高酱油风味[7],但自然发酵也存在一些有害微生物的参与,这不仅使酱油产品的稳定性受到影响,也存在着很大的安全隐患[8]。研究传统发酵酱油中微生物的分布,明确优势菌株的类别对提升传统发酵酱油的质量和安全性具有很积极的意义,目前文献对发酵酱油中霉菌报道很多,对细菌的报道很少。本试验以酱油酿造过程中发酵2个月的黄豆为试验材料,以蛋白酶活力、硫化氢和生物胺产生性能为评价指标进行细菌筛选和鉴定,并对菌株的发酵性能及功能性进行分析。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱油酿造过程中发酵2个月的黄豆样品:江苏康旺食品有限公司。
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus):扬州大学肉制品试验室保藏。
1.1.2 主要试剂
马铃薯葡萄糖琼脂粉、营养肉汤粉、K2HPO4、CaCO3、硫胺素、磷酸吡哆醛、溴甲酚紫(均为分析纯):国药集团化学试剂有限公司;Ezup柱式动物基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)引物:由生工生物工程(上海)股份有限公司合成。
1.1.3 培养基
营养肉汤(nutrient broth,NB)液体培养基:牛肉浸膏10.0 g,蛋白胨10.0 g,氯化钠5.0 g,蒸馏水1 000 mL,121 ℃灭菌15 min。
营养肉汤固体培养基:在营养肉汤液体培养基的基础上添加2%的琼脂。
H2S产生培养基:牛肉膏7.5g,蛋白胨10.0g,琼脂20.0g,氯化钠5.0 g,蒸馏水1 000 mL。在琼脂凝固前加入10%无菌FeCl25.0 mL,在无菌条件下将液体培养基倒入试管内,高度为4~5 cm,冷却凝固,供接种用。
生物胺产生测定培养基:营养肉汤培养基中加入硫胺素0.01 g、K2HPO42.0 g、CaCO30.1 g、磷酸吡哆醛0.05 mg、溴甲酚紫0.06 g。
耐盐性试验培养基:营养肉汤培养基中加入8%的氯化钠。
1.2 仪器与设备
FE20K精密pH计:梅特勒-托利多国际贸易(上海)有限公司;SorvaLLST 16R高速冷冻离心机:美国赛默飞世尔科技有限公司;INFINITE200PRO多功能酶标仪:大臻卓越(北京)科学仪器有限公司;TecanAustria GmbH;ZRD-7140全自动新型鼓风干燥箱:上海智诚分析仪器公司;JF-SX-500高压蒸汽灭菌锅:日本TOMY公司。
1.3 方法
1.3.1 细菌的分离与纯化
取3.9 g样品于35 mL灭菌生理盐水中,室温振荡后,依次进行10倍梯度稀释,每个梯度重复3次。选择不同的稀释度,各取0.1mL分别均匀涂布于营养肉汤固体培养基上,经37℃静置培养24 h后,挑取形态不同的单菌落,经多次划线纯化,得到纯菌株。
1.3.2 细菌的筛选
(1)蛋白酶活力测定:取分离纯化的细菌在20%含盐量培养基上培养,模拟酱油的盐度环境,1 d后测定总蛋白酶活力,蛋白酶活性测定采用福林-酚法[9]。
(2)H2S试验:用200 mL移液枪吸取50 mL菌液,插入距离试管底1 cm处进行接种,37℃条件下培育7 d,观察结果。变黑者为阳性,不变黑者为阴性。生化管呈现黑色则说明此菌株产H2S,筛选出不产H2S的菌株。
(3)生物胺试验:将菌株接种于含1%过滤除菌的酪氨酸的生物胺产生测定液体培养基中,与没有添加氨基酸的生物胺产生测定液体培养基作对照组,37℃条件下培养3~7 d,观察颜色变化,若由黄变紫则说明该菌株氨基酸脱羧酶呈阳性。筛选出不产生物胺的菌株。
1.3.3 细菌的鉴定
(1)形态学鉴定
将筛选出的单一菌株进行培养及革兰氏染色,观察菌株菌落及细胞形态。
(2)生理生化鉴定
参照相关细菌系统鉴定手册[17]。
(3)分子生物学鉴定
将二次活化后的菌液离心取沉淀,使用Ezup柱式动物基因组DNA抽提试剂盒进行DNA的提取,提取的DNA放置于4℃保藏备用。PCR扩增通用引物1:5′-AGAGTTTGA TCCTGGCTCAG-3′;引物2:5′-AAG GAG GTG ATC CAG CCG CA-3′。PCR反应体系:25 μL 2×TaqMaster Mix;2 μL引物1;2 μL引物2;4 μL提取的DNA;17 μL蒸馏水。PCR扩增程序:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,共35个循环;72℃再延伸7 min。通过琼脂糖凝胶电泳对PCR扩增后产物进行分离纯化。PCR扩增产物交由上海生工生物工程股份有限公司进行鉴定。基因序列的测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)上进行BLAST搜索,并在GenBank中进行核酸序列比对分析[10]。
1.3.4 耐盐性试验
耐盐性试验:将菌株接种于耐盐性液态培养基中,37℃条件下培育24 h后,以未接菌的耐盐性液态培养基作为对照,测定波长600 nm处的吸光度值,计算对照组OD600nm值与样品组OD600nm值的比值,通过比值筛选耐盐的菌株[12]。
1.3.5 细菌生长曲线的绘制
用肉汤液体培养基活化菌种,活化菌株以2%的接种量接种于肉汤液体培养基(装液量200 mL/250 mL)中,37℃静置培养,每隔2 h取样,测定菌悬液的OD600nm值,绘制细菌的生长曲线。
1.3.6 细菌的抑菌试验
菌株活化:用移液枪分别取100 μL菌液于10 mL营养肉汤培养基中,37℃培养24 h,为活化一次。菌株进行3次活化,4 000 r/min离心10 min,取沉淀加入灭菌处理过的生理盐水并调整其浓度至107CFU/mL,4℃保存待用。
抑菌试验:以大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)作为抑菌试验的指示菌,吸取0.1 mL稀释后的指示菌菌悬液涂布于营养肉汤培养基上,静置5 min,用直径为6 mm的无菌打孔器打孔,筛选出的菌株的发酵液于4℃、15 800×g离心10 min,取50 μL上清液加入孔中,静置培养24~48 h,观察是否出现抑菌圈,准确记录抑菌圈直径(包括孔的直径)(mm),每株菌做2个平行试验。
1.3.7 氨基酸态氮含量的测定
参照GB/T 5009.39—2003《酱油卫生标准的分析方法》[13]中的甲醛滴定法测定。
2 结果与分析
2.1 菌株的分离纯化结果
本试验经过菌的分离纯化,初步筛出35株菌。
2.2 细菌的筛选
2.2.1 蛋白酶活力测定结果
以吸光度值(y)为纵坐标,酪蛋白质量浓度(x)为横坐标绘制标准曲线,结果如图1所示。
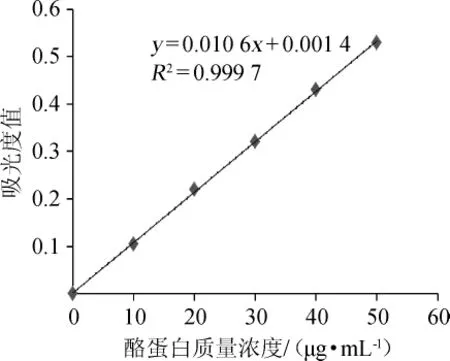
图1 酪蛋白标准曲线Fig.1 Standard curve of casein
由图1可知,酪蛋白标准曲线回归方程为y=0.010 6x+0.001 4,相关系数R2为0.999 7,表明二者线性关系良好。
根据标准曲线,测定不同菌株的蛋白酶活力,结果如图2所示。由图2可知,蛋白酶活力较高的菌株共12株,其中菌株2#、4#、6#、7#、11#的蛋白酶活力达到40 U/g以上。在酱油发酵过程中,蛋白酶降解蛋白质为肽、氨基酸,而氨基酸是风味形成的重要物质,所以菌株的蛋白酶活性越高,越能形成酱油中的优良风味。
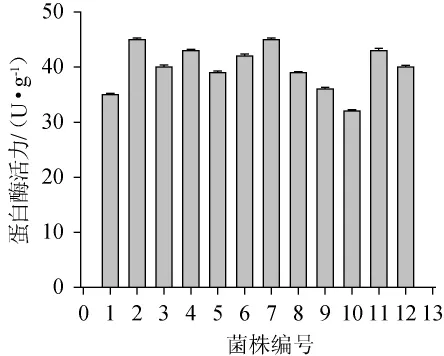
图2 不同菌株的蛋白酶活力比较Fig.2 Comparison of protease activity of different bacterial strains
2.2.2 H2S及生物胺试验结果
在酱油制作过程中,部分微生物发酵会产生H2S、生物胺,赋予产品不好的气味和色泽。硫化氢具有急性剧毒,吸入少量高浓度硫化氢可于短时间内致命,低浓度的硫化氢对眼、呼吸系统及中枢神经都有影响[14]。适量的生物胺有利于人体的健康,但是过量的生物胺会使人体中毒,导致严重的后果,会引起头疼、血压变化、呼吸紊乱、心悸、呕吐等严重反应,另外,腐胺、尸胺、精胺和亚精胺能够与亚硝酸盐反应产生致癌物质亚硝基胺[15-16],所以发酵酱油所选用的优势菌株,要满足不产H2S、生物胺的条件。
将蛋白酶活性试验筛选得出的12株菌进行H2S及生物胺试验,结果如表1所示。由表1可知,筛选出不产H2S和生物胺的菌株5株,菌株编号分别为3#、4#、6#、7#、9#。
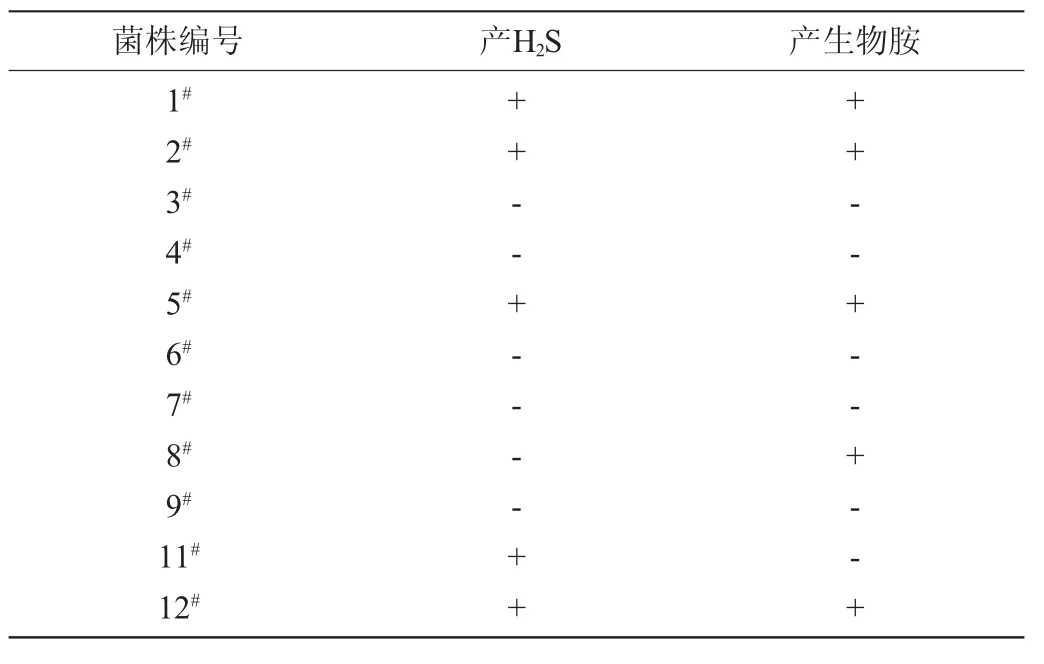
表1 菌株H2S及生物胺试验结果Table 1 Results of hydrogen sulfide and biogenic amines tests
2.3 菌株的鉴定
2.3.1 形态学鉴定
经过革兰氏染色后镜检观察,结果表明,5株菌均呈紫色,为革兰氏阳性杆菌。
2.3.2 生理生化鉴定
5株细菌的生理生化鉴定结果如表2所示,参照相关细菌系统鉴定手册[17],初步鉴定菌株3#、4#、7#为芽孢杆菌属(Bacillus),菌株6#、9#为乳杆菌属(Lactobacillus)。
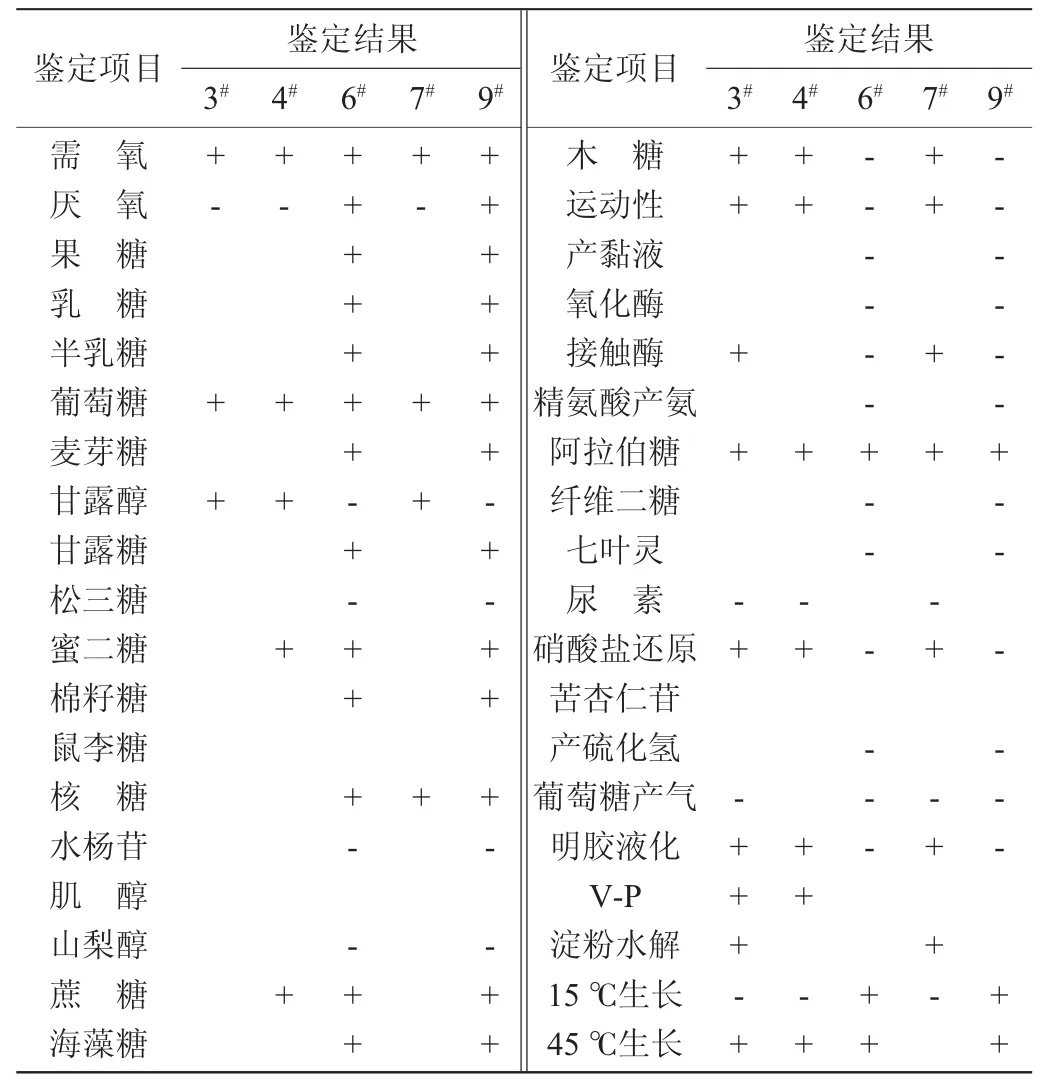
表2 菌株生理生化鉴定结果Table 2 Results of physiological and biochemical identification of strains
2.3.3 分子生物学鉴定
DNA琼脂糖凝胶电泳图结果见图3,16S rDNA序列同源性分析结果见表3。
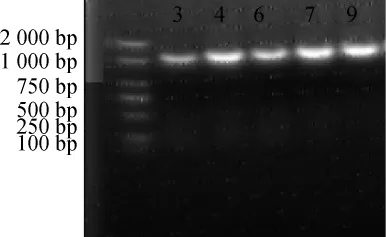
图3 菌株16S rDNA扩增产物电泳图Fig.3 Electrophoretogram of 16S rDNA amplification products of strains
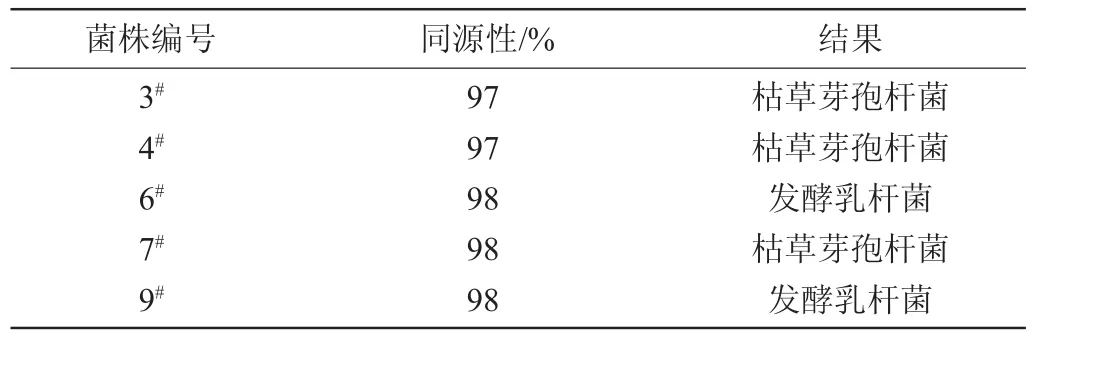
表3 菌株鉴定结果Table 3 Identification results of strains
由图3可知,这5株菌的DNA分子质量在1000~2000bp之间,符合16S rDNA测序要求。由表3可知,通过16S rDNA序列同源性分析,菌株3#、4#、7#与枯草芽孢杆菌(Bacillus subtilis)的同源性达到97%以上,确定这3株为枯草芽孢杆菌;菌株6#、9#与发酵乳杆菌(Lactobacillus fermus)的同源性达到98%,确定为发酵乳杆菌。
2.4 耐盐性试验结果
在酱油制作过程中,在发酵后熟期都不可避免地要添加盐类,除调味和防腐这双重功效外,发酵后期还可以借助盐溶作用提取前期微生物菌体繁殖产生的各种水解酶系,从而为后熟过程中一系列生化反应奠定基础。当食盐达到一定浓度时,会对微生物产生渗透胁迫及毒性作用,使微生物受到抑制甚至死亡[18]。因此菌株对盐类的耐受能力不仅反映了各种细菌在酱油环境中的活性状态,而且对于其发挥功能特性具有重要意义。不同菌株的耐盐性测定结果如图4所示。由图4可知,耐盐性较好的菌株是6#和9#,对照组与样品组OD600nm值的比值在4~5之间,说明发酵乳杆菌的耐盐性强于枯草芽孢杆菌。
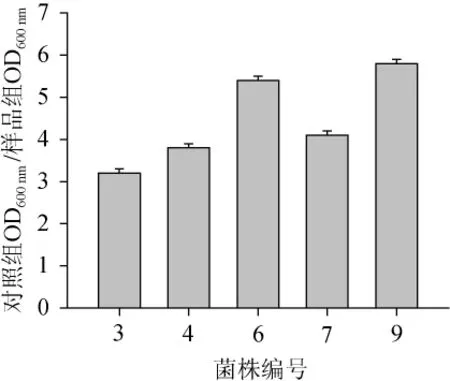
图4 不同菌株的耐盐性比较Fig.4 Comparison of salt tolerance by different strains
2.5 细菌的生长曲线测定结果
菌株的生长曲线反应了菌株的生长能力。5株菌株的生产曲线测定结果如图5所示。由图5可知,5株菌株的生长趋势相似,0~6 h为迟缓期,6~12 h为对数期,12~26 h为稳定期,26~36 h为衰亡期。菌株3#、4#、7#在对数期且稳定期的高峰的OD600nm值较菌株6#、9#的大,说明枯草芽孢杆菌比发酵乳杆菌的生长能力强。
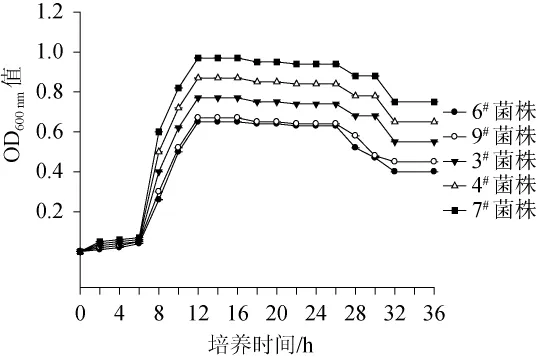
图5 不同菌株的生长曲线Fig.5 Growth curves of different strains
2.6 抑菌试验结果
在酱油发酵过程中,往往伴随着其他微生物的产生,其中,大肠杆菌和金黄色葡萄球菌是豆豉发酵过程中容易滋生的有害微生物[11],所以,抑制大肠杆菌及金黄色葡萄球菌的能力是检测酱油发酵过程中优势菌株的重要指标。5株细菌对大肠杆菌和金黄色葡萄球菌的抑菌圈直径大小见表4。
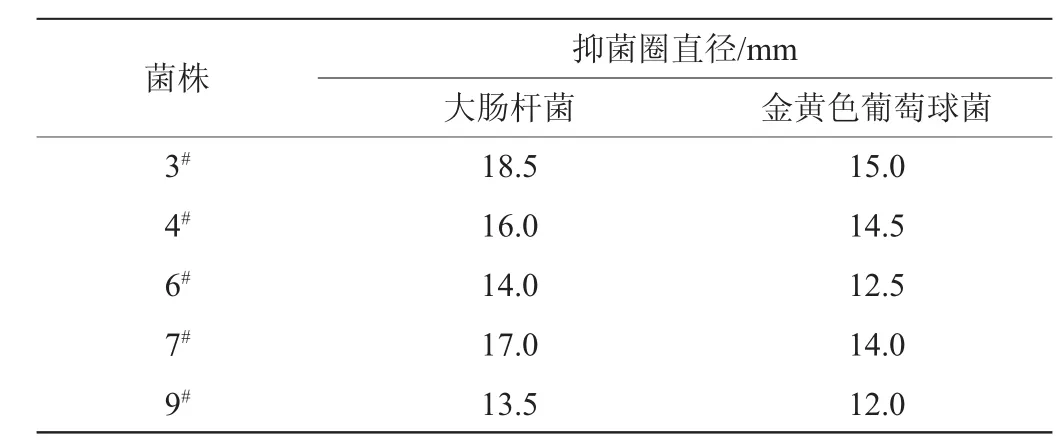
表4 菌株对大肠杆菌和金黄色葡萄球菌的抑菌效果Table 4 Antibacterial ability of strains onEscherichia coliand Staphylococcus aureus
由表4可知,枯草芽孢杆菌3#、4#、7#抑制大肠杆菌的透明圈直径分别为18.5mm、16.0mm、17.0mm,抑制金黄色葡萄球菌的透明圈直径分别为15.0mm、14.5 mm、14.0 mm,较发酵乳杆菌6#、9#的抑菌圈直径大,所以抑菌能力更强。
2.7 氨基酸态氮含量的测定结果
由于氨基酸态氮含量能够反映蛋白的水解程度,所以对不同菌株发酵液中氨基酸态氮含量进行测定,结果见图6。
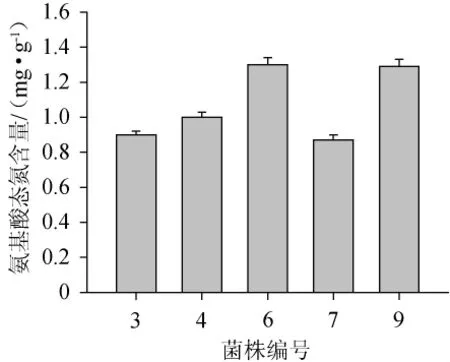
图6 不同菌株发酵液氨基酸态氮含量比较Fig.6 Comparison of amino nitrogen content in fermentation broth of different strains
由图6可知,各菌株发酵液氨基酸态氮含量均高于国标GB/T 5009.39—2003《酱油卫生标准的分析方法》[13],6#和9#菌株的氨基酸态氮含量(均>1.2 mg/g)较高,可见发酵乳杆菌具有更好的蛋白酶降解能力。由于本试验在高盐培养基(20%含盐量)中取样进行分析,充分模拟高盐稀态酱油的高盐环境,具有合理性,因此6#和9#菌株应用于酱油生产中,能得到更高的氨基酸态氮含量。
3 结论
以蛋白酶活力、H2S及生物胺为评价指标,从酱油酿造过程中综合筛选到5株优势细菌,编号分别为3#、4#、6#、7#、9#。经形态学、生理生化特性及16S rDNA基因序列分析,鉴定菌株6#、9#为发酵乳杆菌(Lactobacillus fermus),菌株3#、4#、7#为枯草芽孢杆菌(Bacillus subtilis)。乳杆菌属可防止微生物过量生长,有助于稳定发酵生物区系平衡[19],而芽孢杆菌属作为前期的发酵菌株让产生的酱油口感俱佳[20],同时通过细菌耐盐性、生长曲线、抑菌性试验及氨基酸态氮含量的测定,得知其中发酵乳杆菌的耐盐耐亚硝酸盐性及蛋白降解能力较强,枯草芽孢杆菌的活性和抑菌性较强。因此本研究分离到的菌株可以考虑作为有益菌株应用于酱油的后发酵中。
[1]黄明志,杭海峰.人工神经网络在红霉素发酵过程状态预估中的应用[J].华东理工大学学报:自然科学版,2000,26(2):162-164,176.
[2]梁恒宇,程建军,马 莺.中国传统大豆发酵食品中微生物的分布[J].食品科学,2004,4(11):401-414.
[3]SU N W,LEE M H.Purification and characterization of a novel salt-tolerant protease fromAspergillussp.FC-10,a soy sauce koji mold[J].J Ind Microb Biotech,2001,26(4):253-258.
[4]谢显华.酱油发酵过程微生物群落结构的动态研究[D].广州:华南理工大学,2010.
[5]贾东旭,吴拥军,李耀中,等.细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J].食品科学,2009,6(5):217-221.
[6]王洪升,王素珍,马净丽.耐盐乳酸菌在高盐稀态酱油中的应用[J].中国酿造,2004,23(10):28-30.
[7]陈伯林.耐盐乳酸菌在酱油发酵中的应用[J].现代食品科技,2011,27(11):1340-1343.
[8]胡会萍,刘丹赤,殷丽君,等.豆豉后发酵中优势菌株筛选及其生产性能[J].食品科学,2014,35(17):146-152.
[9]姜锡瑞,段 钢.新编酶制剂实用技术手册[M].北京:中国轻工业出版社,2002:412-418.
[10]张仁凤,陈光静,杨万明,等.豆豉发酵常用毛霉和米曲霉菌株产生物胺能力的评价[J].食品与发酵工业,2017,7(11):1-4.
[11]刘旭辉,杨亚晋,蔡 军,等.豆粕发酵用高产蛋白酶芽孢杆菌的筛选及鉴定[J].饲料工业,2014,5(8):30-32.
[12]杨澜蓝.自然发酵豆豉中优势菌株的筛选及其发酵工业优化[D].扬州:扬州大学,2013.
[13]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T5009.39—2003酱油卫生标准的分析方法[S].北京:中国标准出版社,2006.
[14]张志红.硫化氢对心肌病的保护作用及其机制探讨[D].石家庄:河北医科大学,2017.
[15]高明辉,马立保,葛立安,等.亚硝酸盐在水生动物体内的吸收机制及蓄积影响因素[J].南方水产,2008,3(8):11-24.
[16]王光强,胡 建,夏勇军.食品中生物胺的研究进展[J].食品科学,2016,4(1):10-22.
[17]东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:20-22.
[18]何国庆,丁立孝.食品酶学[M].北京:化学工业出版社,2006:34-42.
[19]宋健华.中国人发明的调料-酱油[J].食品与生活,2013,6(1):44-45.
[20]张艳芳.多菌株制曲促进酶系优化与提高酱油质量的研究[D].无锡:江南大学,2009.

