光谱法研究富勒烯乙二胺衍生物与血清白蛋白的相互作用
杨 华,李燕丽,戚海艳,陈华才,俞梅兰
(1.中国计量大学 材料科学与工程学院,浙江 杭州 310018;2.浙江理工大学 生命科学学院,浙江 杭州 310018)
富勒烯及其衍生物纳米材料新奇的结构,赋予其独特的光、电、磁性质,其超强的清除氧自由基能力、细胞保护、抑制艾滋病病毒(HIV)酶活性、抗菌抗病毒、DNA切割作用,以及在肿瘤治疗和疾病诊断领域诱人的应用前景,充分引起了研究者们的关注.Baati T发现给老鼠喂服溶解在橄榄油中的C60,不仅不会引起慢性毒性,而且会使大鼠寿命相对于对照组延长一倍[1].通过化学反应在富勒烯的表面引入常用的极性基团如羧基-COOH[2]、羟基-OH[3]、氨基-NH2[4]、丙氨酸[5]使碳笼具有良好水溶性,各种水溶性富勒烯及金属富勒烯衍生物的合成克服碳笼固有的疏水性,极大提高其生物相容性及生物利用度,使得这一领域的研究飞速发展,其中羟基化产物富勒醇C60(OH)24和金属富勒醇Gd@C82(OH)22研究最多.尤其引人注意的是,Gd@C82(OH)22在磁共振成像增强剂[6]和抗肿瘤药物[7-9]方面的研究中,表现出优异的性能和极小的生物毒性,商业化前景广阔.毒性顺磁Gd3+屏蔽于Gd@C82(OH)n碳笼中,更能有效地提高驰豫能力,成像增强效率比传统商业造影剂要高得多[10],此外,Gd@C82(OH)n作为抗肿瘤药物不仅可以干扰肿瘤生长和转移,而且对体内和体外正常细胞几乎没有毒性[11].目前,中科院高能物理所赵宇亮院士课题组已经将Gd@C82(OH)22抗肿瘤纳米药物研究成果实现企业转移转化.
最近王春儒等合成并表征具有很好生物相容性和强自由基清除能力的水溶性[12]Gd@C82的乙二胺衍生物Gd@C82-(EDA)8,该合成反应在较为温和的条件下进行,避免了碳笼的潜在破裂[13],更重要的是裸氨基使富勒烯更易于表面功能化[14].目前,有关Gd@C82-(EDA)8与生物大分子血清蛋白相互作用的研究尚未见报道.
蛋白质在生命过程中起着至关重要的作用,与生命的起源、进化和新陈代谢密切相关.药物通过与血浆蛋白结合得以运输,到达受体病变部位,血清白蛋白是血浆中最丰富的蛋白,它可以与大多数内源性和外源性化合物结合[15],其结合模式对药物的吸收、分布、代谢和排泄有很大的影响[16].BSA是药物研究的理想靶蛋白,与HSA具有80%的同源性,是一种重要的转移蛋白.研究BSA与药物相互作用研究是药物分子设计和改造的前提基础,是认识蛋白质生物效应的重要途径.本文通过紫外-可见吸收光谱法和荧光光谱法研究了水溶性C60-(EDA)3和Gd@C82-(EDA)8分别与BSA和HSA的相互作用,对富勒烯氨基衍生物在生物医学中的潜在应用提供基础信息.
1 实验部分
1.1 试剂与仪器
人血清蛋白(HSA纯度≥96%,索莱宝公司),牛血清蛋白(BSA纯度≥96%,上海麦克林生化科技有限公司),Gd@C82甲苯溶液(纯度≥99%,质量浓度为50.42 mg/L,厦门福纳新材料科技有限公司),C60氯苯溶液(本实验室自行分离、提纯的),实验室自行配置Tris-HCl缓冲液(pH=7.4),所有用水均为超纯水,其余试剂均为分析纯.
双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司),型号TU-1901;F-2700荧光分光光度计为日本Hifachi公司所产;电子天平型号为FA124,购于上海舜宇恒平科学仪器有限公司;以及其他实验室常规仪器设备.
1.2 配制储备溶液
用pH=7.4的Tris-HCl缓冲液分别把C60-(EDA)3配成浓度为1.54×10-3mol/L、Gd@C82-(EDA)8浓度为0.98×10-4mol/L、HSA和BSA浓度均为1×10-4mol/L的储备液,保存于4 ℃恒温冰箱,使用前采用上述缓冲液稀释至工作浓度.
1.3 配制空心富勒烯乙二胺衍生物C60-(EDA)3与血清白蛋白的反应溶液
在标号为1~7七支10 mL比色管中依次加入0 μL、20 μL、40 μL、60 μL、80 μL、100 μL、200 μL储备液,然后于上述各管中分别加入BSA 500 μL,最后用pH 7.4的Tris-HCl缓冲液定容至5 mL,充分混合均匀,使C60-(EDA)3浓度分别为0 mol/L、0.62×10-5mol/L、1.23×10-5mol/L、1.85×10-5mol/L、2.46×10-5mol/L、3.08×10-5mol/L、6.16×10-5mol/L,BSA浓度为1×10-5mol/L,置于10 ℃冰箱中反应10 min,以备光谱测试,C60-(EDA)3与HSA的作用研究方法步骤同上.
1.4 配制内包稀土金属富勒烯乙二胺衍生物Gd@C82-(EDA)8与血清白蛋白的反应溶液
在标号为8~14的比色管中依次加入Gd@C82-(EDA)8储备液0 μL、60 μL、120 μL、180 μL、240 μL、300 μL、500 μL重复上述实验步骤,所得Tris-HCl缓冲定容液中Gd@C82-(EDA)8浓度依次为0 mol/L,1.18×10-6mol/L,2.35×10-6mol/L,3.53×10-6mol/L,4.70×10-6mol/L,5.88×10-6mol/L,9.80×10-6mol/L,血清白蛋白浓度同上,以备光谱测试.
1.5 紫外-可见吸收光谱测定
将上述各富勒烯乙二胺衍生物与血清白蛋白作用溶液置于1 cm石英比色皿,以pH=7.4的Tris-HCl缓冲液作为参比,采集190~500 nm范围内的紫外-可见吸收光谱.
1.6 荧光发射光谱测定
将上述各富勒烯乙二胺衍生物与血清白蛋白作用溶液进行荧光光谱测试,设置参数激发狭缝5 nm、发射狭缝5 nm、光电倍增400 V,激发波长选择λex为280 nm,扫描范围设定285~500 nm.
1.7 三维荧光发射光谱测定
将上述各富勒烯乙二胺衍生物与血清白蛋白作用溶液进行三维荧光光谱测试,λex=220~500 nm,λem=250~600 nm,扫描速度=3 000 nm/min,其它参数设置同上.
2 结果与讨论
2.1 紫外-可见吸收光谱
生色氨基酸残基所处微环境变化会改变蛋白质分子构象,进而使生色团吸收光谱发生改变[17].因此,紫外-可见吸收光谱研究小分子化合物与蛋白质相互作用是最简单有效的方法之一,如图1.
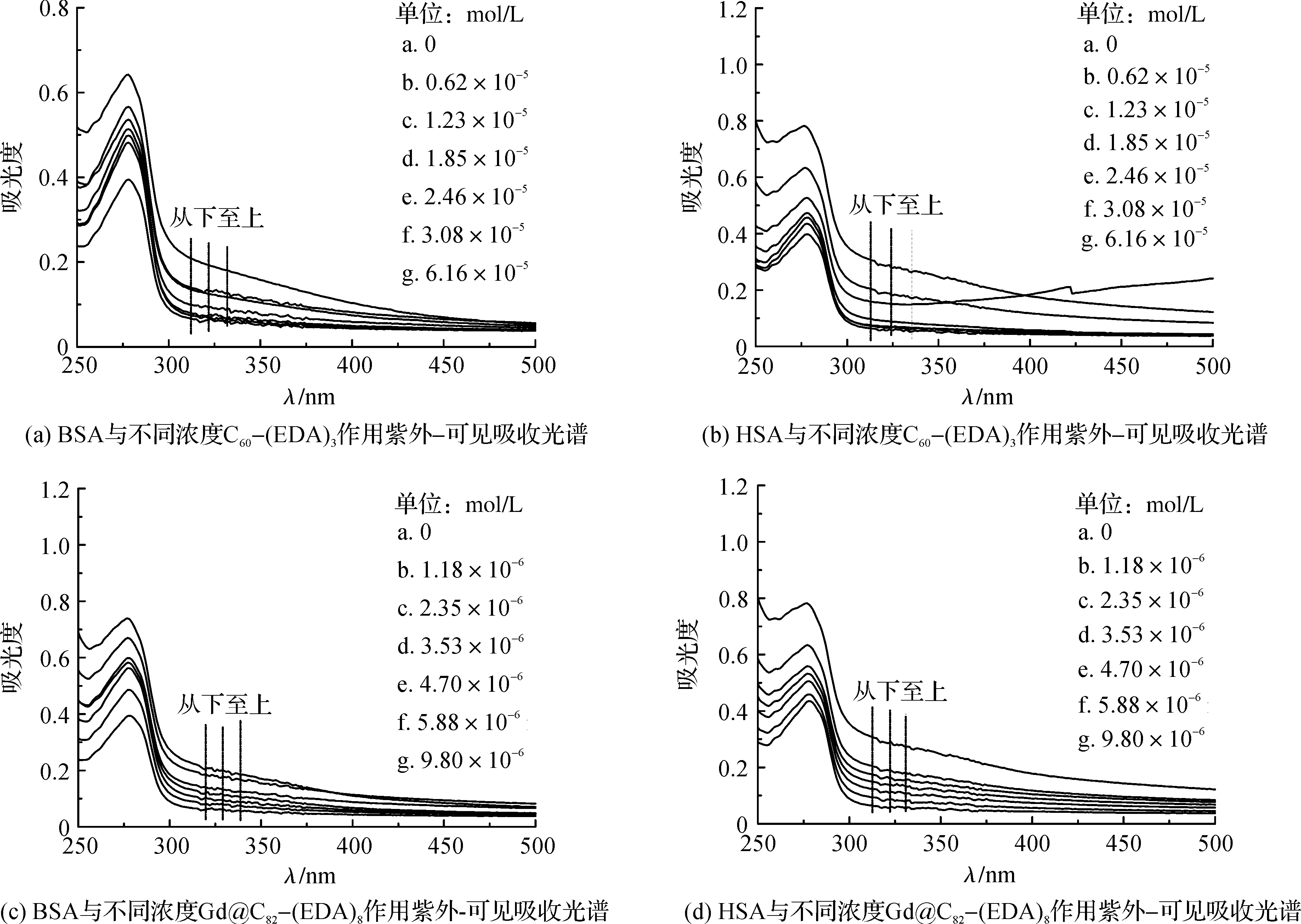
图1 血清蛋白与不同浓度富勒烯乙二胺衍生物作用紫外-可见吸收光谱Figure 1 UV-Visible absorption spectra of interaction of serum protein with different concentrations of fullerene-ethylenediamine derivativeC(BSA,HSA)=1.0×10-5 mol/L,C[C60-(EDA)3]=0 mol/L,0.62×10-5 mol/L,1.23×10-5 mol/L,1.85×10-5 mol/L,2.46×10-5 mol/L,3.08×10-5 mol/L,6.16×10-5 mol/L,C[Gd@C82-(EDA)8]=0 mol/L,1.18×10-6 mol/L,2.35×10-6 mol/L,3.53×10-6 mol/L,4.70×10-6 mol/L,5.88×10-6 mol/L,9.80×10-6 mol/L,反应温度T=283 K.
图1的(a)~(d)为BSA和HSA分别与不同浓度C60-(EDA)3和Gd@C82-(EDA)8相互作用的紫外-可见吸收光谱.C60-(EDA)3和Gd@C82-(EDA)8在波长250~300 nm处吸收峰很弱,可忽略不计.由图1可知,随着C60-(EDA)3/Gd@C82-(EDA)8浓度增加,BSA/HSA在280 nm附近的紫外吸收强度明显增强.图1(a)~(d)其吸光度依次增强了0.25,0.37,0.34和0.34,且最大吸收波长伴随着轻微的蓝移现象,从280 nm移到了278 nm.紫外光谱的峰形和峰位均发生变化,很可能是由BSA和HSA中氨基酸残基的微环境改变,从而改变血清蛋白空间构象,表明药物与BSA和HSA发生了相互作用.
2.2 荧光光谱
图2为BSA和HSA分别与不同浓度C60-(EDA)3和Gd@C82-(EDA)8相互作用的荧光光谱图.

图2 血清蛋白与不同浓度富勒烯胺衍生物作用荧光光谱Figure 2 Fluorescence spectra of interaction between serum protein and different concentrations of fullerene-ethylenediamine derivativeC(BSA,HSA)=1.0×10-5 mol/L,C[C60-(EDA)3]=0 mol/L,0.62×10-5 mol/L,1.23×10-5 mol/L,1.85×10-5 mol/L,2.46×10-5 mol/L,3.08×10-5 mol/L,6.16×10-5 mol/L,C[Gd@C82-(EDA)8]=0 mol/L,1.18×10-6 mol/L,2.35×10-6 mol/L,3.53×10-6 mol/L,4.70×10-6 mol/L,5.88×10-6 mol/L,9.80×10-6 mol/L,反应温度T=283 K.
由图2可知,随着C60-(EDA)3/Gd@C82-(EDA)8浓度的增加,BSA/HSA的荧光强度逐渐减弱,说明C60-(EDA)3/Gd@C82-(EDA)8对BSA/HSA具有明显荧光淬灭作用,且淬灭作用随着药物浓度增大逐渐增强.当C60-(EDA)3浓度为6.16×10-5mol/L时,BSA的荧光强度从4 520 a.u.降低到2 137 a.u.,其荧光淬灭率达到52.7%;而HSA的荧光强度从1 770 a.u.降低到641.6 a.u.,其荧光淬灭率则高达63.8%.当Gd@C82-(EDA)8浓度为9.80×10-6mol/L时,BSA荧光强度从3 598 a.u.降低到2 147 a.u.,其荧光淬灭率为40.3%;HSA荧光强度从1 963 a.u.降低到901.8 a.u.,其淬灭率则为54.1%.C60-(EDA)3使BSA和HSA荧光最大发射波长红移1 nm,而Gd@C82-(EDA)8则使其红移2 nm,且C60-(EDA)3/Gd@C82-(EDA)8对HSA的淬灭率远远大于其对BSA的淬灭率,很可能是BSA与HSA的个别氨基酸序列差异所致.综上所述,C60-(EDA)3/Gd@C82-(EDA)8可以改变BSA/HSA中氨基酸残基微环境,降低其疏水性,从而使血清蛋白分子空间构象发生变化,荧光淬灭.
2.3 三维荧光光谱
三维荧光光谱所含的光谱信息极其丰富,其峰形峰位、指纹信息以及荧光强度可直观反映荧光体分子状态的变化[18].图3是283 K下,相同浓度的BSA/HSA及其与C60-(EDA)3/Gd@C82-(EDA)8相互作用三维荧光等高线剖面图,其中四种相互作用物浓度均为1.0×10-5mol/L.

图3 血清蛋白与等浓度富勒烯乙二胺衍生物作用体系的三维荧光等高线剖面图Figure 3 Three-dimensional fluorescence contour profiles of serum protein with equal concentration fullerenes ethylenediamine derivativesC(BSA,HSA,C60-(EDA)3,Gd@C82-(EDA)8)=1.0×10-5 mol/L,反应温度T=283 K.
由图3可见,与富勒烯乙二胺衍生物作用后,BSA和HSA的指纹特征信息明显减弱甚至消失.加入等浓度C60-(EDA)3后,BSA特征峰位荧光淬灭43.75%,HSA特征峰位荧光淬灭29.6%;加入与Gd@C82-(EDA)8后,BSA特征峰位荧光淬灭71.1%,HSA特征峰位荧光淬灭高达77.9%.相较空心富勒烯C60-(EDA)3,内嵌金属Gd@C82-(EDA)8是淬灭率几乎两倍于C60-(EDA)3.根据图3数据绘制三维荧光光谱等高线剖面图的特征峰位见表1.

表1 血清蛋白与等浓度富勒烯乙二胺衍生物作用体系三维荧光特征峰位Table 1 Three-dimensional fluorescence characteristic peak position of the interaction of serum protein with equal concentration of fullerene ethylenediamine derivatives
由表1看出,其它作用体系没有变化,仅有Gd@C82-(EDA)8与BSA作用会引起特征峰位发射波长红移5 nm,表明该体系相互作用较强.结合图3和表1可得出:Gd@C82-(EDA)8和C60-(EDA)3均显著改变BSA和HSA分子的三维荧光等高线剖面图形状和强度,导致明显的蛋白荧光淬灭.相较于C60-(EDA)3,Gd@C82-(EDA)8淬灭能力远强于C60-(EDA)3.
2.4 荧光淬灭类型
荧光团的荧光淬灭有两种机理,即动态淬灭和静态淬灭[19],前者满足Stern-Volmer线性方程,后者则可用Perrin线性方程来描述[20].
动态淬灭由淬灭剂与荧光物质激发态分子发生相互碰撞,后者损失能量,导致荧光淬灭[21],该过程可用Stern-Volmer线性方程来表示:
F0/F=1+KSVQ.
(1)
静态淬灭则是因为淬灭剂与荧光物质基态分子相互结合,生成不具有荧光的络合物,导致荧光淬灭,该过程满足Perrin线性方程
ln(F0/F)=KPQ.
(2)
就本实验而言,式(1)和(2)中:F0和F分别为淬灭剂C60-(EDA)3或Gd@C82-(EDA)8加入前后血清蛋白BSA或HSA的荧光强度,Q为C60-(EDA)3或Gd@C82-(EDA)8的浓度,KSV为Stern-Volmer动态淬灭常数,KP为Perrin静态淬灭常数.
图4是根据BSA或HSA分别与不同浓度C60-(EDA)3或Gd@C82-(EDA)8相互作用荧光光谱数据而绘制的Stern-Volmer曲线和Perrin曲线,由两种曲线方程分别计算出相应的淬灭常数见表2.

图4 BSA/HSA与不同浓度C60-(EDA)3/Gd@C82-(EDA)8作用Stern-Volmer曲线和Perrin曲线Figure 4 The stern-volmer curves and the Perrin curves for BSA/HSA with different concentrations of C60-(EDA)3/Gd@C82-(EDA)8
由表2可见,与C60-(EDA)3相比,Gd@C82-(EDA)8对BSA/HSA的淬灭常数均明显增大,且四个动态淬灭速率常数Kq的数量级均为1012,远远大于由扩散碰撞引发的荧光淬灭机制该常数最大值2.0×1010L/(mol·s),由此可推断富勒烯乙二胺衍生物对血清白蛋白的淬灭作用不是动态淬灭.

表2 富勒烯乙二胺衍生物与血清白蛋白作用的淬灭常数Table 2 The quenching constants of the interaction of fullerene-ethylenediamine derivatives with serum albumin
KSV为Stern-Volmer动态淬灭常数;KP为Perrin静态淬灭常数;Kq为动态淬灭速率常数.
接下来通过荧光体与淬灭剂作用前后的紫外-可见吸收光谱变化来进一步求证其荧光淬灭类型.通常动态淬灭过程仅涉及到荧光物质激发态分子的能量损失,不会改变荧光体吸收光谱的峰形峰位;静态淬灭过程因伴随荧光体与淬灭剂基态复合物的生成,与淬灭剂作用后荧光体紫外-可见吸收光谱会表现出各别峰位的移动和峰形的改变.

图5 BSA/HSA与等浓度C60-(EDA)3/Gd@C82-(EDA)8作用前后的紫外-可见吸收差谱曲线Figure 5 UV-Visible absorption differential spectra curves of BSA/HSA before and after the interaction of equivalent concentration of C60-(EDA)3/ Gd@C82-(EDA)8C(BSA,HSA,C60-(EDA)3,Gd@C82-(EDA)8)=1.0×10-5mol/L,反应温度T=283 K.
图5(a)~(d)展示出荧光体BSA或HSA分别与等浓度淬灭剂C60-(EDA)3或Gd@C82-(EDA)8相互作用溶液的紫外-可见吸收差谱曲线的获取过程,各图中曲线1为荧光体与淬灭剂作用的紫外-可见吸收光谱,曲线2为淬灭剂单体的紫外-可见吸收光谱,曲线3为荧光体单体的紫外-可见吸收光谱,曲线4为曲线1和曲线2做差得到的紫外-可见吸收差谱曲线.
各图中曲线3均与差谱曲线4不重合,可推断富勒烯乙二胺衍生物能够结合血清白蛋白,生成不具有荧光的基态复合物,蛋白荧光淬灭,该机制为静态淬灭.
2.5 结合常数和结合位点数
BSA/HSA分别与C60-(EDA)3/Gd@C82-(EDA)8的结合常数和结合位点数可采用双对数回归曲线方程[22]来表示:
lg[(F0-F)/F]=lgKa+nlgQ.
(3)
式(3)中:Ka为结合常数,n为结合位点数.
图6是BSA或HSA分别与C60-(EDA)3或Gd@C82-(EDA)8相互作用的lg[(F0-F)/F]对lgQ的关系图,由此构建双对数回归曲线方程并计算结合常数Ka和位点数n,详见表3.

图6 BSA/HSA体系lg[(F0-F)/F]对lgQ的关系图Figure 6 The BSA/HAS system of lg[(F0-F)/F]- lgQ

样品Ka/(×105 L·mol-1)nBSA-C60(EDA)31.9941.105HSA-C60(EDA)31.9161.140BSA-Gd@C82(EDA)86.6941.201HSA-Gd@C82(EDA)816.6140.872
由表3可知:作用体系结合位点数n均在0.872~1.201之间,接近1,结合常数Ka均大于1×105L/mol.C60-(EDA)3与BSA和HSA的结合常数近似相等,但HSA与Gd@C82-(EDA)8的结合常数几乎2.5倍于BSA与Gd@C82-(EDA)8的结合常数,BSA/HSA与Gd@C82-(EDA)8的结合常数8倍于C60-(EDA)3.足见,结合位点数一致的情况下,Gd@C82-(EDA)8与BSA/HSA的结合能力远远超过C60-(EDA)3.
2.6 Gd@C82-(EDA)8数倍于C60-(EDA)3的荧光淬灭能力差异原因
蛋白质生物大分子与药物小分子作用类型主要有氢键作用、范德华力、疏水作用力、静电引力等.Gd@C82-(EDA)8和C60-(EDA)3有相似球状结构,且均含有氨基基团,可与蛋白质中氨基酸残基生成氢键引起蛋白荧光淬灭.Gd@C82-(EDA)8相对于C60-(EDA)3而言,碳笼更大,内嵌Gd向碳笼传递3个电子,碳笼电荷分布为携带-3e负电荷的不饱和开壳层体系,即便键合8个EDA分子,其与蛋白质间的静电引力作用也会远大于C60-(EDA)3中性碳笼体系,导致血清蛋白更大的荧光淬灭.
Gd@C82-(EDA)8内嵌Gd+3具有强顺磁性和对称的电子基态,电子弛豫时间较长,会与蛋白质所含水分子中H磁性核发生作用,改变氨基酸残基疏水环境程度远大于C60-(EDA)3,引起更强的荧光淬灭.
以上结论与报道较多的C60(OH)24和金属富勒醇Gd@C82(OH)22与生物大分子相互作用性能差异一致[23].
3 结 论
本文利用紫外-可见吸收光谱和荧光光谱法来研究C60-(EDA)3和Gd@C82-(EDA)8分别与BSA/HSA的相互作用机理.C60-(EDA)3/Gd@C82-(EDA)8导致BSA/HSA的紫外-可见最大吸收波长由280 nm蓝移至278 nm,BSA/HSA作用前后的紫外-可见吸收差谱曲线不能完全重合,支持作用体系为静态淬灭机制.
C60-(EDA)3和Gd@C82-(EDA)8对BSA和HSA均具有明显荧光淬灭作用,且淬灭作用随着药物浓度增大逐渐增强,其机制为静态淬灭.相同条件下HSA的淬灭率明显大于BSA;C60-(EDA)3和Gd@C82-(EDA)8与BSA和HSA的结合常数均近似为1的情况下,Gd@C82-(EDA)8与BSA的结合常数3倍于C60-(EDA)3,与HSA的结合常数8倍于C60-(EDA)3.
Gd@C82-(EDA)8数倍于C60-(EDA)3的荧光淬灭能力可能是由于相较于中性碳笼C60-(EDA)3,内嵌Gd使得Gd@C82-(EDA)8碳笼携带-3e负电荷,与血清蛋白的静电引力作用增强,导致更大淬灭;还可能是强顺磁Gd3+与蛋白质所含水分子中H磁性核发生作用,改变氨基酸残基疏水环境程度远大于C60-(EDA)3,引起更强的荧光淬灭.
该实验研究结果可为后续富勒烯乙二胺衍生物在清除氧自由基能力、细胞保护、抑制艾滋病病毒(HIV)酶活性、抗菌抗病毒、DNA切割作用,以及在肿瘤治疗和疾病诊断领域一系列生物医学领域的应用提供基础信息.

