抑癌基因与癌基因的最新研究进展
李海丽,邵驰浩,周若宇,张永进,李 翠,罗 瑛
(昆明理工大学 医学院 衰老与肿瘤分子遗传学实验室, 云南 昆明 650500)
肿瘤的发生及发展是一个逐级进行的复杂生物学过程,机体内原癌基因的激活和抑癌基因的失活是肿瘤发生的本质原因。抑癌基因是一类可抑制细胞增殖从而潜在抑制癌变作用的基因。正常情况下,抑癌基因通过抑制细胞周期,或促进细胞凋亡来达到监控细胞内增殖信号,防止细胞异常增殖来达到抑癌的功能。这种作用可能是通过转录调控来达成,如TP53基因;也可能通过直接调控细胞周期的进程,如p21基因和p16INK4a基因;也可能通过调控p53蛋白的稳定性,如p14ARF基因;也可能通过抑制癌基因的活性,如Rb和 PTEN基因。相反,癌基因的功能则是通过促进细胞增殖,阻止细胞凋亡来达到使肿瘤逃逸周期抑制,从而使细胞失控生长,如MDM2。这种作用可能通过直接转录激活生长信号通路或是直接促进细胞周期,或是通过降解抑癌基因来促进细胞的增殖。
1 抑癌基因p53
P53是一个抑癌基因,也是一个重要的转录因子。正常情况下, 野生型p53(wtp53)会与其靶基因HDM2/MDM2形成负反馈机制,因此wtp53蛋白在机体内的表达水平比较低。在人类的恶性肿瘤中普遍存在p53的突变[1],突变的p53(mutp53)会丧失野生的p53(wtp53)所具有的维持基因组稳定性的抑癌基因特性,这称为突变p53的“功能缺失”(loss of function);同时,mutp53获得类似癌基因的特性,这称为突变p53的“功能获得”(gain of function)。mutp53在人类的急性骨髓白血病、角化棘皮瘤和鳞状细胞癌中以癌基因的形式高表达,在骨髓增生异常综合征的患者中,60%的患者伴随有抑癌基因p53点突变[2- 3]。mutp53 R175H和mutp53 R273H就完全失去了wtp53蛋白的抑癌功能,在很多临床肿瘤样本中高表达,表现为促癌作用[4- 5]。Mutp53也可以与癌基因或原癌基因协同作用表现促癌作用。在小鼠体内,突变p53N236S与癌基因Ras协同作用也具有明显的促癌作用[6]。那么当p53是野生型的状态下,是否也会表现出促癌的作用呢?氧化偶氮甲烷(azoxymethane,AOM)模型,是一种能强力诱发大肠癌的药物动物模型。在AOM模型中,ARF- p53通路的激活,会使得MDM2完全处于抑制状态(图1),若wtp53的转录激活区没有完全被激活,其下游的凋亡程序就不会启动。在AOM诱导的结肠癌细胞AJ02-NM0中,MDM2被抑制表达,MDM2对其的负反馈调节作用导致wtp53却具有促癌的作用[7]。这个模型颠覆了以往wtp53是抑癌基因的观点,同时为临床靶向p53治疗肿瘤提供重要的理论依据。
2 抑癌基因pten
Pten(phosphatase and tensinhomolog deleted in chromosome10)于1997年开始作为一种抑癌基因出现在研究者的视野中,其结构包括磷酸酶区域、与脂质结合的C2区域和羧基端区域。其中pten的氨基端区域所包含的酪氨酸磷酸酶,使其具有脂质磷酸酶和蛋白磷酸酶得双重活性;而pten结构的C2区域的突变会下调pten与膜的亲和能力;pten的羧基端区域是肿瘤的易突变区。在人类多种恶性肿瘤中均会出现pten缺失、突变或是被抑制[9]。那么pten的突变给临床肿瘤治疗带来那些影响呢?在恶性子宫肌瘤、星形细胞瘤(PMAs)及乳腺癌中,pten占有很高的突变率[10- 11]。Pten结构中羧基端的突变,会使肿瘤细胞发生恶性增殖,因此有研究者提出可以根据pten突变的区域来分析肿瘤的分期。其在肿瘤中的突变及失调也提示了pten蛋白可能存在转录及翻译后水平的调控机制。pten蛋白在细胞中主要是通过磷脂酰肌醇3激酶(phosphatidylinositol3 kinase,P13K)/蛋白激酶B(AKT)信号通路调控细胞周期、衰老、凋亡及分化等多种生理过程。当pten蛋白失去磷酸酶的活性时,就会失去对AKT信号途径的抑制作用,AKT会大量聚集,过度活化的AKT导致癌细胞迁移、增殖及周围血管的大量生成,进而促进肿瘤细胞的存活。这就提示了pten在肿瘤抑制信号通路中的抑癌作用还需要继续探索。
3 抑癌基因INK4a/ARF
细胞周期依赖性激酶抑制剂(cyclin-dependent kinase inhibitors,CKI)的INK4a家族所编码的基因被公认为是重要的抑癌基因[12],分别是:p16INK4a和p14ARF(小鼠中是p19ARF)。与p16INK4a不同的是p14ARF能够和p53负调节因子 MDM2 (murine double minute 2)结合,抑制MDM2的表达。当ARF被诱导过表达时,MDM2会受限于细胞核中,p53就会在核质中大量聚集,进而引起细胞周期阻滞,凋亡及衰老[13](图1)。特异蛋白- 1(specificity protein 1,AP- 1)在调节细胞增殖、分化及Ras信号通路方面具有重要的作用。当细胞周期发生阻滞,AP- 1二聚体会激活p14/p19ARF转录调控作用,p14ARF会依赖于p53/p21信号通路来行使其抑癌功能。在HCT116细胞中敲除p21Cip1/WAF- 1和14- 3- 3δ时,会引起细胞周期阻滞及凋亡,反而p14ARF表达量升高,表现为p14ARF促癌作用[14]。p16INK4a通过调控细胞周期依赖激酶CDK4/6及cyclin D复合物的活性,在细胞周期中也扮演着重要的角色。p16INK4a的变异及表观遗传的畸变均会引起肿瘤的发生[12]。因此在肿瘤的发生过程中,常会出现p16INK4a和p14ARF的变异、丢失、甲基化或是上游信号通路调控异常[15- 16],使得p16INK4a和p14ARF在肿瘤发生及进展过程中起到促进作用。
4 抑癌基因Rb
Rb(retinoblastoma)基因是最早发现于视网膜母细胞瘤(retinoblastoma,Rb)的一种抑癌基因, 其产物Rb蛋白位于细胞核中,存在磷酸化和非磷酸化状态。磷酸化的Rb蛋白基本失去功能,释放与其结合的转录因子E2F1,E2F1会启动下游的蛋白表达,Rb/E2F1的调控处于细胞周期的重要环节,可以引起细胞周期的阻滞,反而非磷酸化的Rb蛋白相对活跃[17]。Rb蛋白还具有抑制细胞凋亡的功能,尤其在肿瘤细胞中,可以促进肿瘤细胞的增殖,因此Rb蛋白对肿瘤细胞的作用存在异议。在卵巢癌的肿瘤组织中Rb蛋白高表达。在喉癌中Rb基因的表达与其发病有很大的相关性,随着喉癌恶性程度的增加,Rb基因突变率不断增加,Rb基因的突变可能参与了喉癌的发生及恶化的过程[18]。在宫颈癌的发生的机制中,E7原癌基因可以促进转录激活因子CBP与pRb的结合,导致细胞周期紊乱进而发生癌变。在肉瘤细胞中,Rb-E2F1通路也表现为调控异常。在肾细胞癌及头颈部癌中发现Rb蛋白的高度甲基化及突变[19]。因此,几乎大多数的肿瘤中会出现Rb的缺失、甲基化、突变失去功能或通过改变其上游的转录调控因子而导致Rb蛋白表达量或活性的改变。在不同肿瘤背景下,Rb的状态、功能及所涉及的通路均表现出不同的生物学意义。
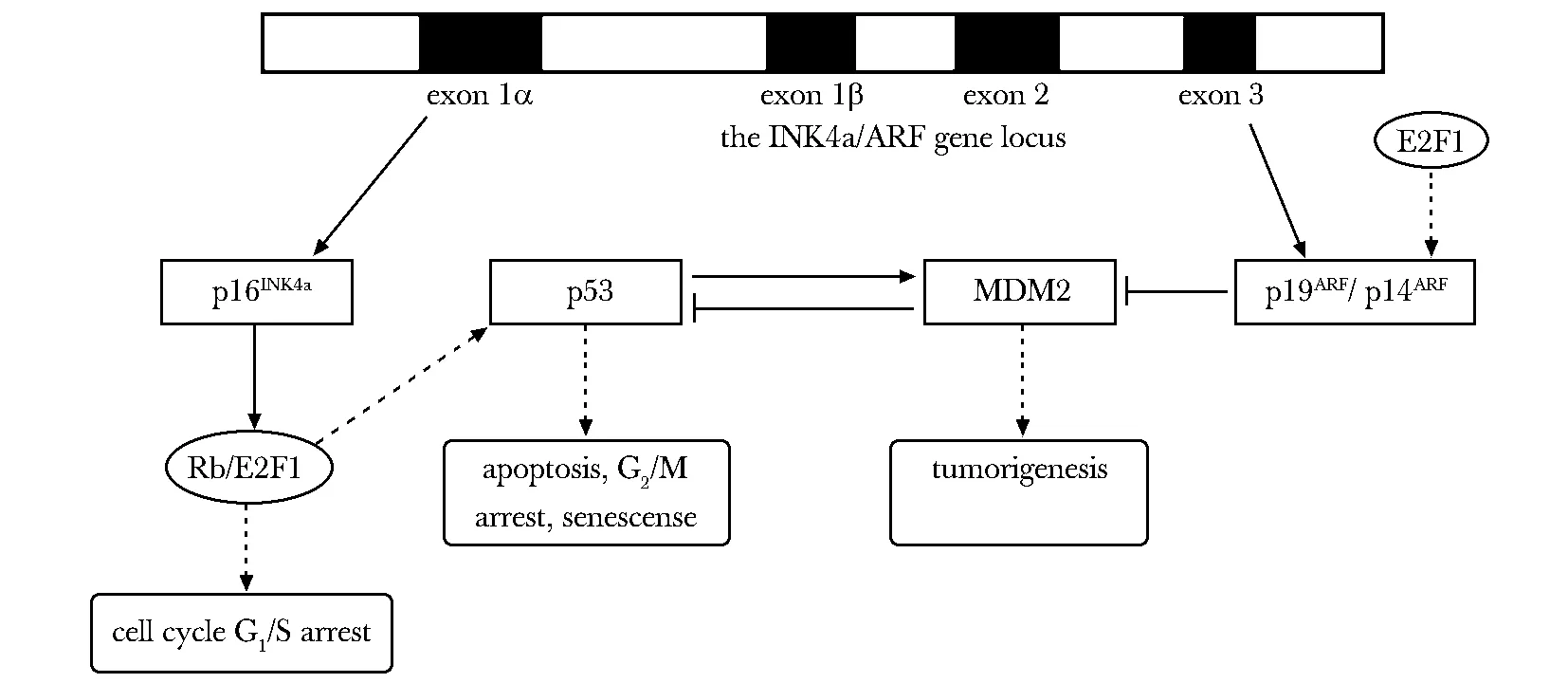
图1 p16INK4a/RB/E2F1 和 p14ARF/p53/MDM2 通路Fig 1 Schematic representation of the p16INK4a/RB/E2F1 and p14ARF/p53/MDM2 pathways
5 原癌基因MDM2
MDM2 (murine double minute 2)最早是从异常染色体上克隆出来的,这些染色体容易引起机体的异常增生及肿瘤的形成,因此MDM2也被认为是癌基因。MDM2可以与p53的N-转录激活区结合,从而抑制p53对其下游基因的转录功能,这种结合就是MDM2与p53之间负反馈作用(图1)。因此可以得出MDM2的促癌作用是需要抑癌基因p53的相互作用。但是这种负反馈机制并不是永恒的,即当DNA发生损伤时会需要大量p53蛋白的表达,这个时候磷酸化的p53会逃脱掉与MDM2的结合,同时自身磷酸化的MDM2也会减弱与p53的结合作用,使得p53发挥修复DNA的作用即抑制肿瘤发生,MDM2也在一定程度上发挥了抑癌的功能[20]。MDM2敲除的小鼠,p53会大量的表达,导致小鼠胚胎无法存活;同时敲除MDM2和p53,小鼠却呈现成瘤倾向[21],这也说明MDM2与p53之间负反馈机制的有偿性。在人类的肿瘤中p14ARF才是MDM2的抑制剂[15],在野生型p53及MDM2表达的肿瘤样本中发现,ARF突变出现高表达,而p53并没有明显的抑制作用。可以看出MDM2在肿瘤的形成过程中有两条负反馈的通路参与,其中ARF占主要地位,尤其是当p53发生异常时,ARF会抑制MDM2的作用,直接诱导细胞凋亡的发生,这种细胞背景下MDM2则表现为抑癌功能。
抑癌基因是生物体细胞中存在的保护机体免于癌变的基因, 该类基因若发生点突变、易位、重排等则会表现为癌基因的功能[22- 23]。抑癌基因的抑癌作用或癌基因的抗癌作用不是某个基因的行为,其是多个基因的协同作用,在卵巢癌上皮细胞癌中就表现出p14、p16和p53蛋白的高表达[24],在鳞状细胞癌中也表现出p16与KI67的协同促癌作用[25]。现在对抑癌基因的促癌功能或者癌基因的抑癌功能还不是很清楚,但这种转换机制也可能是生物界长期进化的结果,即依赖细胞内微环境的变化及基因突变。随着对癌基因与抑癌作用研究的不断深入,相信癌基因或抑癌基因的转换机制会给临床治疗肿瘤提供充实的理论依据。

