下调高迁移率族蛋白B1对宫颈癌细胞侵袭、迁移的影响及机制
杨群,李丽
(1四川省人民医院,成都610072;2四川大学华西医院)
宫颈癌是女性常见的恶性肿瘤之一,在全球范围内妇科恶性肿瘤中发病率位居第二,全球平均每年有53万新发宫颈癌病例,宫颈癌总体病死率达50%,其中发展中国家的宫颈癌病死率超过85%[1]。宫颈癌的复发及转移是影响宫颈癌患者预后的重要原因[2]。高迁移率族蛋白B1(HMGB1)在多种肿瘤中存在过表达,与肿瘤发生及预后相关[3~5]。HMGB1在宫颈癌中也存在过表达,并且与宫颈癌转移和复发等恶性肿瘤表型密切相关,是宫颈鳞状细胞癌早期诊断的预测指标和独立预后因素[6,7]。胞外释放的HMGB1与细胞膜上的Toll样受体4(TLR4)结合,可以激活下游信号传导通路,如磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)、核因子-кB(NF-кB)通路,这将导致基因的过表达以及肿瘤细胞生物学行为的改变。然而,宫颈癌细胞外释放的HMGB1能否与宫颈癌细胞膜上的TLR4结合并激活TLR4/NF-κB和TLR4/PI3K/Akt信号通路,以及对宫颈癌细胞侵袭和迁移能力产生的影响还不清楚。2017年10月~2018年1月,我们观察了下调HMGB1对TLR4/NF-κB和TLR4/PI3K/Akt信号通路相关蛋白表达的影响,及其对宫颈癌细胞侵袭、迁移能力的影响。
1 材料与方法
1.1 材料 人宫颈癌SiHa细胞购自美国Hyclone生物公司。DMEM高糖培养基(美国Hyclone生物公司),正丁酸钠(美国Sigma-Aldrich试剂公司),GAPDH(海基生物科技有限公司),HMGB1、TLR4等抗体(美国Abcam试剂公司),兔抗鼠GAPDH单克隆抗体(美国Cell Sigaling Technology试剂公司),辣根过氧化物酶(HRP)标记羊抗兔IgG(美国Cell Sigaling Technology公司),牛血清白蛋白(BSA,美国Sigma生物科技公司),溴酚蓝(BPB,上海信帆生物科技公司),Tris-HCl(湖北武汉博士德生物工程公司),Tris(中国Biosharp生物科技),SDS-PAGE凝胶试剂盒(湖北武汉拜意尔生物),BCA蛋白浓度检测试剂盒(美国Thermo公司),ECL化学发光显色试剂盒(湖北武汉谷歌生物公司),MTT检测试剂盒(南京凯基生物公司),Transwell小室模型(BD Biosciences有限公司),SYBR®Premix Ex TaqTM(日本TaKaRa生物工程公司)。
1.2 细胞培养与分组 将SiHa细胞加入含10%胎牛血清的RPMI-1640培养基,置于37 ℃、5% CO2培养箱内孵育,经过3~4次细胞传代,取对数生长期细胞用于实验。将细胞分为对照组和实验组,对照组加入0.01% DMSO、实验组加入HMGB1抑制剂正丁酸钠0.5 mmol/L处理24 h。
1.3 细胞迁移和侵袭能力观察 采用Transwell小室实验。将基质胶加入Transwell小室上室,放入37 ℃、5% CO2培养箱静置成胶;下室中加入含20%胎牛血清的培养基,37 ℃、5% CO2孵箱中培养30 min。将两组细胞加入胰蛋白酶消化,制成单细胞悬液,按1×104/孔加入上室。24 h后以4%多聚甲醛固定15 min,苏木素染色10 min,自来水冲洗,伊红染色2~3 min,蒸馏水冲洗。用手术刀片沿外周切下Transwell膜,置于载玻片上,中性树胶封片。随机选出10个视野在显微镜下观察、拍照,计数每个视野下的完整细胞数,取平均值,实验重复3次。迁移实验步骤同侵袭实验,Transwell小室无需进行铺胶处理,细胞数目为1×105/孔。以穿膜细胞数表示细胞的迁移和侵袭能力。
1.4 HMGB1及TLR4/NF-кB信号通路相关分子[TLR4、NF-кB、整合素av、整合素β3、原肌球蛋白1(TPM1)、丝氨酸蛋白酶抑制剂(maspin)]、TLR4/PI3K/Akt信号通路相关分子(p-PI3K、p-Akt、整合素β1)mRNA表达检测 采用实时荧光定量PCR法。采用TRIzol法提取两组细胞总RNA,逆转录合成cDNA。取PCR产物各10 μL,于EB染色的1.5%琼脂糖凝胶40 V恒压电泳50 min,取出凝胶后在凝胶成像分析系统进行拍照并分析。以2-ΔΔCt法计算目的基因的相对表达量。
1.5 HMGB1及TLR4/NF-κB、TLR4/PI3K/Akt信号通路相关分子蛋白表达检测 采用Western blotting法。取对数生长期细胞,加入胰蛋白酶消化,制成细胞悬液。移入直径10 cm的培养皿中,置于37 ℃、5% CO2恒温培养箱中培养24 h,使细胞贴壁生长。向培养皿内加入I3C,终浓度分别为0、100、200、300 μmol/L。于37 ℃、5% CO2恒温培养箱中培养48 h。弃培养液,PBS洗涤,加入细胞裂解液,提取细胞总蛋白,BCA定量法检测蛋白浓度。SDS-PAGE凝胶电泳,转PVDF膜;封闭2 h后,加入1∶1 000配置的一抗,4 ℃孵育过夜;洗膜后加入1∶8 000的羊抗兔二抗(过氧化物酶HRP标记),室温下孵育;洗膜后进行ECL显色,按照ECL显色试剂盒进行操作。以目的蛋白与内参灰度比值表示各蛋白的相对表达量。
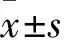
2 结果
2.1 两组细胞迁移和侵袭能力比较 对照组迁移和侵袭实验中的穿膜细胞数分别为(80.8±1.8)、(55.2±2.9)个,实验组分别为(62.4±1.1)、(42.2±2.4)个。实验组穿膜细胞数均少于对照组(P均<0.05)。
2.2 两组TLR4/NF-κB和TLR4/PI3K/Akt信号通路相关分子mRNA表达比较 与对照组相比,实验组HMGB1、TLR4、NF-кB p65、整合素av、整合素β3、整合素β1 mRNA表达下降,TPM1、maspin mRNA表达升高(P均<0.05)。见表1。

表1 两组TLR4/NF-κB和TLR4/PI3K/Akt信号通路相关分子mRNA表达比较
注:与对照组相比,*P<0.05。
2.3 两组TLR4/NF-κB和TLR4/PI3K/Akt信号通路相关分子蛋白表达比较 与对照组相比,实验组HMGB1、TLR4、NF-кB p65、整合素av、整合素β3、整合素β1蛋白表达下降,TPM1、maspin蛋白表达升高(P均<0.05)。见表2。

表2 两组TLR4/NF-κB和TLR4/PI3K/Akt信号通路相关分子蛋白表达比较
注:与对照组相比,*P<0.05。
3 讨论
HMGB1可以促进肿瘤细胞侵袭和迁移,影响宫颈癌患者的预后。Li等[8]报道,沉默HMGB1的表达可有效抑制胃癌细胞的侵袭和转移。Chen等[9]采用cDNA微矩阵法检测高侵袭性和低侵袭性的卵巢癌细胞株基因表达的差异,证实HMGB1在卵巢癌高侵袭株中的表达显著高于低侵袭株中的表达,且在敲除HMGB1基因后,有效抑制了细胞的侵袭和迁移。我们的前期研究显示,对于宫颈癌患者,HMGB1的外释放可以促进宫颈癌细胞的侵袭和迁移能力。另外,作为HMGB1的受体,TLR4下游许多信号通路与肿瘤细胞的侵袭和迁移能力相关[10]。
本研究观察了宫颈癌细胞中HMGB1对TLR4/NF-кB信号通路相关分子(TLR4、NF-кB、整合素av、整合素β3、TPM1、maspin)、TLR4/PI3K/Akt信号通路相关分子(p-PI3K、p-Akt、整合素β1)以及宫颈癌细胞侵袭和迁移能力的影响。结果显示,在宫颈癌细胞中,抑制HMGB1的表达可以下调TLR4下游信号通路的表达,从而抑制宫颈癌细胞的侵袭和迁移能力。在宫颈癌细胞中,HMGB1可以通过与TLR4结合,激活TLR4/NF-кB相关的信号传导通路,促进宫颈癌细胞侵袭迁移能力。NF-кB信号通路与肿瘤细胞的侵袭和迁移能力有密切联系。多项实验证明,HMGB1可能通过调控NF-кB信号通路来影响肿瘤的生长[11]。Jube等[12]研究表明,在恶性间皮瘤中,HMGB1可以通过激活NF-кB信号传导通路增加肿瘤的恶性程度和促进转移。有研究报道,HMGB1可以通过激活NF-кB相关的信号传导通路促进肿瘤细胞迁移能力[11]。Eiro等[13]研究证实,TLR4可以通过NF-кB信号通路在结肠癌的发生和发展中发挥重要作用。Liao等[14]研究表明,在转移的乳腺癌细胞中,激活的TLR4可以通过NF-кB信号传导通路促进整合素avβ3介导的乳腺癌细胞的黏附和侵袭性转移。整合素是细胞黏附分子家族的重要成员,主要通过介导细胞与细胞、细胞与细胞外基质(ECM)之间的相互黏附,并介导细胞与ECM之间的双向信号传导而发挥其作用。整合素αvβ3由av和β3亚单位组成,可以与多种配体结合,表现在多种细胞中,参与到肿瘤的侵袭转移、血管生成、伤口愈合、凝血和炎症等生理以及病理的过程中。整合素对肿瘤血管生成起着重要作用,多种肿瘤表面和新生血管内皮细胞中整合素有较高的表达。在众多的整合素中,整合素αvβ3的作用尤其重要。Liao等[14]研究表明,整合素avβ3是血流中介导肿瘤细胞停滞和侵袭性迁移的过程中的关键整合素。在乳腺癌中,整合素avβ3在侵袭性肿瘤和转移灶中表达上调,故可以用整合素avβ3来描绘转移性表型。整合素avβ3表达水平可能显著影响血流中乳腺癌细胞停滞和转移能力。研究显示,TLR4的配体可能在转移性乳腺癌中通过激活NF-кB信号通路而促进整合素avβ3的表达。研究结果中,使用HMGB1抑制剂的SiHa细胞中,TPM1和maspin表达量降低。肿瘤细胞侵袭性迁移可能受到TPM1和maspin的限制,这两者都可以阻断基质蛋白水解作用来抑制肿瘤细胞的侵袭。在乳腺癌细胞MDA-MB-231中提高TPM1或者maspin的表达可以抑制细胞的侵袭及迁移。研究显示,TLR4信号通路能够调节这些基因以及整合素avβ3的表达,由此来促进转移性乳腺癌细胞侵袭及迁移。TLR4信号通路通过激活NF-кB来降低TPM1和maspin表达。然而这些基因并不是NF-кB直接的靶向基因,因为NF-кB并不会影响这些基因的转录活动。NF-кB事实上是通过上调肿瘤细胞中miR-21的表达来降低TPM1和maspin表达。NF-кB可以被一些致癌基因激活,持续的NF-кB激活可以在大多数乳腺癌细胞中发现。而TLR4信号通路可以进一步增加NF-кB的激活。
本研究显示,在宫颈癌细胞中HMGB1可以通过与TLR4结合,激活TLR4/PI3K/Akt相关的信号传导通路,促进宫颈癌细胞侵袭和迁移能力。PI3K/Akt信号通路与肿瘤细胞的侵袭和迁移能力有密切联系。有研究表明,Akt信号通路在恶性肿瘤的进展中有重要作用[15]。Akt在所有类型的细胞和组织中都有表达。Akt可以提高细胞存活率并成为有效的抗肿瘤靶标。临床上Akt的活性增加可以导致胃癌的进展和细胞增殖,而且Akt也参与到神经胶质细胞的细胞存活和增殖的信号传导通路中。由此可知阻断Akt信号通路可以成为潜在的靶向治疗策略。在肿瘤细胞中,TLR4与配体的结合可以激活下游PI3K/Akt途径,上调IRAK-4表达,促进血管内皮生长因子、粒细胞巨噬细胞集落刺激因子,导致肿瘤形成[16]。Hsu等[10]的研究显示,在结肠癌细胞中使用LPS激活TLR4信号传导通路可以促进整合素β1介导的结肠癌细胞的黏附和肝转移,用LPS刺激TLR4/MD2复合体可以激活PI3K/Akt信号通路,从而促进下游的整合素β1的功能,由此增加结肠癌细胞的黏附性和转移的能力。包含β1亚单位的整合素主要是介导细胞与细胞外基质成分之间的黏附,故整合素β1表达增加可以促进肿瘤细胞的黏附能力,进一步促进肿瘤细胞的侵袭和迁移。
综上所述,在宫颈癌细胞中,下调HMGB1表达可使TLR4下游信号传导通路分子的表达下调或上调,最终导致SiHa细胞的侵袭和迁移能力下降,说明HMGB1可以通过激活TLR4的两条通路,增强宫颈癌细胞的侵袭和迁移能力。HMGB1以及TLR4/NF-кB、TLR4/PI3K/Akt信号传导通路分子,尤其是其中起着关键作用的HMGB1和TLR4,可以作为未来宫颈癌靶向治疗的研究对象。

