γ-聚谷氨酸对面筋蛋白冻藏稳定性的影响
谢新华 毋修远 张 蓓 徐 超 张艳杰 沈 玥
(1.河南农业大学食品科学技术学院,郑州 450002; 2.农业部大宗粮食加工重点实验室,郑州 450002)
0 引言
冷冻面制品具有安全、便捷的优点,但冷冻储藏后产品品质劣变和稳定性下降的缺点也十分明显。作为面制品的重要影响因素,小麦面筋蛋白由醇溶蛋白和谷蛋白组成,能通过吸水形成三维网络结构并对面团持水率以及流变学性能产生影响[1]。在小麦面筋蛋白冻藏过程中,会出现冰晶生长及温度不稳定所产生的重结晶现象,其导致的面筋网络结构物理性破坏是面筋蛋白品质劣变的主要因素之一[2],现阶段解决方法主要有对冷冻工艺的优化、添加改良剂如抗冻蛋白、食用胶等[3-5],且对亲水胶体、抗冻蛋白等抗冻剂的研究报道大都集中在对冷冻面团品质的改善等方面。
γ-聚谷氨酸(Poly-γ-glutamicacid,γ-PGA)是一种多聚氨基酸类的环保型多功能生物可降解高分子材料[6]。MITSUIKI等[7]研究发现γ-PGA是有效的冷冻保护剂,且添加对味道影响较小。SHIH等[8]研究发现γ-聚谷氨酸抗冷冻能力随分子量下降而增加,并在食品、菌种以及酶的保存中得以应用。KUMIO等[9]研究发现,添加γ-PGA可提高冷冻面团中酵母细胞的存活率,增强酵母耐冻性能。本文旨在研究冻藏条件下γ-聚谷氨酸对面筋蛋白抗冻性能的影响,采用核磁共振仪器(NMR)、傅里叶变换红外(FITR)、差示扫描量热仪(DSC)、热重分析仪(TGA)、动态流变仪(DHR)和扫描电子显微镜(SEM)对冻藏过程中冷冻面筋蛋白体系的水分分布、蛋白二级结构、热力学特性、流变学特性及微观结构进行测定,揭示γ-PGA对面筋蛋白冻藏稳定性影响的作用机制,为γ-PGA作为一种抗冻剂添加在冷冻面制品中提供基础研究依据。
1 材料与方法
1.1 材料
面筋蛋白购自一加一天然面粉有限公司,蛋白质质量分数82%。γ-聚谷氨酸购自西安四季生物科技有限公司。
1.2 方法
1.2.1样品制备
将小麦面筋蛋白与水按液料比1.5 mL/g混合(根据文献及预实验,γ-PGA组加入占面筋蛋白质量0.5%和1%的γ-PGA),混合采用漩涡振荡的方式避免面筋蛋白结块。将制得的湿面筋蛋白用保鲜膜包覆置于4℃平衡1 h,后放于-40℃低温冷柜速冻2 h,然后置于-18℃冷藏0、7、21、35、49 d,即为冷冻湿面筋蛋白。部分样品置于室温(20℃)解冻2 h后直接测定,部分样品采用美国FTS公司Flexi-Dry型冷冻干燥机干燥后,粉碎、研磨,过120目筛置于干燥器备用。
1.2.2γ-PGA热滞活性测定
参照文献[4]使用德国仪器制造有限公司的DSC-214型差示扫描量热仪对γ-PGA的热滞活性(Thermal hysteresis activity, THA)进行测定,记录样品熔点Tm、熔融焓ΔAm、保留温度Th、冻结起始温度To和部分冻结时的熔融焓ΔAf。样品体系的冰晶质量分数Φ和热滞活性Tγ计算公式为
Tγ=Th-To
1.2.3面筋蛋白中水分分布测定
采用上海纽迈电子科技有限公司Micro MR型核磁共振仪测定弛豫时间T2。参数设置:共振频率为22 MHz,磁体温度为32℃,90°脉冲时间为18 μs,180°脉冲时间为36 μs,采样点数为416 616,模拟增益RG1为20,模拟增益RG2为3,累加次数为32,回波个数为5 000,数字增益为3[10]。
1.2.4面筋蛋白二级结构测定
蛋白二级结构由布鲁克科技有限公司TENSOR Ⅱ型傅里叶红外光谱仪测定。参数设置:扫描范围400~4 000 cm-1;扫描256次;分辨率4 cm-1[11]。对结果中酰胺I吸收峰(1 600~1 700 cm-1)位置基线校正、高斯去卷积和二阶求导后进行曲线拟合,各特征峰与面筋蛋白二级结构对应关系参照文献[12]。
1.2.5面筋蛋白热力学特性测定
DSC(面筋蛋白变性温度Tp)测定:从20℃以5℃/min加热至100℃;TGA(面筋蛋白热降解温度Td及失重率)测定:从50℃以10℃/min升温速率加热至600℃[10],TGA测定采用美国TA仪器有限公司Q500型热重分析仪。
1.2.6面筋蛋白流变学特性测定
采用美国TA仪器有限公司DHR-2型旋转流变仪测定动态流变学特性。参数设置:平板直径为40 mm,夹具间隙为1.2 mm,扫描频率为0.01~100 Hz,应力为1%,温度为25℃[4]。
1.2.7面筋蛋白微观结构观察
所有样品冷冻干燥后表面喷金,用美国FEI公司Quanta FEG 250型场发射扫描电镜进行1 000倍观察[13]。
1.2.8数据分析
用SPSS 22.0对数据进行统计分析。
2 结果与分析
2.1 γ-PGA热滞活性
THA常用来表征抗冻活性的主要特异性指标[14]。γ-PGA的DSC冻融曲线见图1。由表1可看出,当保留温度从-3.25℃增加至-2.75℃时,样品冰晶含量最少,放热曲线面积最大。当保留温度为-2.75℃时,Tγ达到最大值为1.65℃,这表明γ-PGA具有抗冻活性。
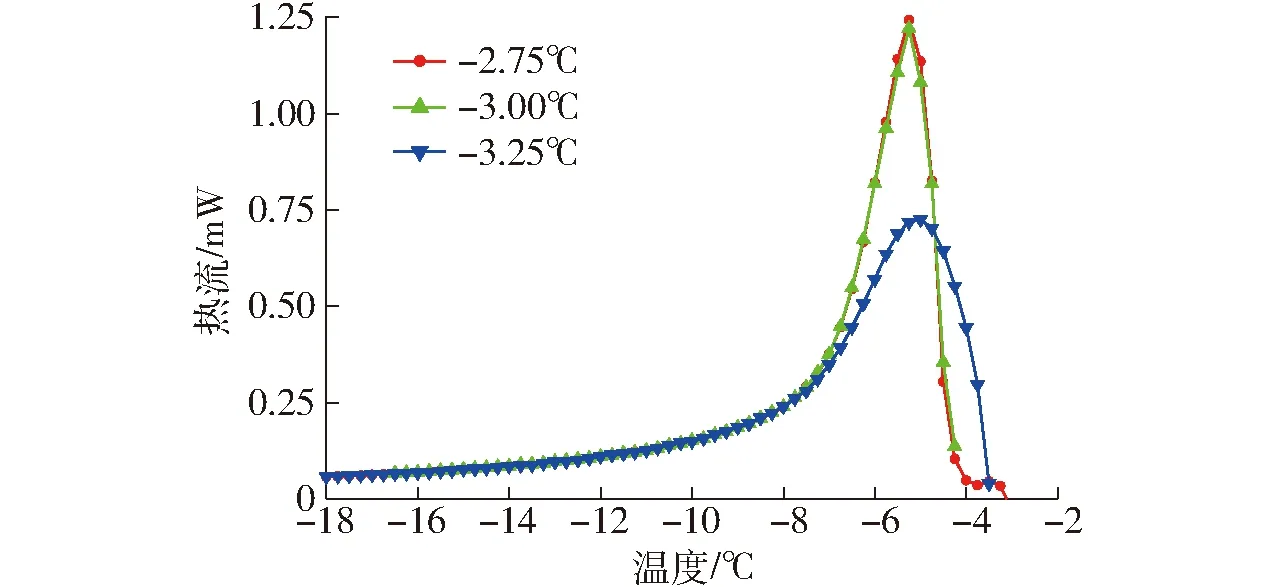
图1 γ-PGA在不同保留温度下的再次冻结DSC曲线Fig.1 DSC curves of re-freezing of γ-PGA at different retention temperatures
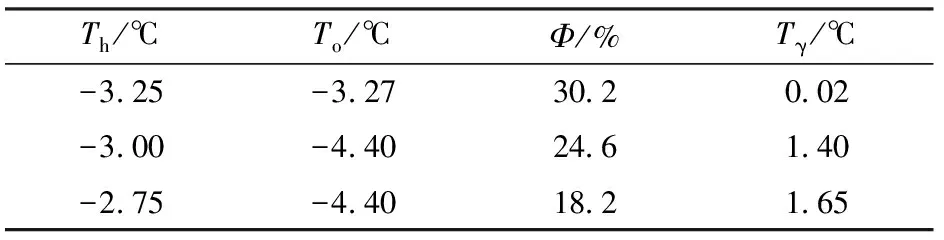
表1 γ-PGA在不同Th下的To、Φ和TγTab.1 Onset temperature (To), ice fraction (Φ) and THA (Tγ) of γ-PGA at different hold temperatures (Th)
2.2 γ-PGA对面筋蛋白体系水分分布的影响
由图2可知,面筋蛋白中水分子主要以3种状态存在,与大分子结合紧密的结合水(T21)、与大分子结合较弱的弱结合水(T22)和游离的自由水(T23)[15]。由图2、表2可知,随冻藏时间增加,对照组弱结合水含量显著下降,自由水含量显著增大,结合水含量无显著变化,这与DING等[13]结果相似。添加1%的γ-PGA使自由水增大趋势被遏制,冻藏35 d后只增加1.5%,远小于对照组,同时优于0.5%添加组,弱结合水含量在冻藏期间无显著变化,说明γ-PGA有效减弱了弱结合水向自由水的转化,这是因为γ-PGA作为阴离子型亲水多肽,自身大量羧基能较好吸附自由水,同时面筋蛋白与γ-PGA阴离子基团间可能产生相互作用,形成面筋蛋白-多肽复合网络,限制水分的流动[16-17],降低了冻藏导致的面筋蛋白中水分流动性增大。
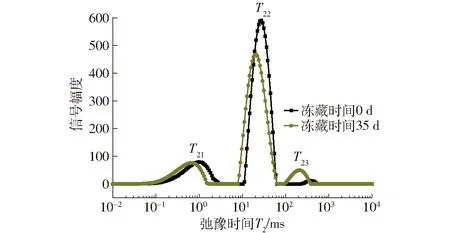
图2 面筋蛋白中水分子弛豫时间分布Fig.2 Distribution of relaxation time (T2) of water molecules in gluten proteins
2.3 γ-PGA对面筋蛋白体系二级结构的影响
由表3可知,随冻藏时间的增加蛋白二级结构发生显著变化,这是因为冻藏破坏了面筋蛋白中起骨架作用的螺旋结构,使分子尺寸变小,延展性减弱[18],同时冻藏导致蛋白分子内和分子间出现新的分子交联,改变了蛋白的二级结构。相比对照组,添加1%的γ-PGA削弱了α-螺旋在冻藏期间的下降趋势,并使无规则卷曲相对含量的增加下降了10%。这是因为γ-PGA有效束缚了冻藏期间面筋蛋白中水分流动,抑制了面筋蛋白中冰晶的生长和重结晶现象的发生,保护了面筋网络结构,减缓了大分子解聚速度,减弱了二级结构变化。对比可知γ-PGA增大了面筋蛋白二级结构中α-螺旋的相对含量,而α-螺旋作为多肽的稳定骨架支撑,其相对含量的增加也说明γ-PGA对蛋白稳定性起到有利影响。
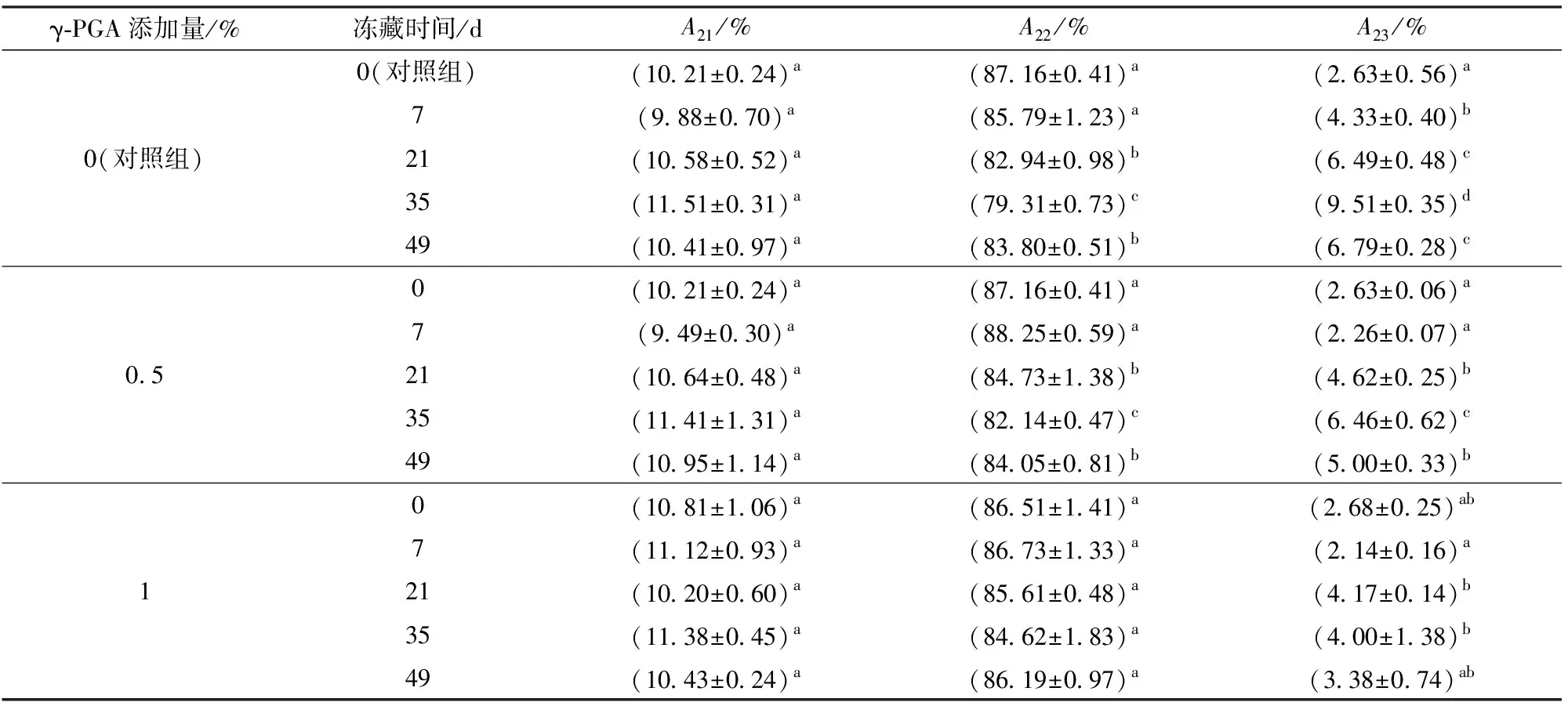
表2 γ-PGA对冷冻面筋蛋白体系水分子弛豫时间T21、T22、T23对应峰面积占比Tab.2 Effect of γ-PGA on relaxation times (T21, T22 and T23) and corresponding peak area in frozen gluten protein system
注:A21、A22、A23分别代表T21、T22、T23对应峰面积占比;同列数字后不同字母表示水平间差异显著(P≤0.05),下同。
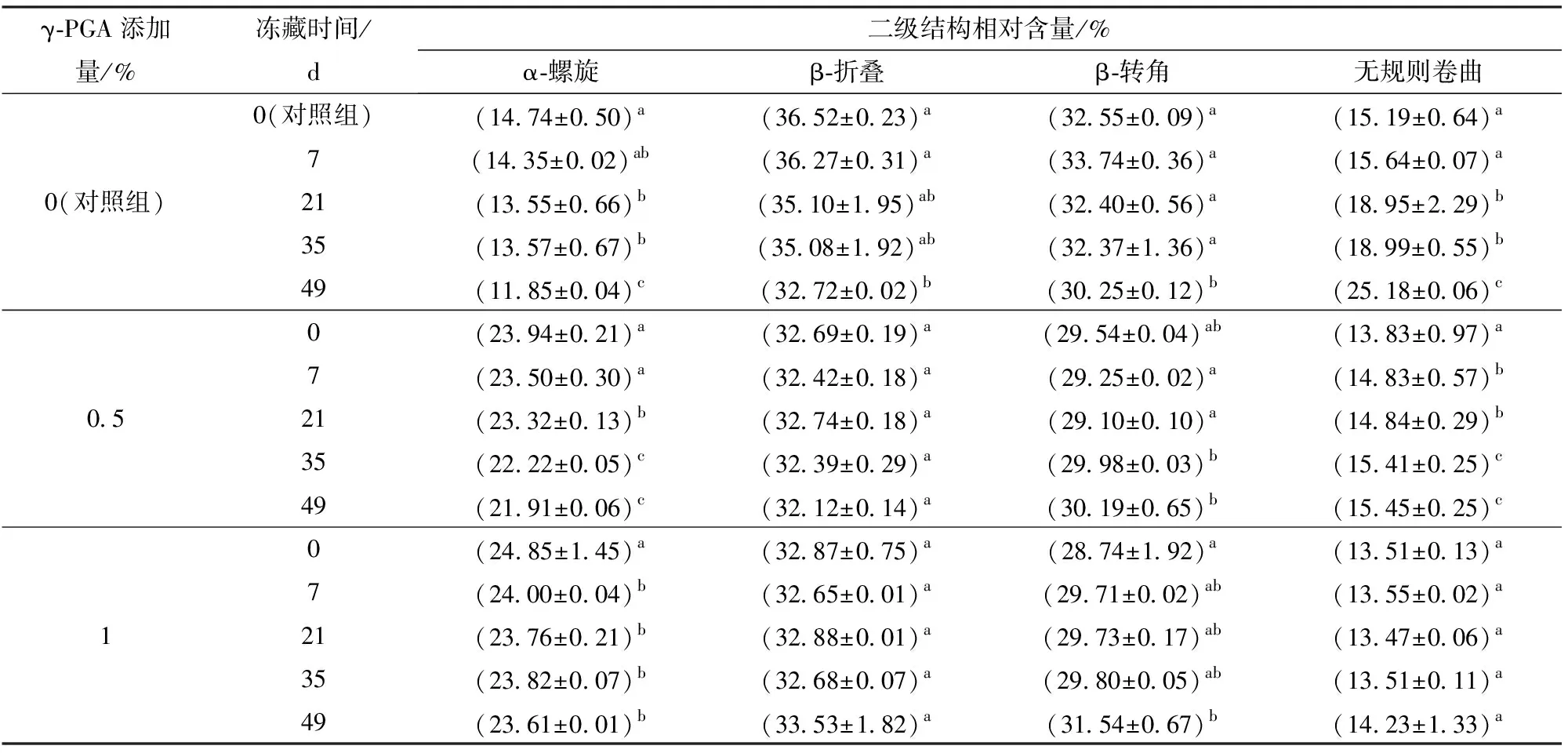
表3 γ-PGA对冷冻面筋蛋白体系二级结构的影响Tab.3 Effect of γ-PGA on the secondary structure of frozen gluten protein system
2.4 γ-PGA对面筋蛋白体系热力学特性的影响
由表4可知,随冻藏时间延长,面筋蛋白的变性温度由52℃显著增加至57℃。冻藏49 d时,添加1% γ-PGA的面筋蛋白变性温度比同条件下对照组高4℃左右,说明γ-PGA添加使其热变性温度得到提升。热重分析得知冻藏期间面筋蛋白降解温度无显著变化,失重率显著升高,这是因为冻藏导致面筋蛋白分子间氢键和二硫键进一步断裂,面筋蛋白网络弱化[19-20],降低了蛋白的高温稳定性。添加1% γ-PGA组面筋蛋白相比对照组和0.5%添加组失重率提升较小,说明1% γ-PGA添加有效保护了蛋白面筋网络,这也与水分迁移及二级结构的结果相对应。
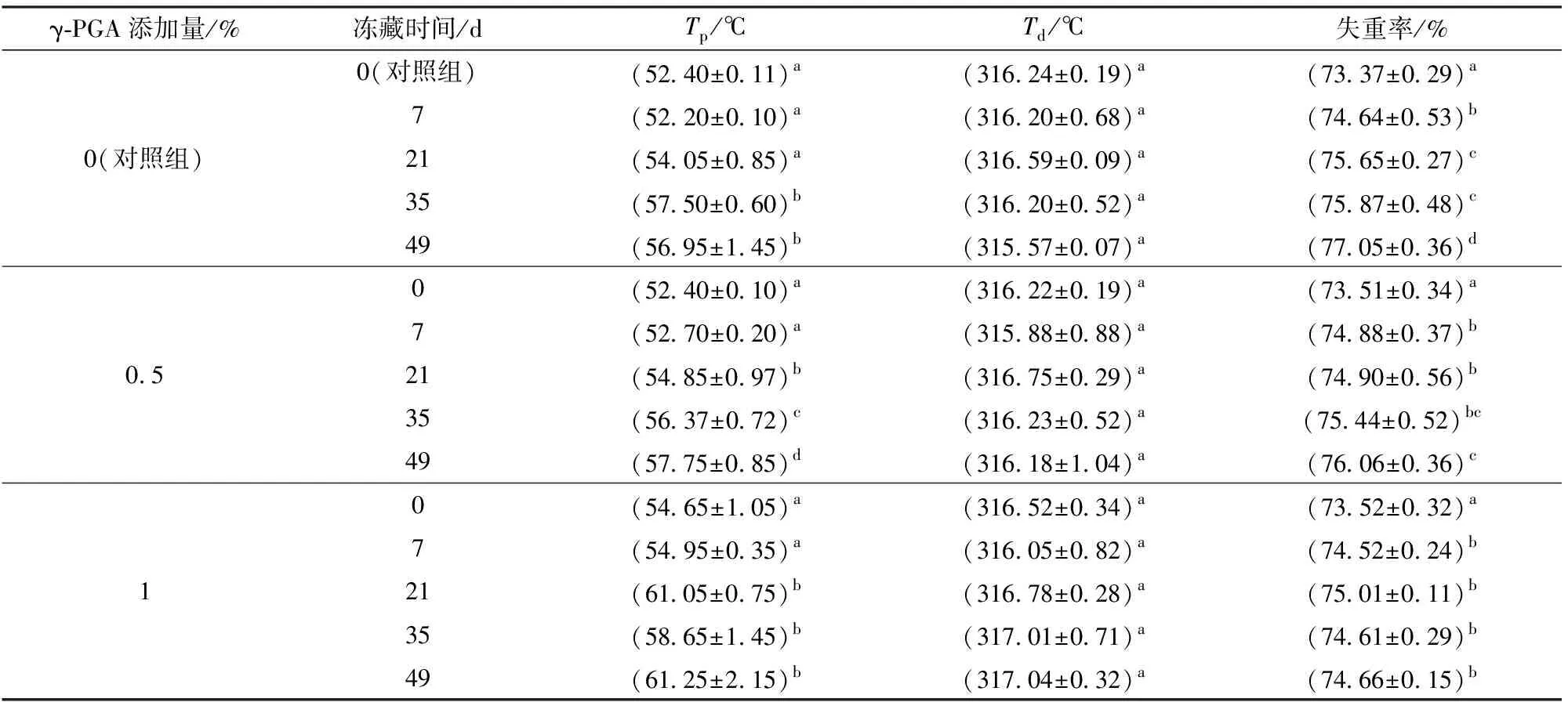
表4 γ-PGA对冷冻面筋蛋白体系热力学特性的影响Tab.4 Effect of γ-PGA on thermodynamic properties of frozen gluten protein system
2.5 γ-PGA对面筋蛋白体系流变学特性的影响
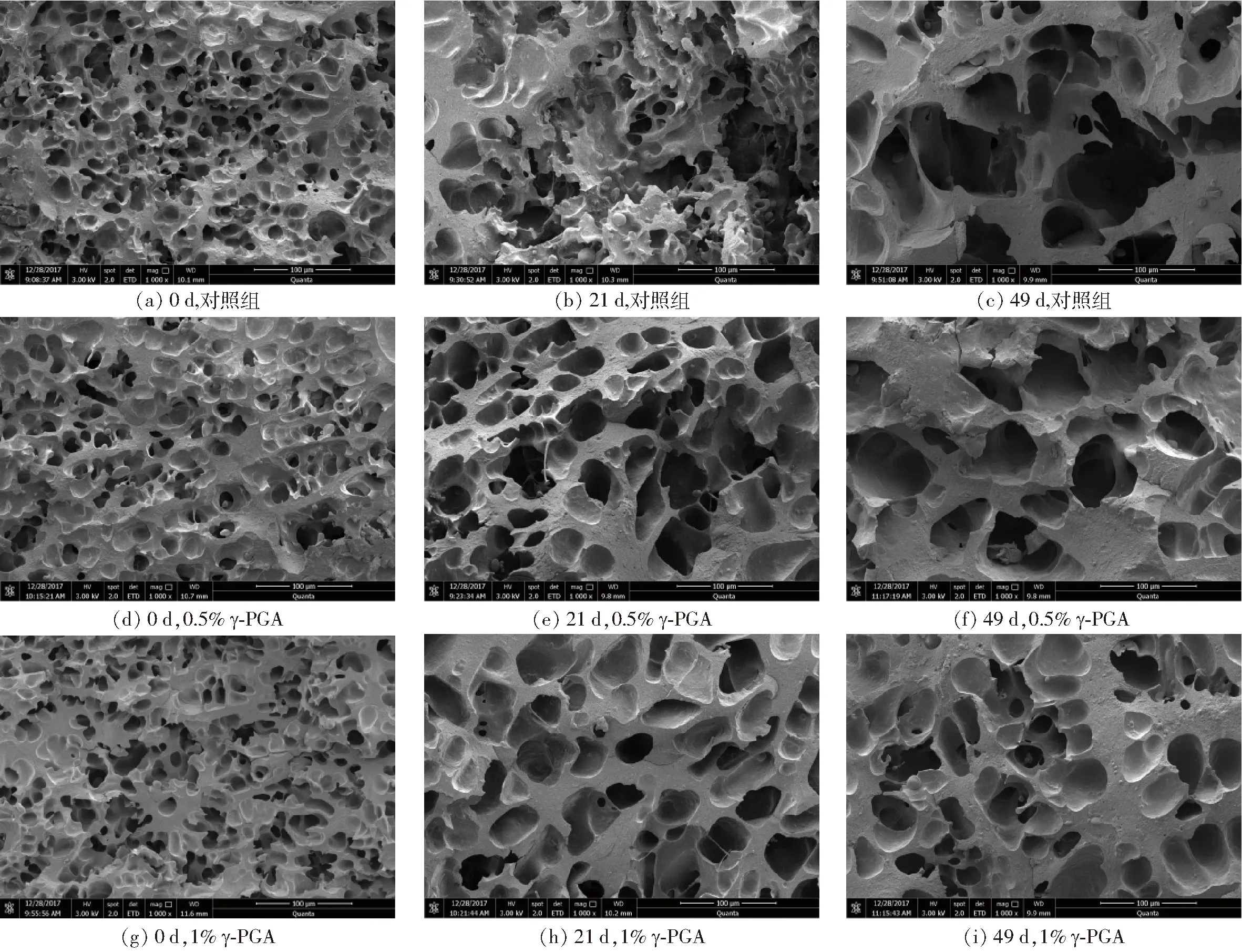
图4 γ-PGA对冷冻面筋蛋白体系微观结构的影响Fig.4 Effect of γ-PGA on microstructure of frozen gluten protein system
如图3所示,在频率0.1~100 Hz范围内,面筋蛋白G′和G″均随频率增加逐渐增大,且是G′始终大于G″的粘弹性体系,显示面筋蛋白是类固体状态,HAYTA等[21]研究也有相似结果。但随着冻藏时间的延长,面筋蛋白体系的G′和G″均呈逐渐下降趋势。这是因为冻藏破坏了谷蛋白空间网络结构,而谷蛋白大分子聚合体对面筋蛋白粘弹性起主要贡献,大分子聚合体解聚致使面筋蛋白粘弹性下降[22],也可能是随冻藏时间延长,重结晶现象使面筋网络结构发生断裂,蛋白二级结构改变引起面筋蛋白粘弹性变化[23]。添加γ-PGA的面筋蛋白的G′和G″虽随冻藏时间增加也出现下降趋势,但下降幅度明显小于对照组,且添加1% γ-PGA显著优于0.5%的添加。这可能是因为γ-PGA包裹在冰晶表面,抑制了面筋蛋白中重结晶现象的发展,保护了面筋网络,抑制了蛋白大分子解聚和蛋白二级结构转化,减弱了冻藏对面筋蛋白体系的破坏[11]。这说明γ-PGA引入有效减缓了冻藏引起的面筋蛋白流变特性的劣变。
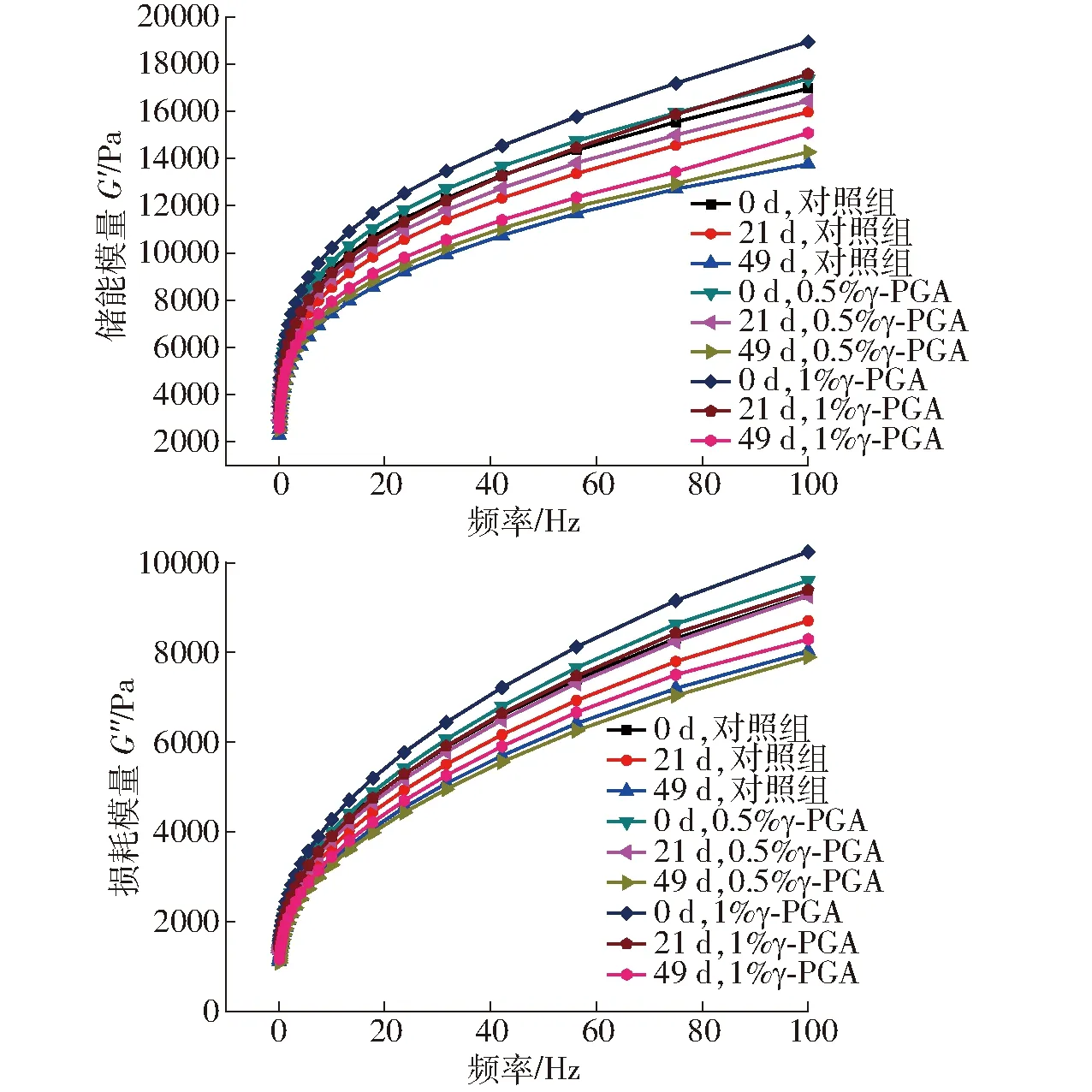
图3 γ-PGA对冷冻面筋蛋白体系流变学特性的影响Fig.3 Effect of γ-PGA on rheological properties of frozen gluten protein system
2.6 γ-PGA对面筋蛋白体系微观结构的影响
由图4可明显看出,冻藏初期面筋蛋白均保持高度三维网络结构,孔洞致密而均匀,孔径多在8~20 μm(图4a、4d、4g)。随冻藏时间增加,面筋蛋白致密的空间网络被破坏,出现网络结构开裂、不连续,且孔径增大至100 μm左右(图4b、4c),这是因冻藏期间蛋白脱水使得冰晶数增加及重结晶现象的发生,致使面筋网络受到不同程度的破坏[10],而面筋网络劣变造成的蛋白分子量和分子链的变化,一定程度上影响了面筋蛋白的流变特性、二级结构等性能[24]。冻藏49 d后添加1% γ-PGA组面筋蛋白与对照组相比,其网络结构仍能保持均匀、连续,且孔径仍能维持在50 μm左右,且显著优于0.5%的添加。这可能是由于γ-PGA吸附在冰晶表面,修饰冰晶生长形状,抑制面筋蛋白中大冰晶的生成和重结晶现象,减少了面筋蛋白的机械损伤[4]。这说明γ-PGA对冻藏引起的面筋蛋白网络劣变起到良好改善作用,而三维网络的保持有效束缚水分的迁移[25],也印证了上述的实验结果。
3 结束语
随冻藏时间延长,面筋蛋白中自由水含量呈现增加趋势,面筋蛋白水分流动性增大。冻藏49 d后,面筋蛋白二级结构中α-螺旋相对含量显著下降,无规则卷曲显著增加。面筋蛋白失重率显著提升,表明面筋蛋白热力学稳定性下降。冻藏期间面筋蛋白网络结构产生断裂及大孔洞,面筋网络的劣变及二级结构的变化致使面筋蛋白粘性和弹性出现下降趋势。γ-PGA的添加有效抑制了冰晶生长和重结晶现象,保护了面筋蛋白网络,降低了水分流动性的增大趋势,抑制了蛋白二级结构向不稳定状态转化的程度,且添加1% γ-PGA明显优于添加0.5%γ-PGA。γ-PGA抑制了冻藏导致的面筋蛋白劣变,提升了面筋蛋白的冻藏稳定性。

