宰后藏羊肉Hsp70表达量变化及其与肉品质相关性分析
张爱萍 师希雄 韩 玲 岳建伟 孙金龙 张有富
(1.甘肃农业大学食品科学与工程学院,兰州 730070; 2.河西学院农业与生物技术学院,张掖 734000)
0 引言
藏羊对高寒缺氧环境的极强适应能力以及耐粗饲、抗病力强、遗传性状稳定等优点使其成为甘南地区牧民重要的经济和肉品来源。欧拉型藏羊是藏羊的一种,生活环境污染小,常年以放牧为主,肌间脂肪含量适中,粗蛋白、维生素和矿物质含量丰富,肉色鲜[1-2]。但因其系水力和熟肉率较低、肌纤维直径稍粗,尤其是嫩度较差的特点影响了食用品质。
宰后成熟是改善肉品质的有效方法之一。肉成熟之后,嫩度、保水性、风味均得到明显的改善,目前的研究成果认为,肉成熟过程中品质的改善主要归因于肌原纤维蛋白的降解,然而,肉的成熟机理尚未明确。动物宰后的缺血缺氧激活了细胞凋亡酶,在诱导细胞凋亡的同时,应激诱导了具有高度保守性的一类非特异性细胞热应激蛋白(Heat shock proteins,Hsps)的合成,其主要功能是作为分子伴侣与抗凋亡因子,可阻止宰后肌肉成熟过程所发生的细胞凋亡、蛋白降解等生理生化过程[3]。近些年,蛋白组学关于肉品质的研究表明,Hsps作为生物标记物在预测嫩度、肉色、保水性和风味方面具有一定的潜力[4-5]。目前,国内外关于Hsps的研究主要集中在医学领域,对肉品质影响的研究主要集中在小分子热休克蛋白(Small heat shock proteins, sHsps) 方面,如Hsp27和αβ-晶体。
HWANG等[6]经蛋白质组学分析研究认为:Hsp27含量与肌肉嫩度呈负相关;sHsps是一种分子伴侣,具有维持蛋白质完整性的功能,故肌肉中Hsp27与αβ-晶体含量的下降有利于肌动蛋白和肌球蛋白的降解,肌肉的嫩度得以提高。LOMIWES等[7]用免疫沉淀法研究安格斯小母牛背最长肌中Hsp27等几种蛋白与μ-钙蛋白酶之间的关系时发现,Hsp27在较嫩的肉样中含量略低。
左惠心等[8]对牦牛肉通过蛋白质组学研究显示,Hsp27是与牦牛肉保水性相关的蛋白之一。BERNARD等[9]对夏洛莱牛胸部肌肉进行研究时发现,Hsp27和αβ-晶体蛋白含量与肌肉的嫩度和持水性呈显著负相关,Hsp27在肌肉中表达量的下调能够改善肉的嫩度、多汁性和风味。张淼[10]研究发现,宰后运输应激过程中猪肉Hsp27含量与韧性、a*值呈正相关,与L*值和b*值呈负相关。
Hsp70是热休克蛋白之一,动物宰后的缺血缺氧应激诱导Hsp70的合成,在动物宰后肉成熟过程中Hsp70对肉品质的影响鲜有报道,尤其对藏羊肉品质的影响未见报道。本文研究藏羊肉宰后成熟过程中Hsp70表达量与肉品质指标的变化,同时,分析Hsp70表达量与肉品质指标的相关性,以期为藏羊肉宰后成熟过程中Hsp70对食用品质的影响提供理论依据,从而丰富藏羊肉成熟机理,进一步改善藏羊肉品质。
1 材料与方法
1.1 试验材料
试验材料:选取甘南藏族自治州自然放牧条件下健康无病、发育正常、体重相近的4~5岁欧拉藏母羊24只,宰前禁食10~15 h,只提供饮水。
试验试剂:KCl,K3PO4,EDTA,MgCl,NaN3,均为分析纯;RIPA组织裂解液,苯甲基磺酰氟(Phenylmethylsulfonyl fluoride,PMSF),北京索莱宝科技有限公司。
羊热休克蛋白70(Hsp70)酶联免疫吸附测定(ELISA)试剂盒,上海酶联生物科技有限公司。
1.2 试验仪器
PHS2-2型酸度计(上海雷磁公司),CR-400型色差仪(日本Konika-Minolta 公司),HI99163型便携式肉类pH计(意大利哈纳HANNA仪器公司),C-LM4型数显式肌肉嫩度仪(东北农业大学工程学院),YYW-2型应变控制式无侧限压力仪(南京土壤仪器厂有限公司),HHS型数显电热恒温水浴锅(上海博讯实业有限公司医疗设备厂),BSA224型电子天平(赛多利斯科学仪器北京有限公司),XHF-D型高速分散器(宁波新芝生物科技股份有限公司),XH-B型涡旋混合器(江苏康健医疗用品有限公司),TGL-24M型台式高速冷冻离心机(长沙平凡仪器仪表有限公司),SP-756P 型紫外可见分光光度计(上海光谱仪器有限公司),iMark Microplate Reader型酶标仪(美国Bio-Rad公司)。
1.3 试验方法
1.3.1样品采集与制备
随机选取24只年龄体重相近的欧拉藏羊为试验对象,宰前禁食并且随机编号,尽量减小屠宰过程中的应激。宰后30 min内迅速取下背最长肌,并在一侧背最长肌上取下少许肉样作为第0天肉样,用锡箔纸包裹后保存于液氮中待测;其余肉样置于4℃环境中成熟,并分别于宰后2、12、24、48、72、120、168 h取样,取得的样品在-80℃超低温冰箱中保存,随后进行Hsp70表达量、pH值、肉色、剪切力、系水率、蒸煮损失、肌原纤维小片化指数(MFI)、糖原含量的测定。
1.3.2Hsp70表达量
蛋白样品的制备:参照SALOKHE等[11]的方法并改进,将保存于-80℃冰箱中的肉样组织取出,于4℃恒温恒湿(相对湿度85%)箱解冻至半冻状态,除去表皮脂肪和筋膜,切成小块。准确称取150 mg样品置于研钵中,加入1.5 mL RIPA组织裂解液、15 μL PMSF充分研磨,将研磨后的组织液转移到玻璃匀浆器中匀浆1 min,以充分裂解组织细胞,将匀浆液移至3 mL离心管中离心(12 000g,4℃,20 min),离心完毕后将上清液移至另一EP管中于-80℃保存备用。
Hsp70表达量的检测:参照试剂盒说明书并参照YU等[12]的方法,采用ELISA分析法检测Hsp70的含量。将4℃冰箱中保存的试剂盒取出,室温(20℃)下平衡30 min后,对已经制备好的样品进行ELISA分析法检测。
在Excel工作表中,以试剂盒里Hsp70的不同质量浓度梯度标准品质量浓度为横坐标,对应450 nm处 OD值为纵坐标,绘制出标准品线性回归曲线(设定系数R2≥0.990 0),按曲线方程计算各样品Hsp70质量浓度,即Hsp70表达量。
1.3.3pH值
采用 HI99163 型便携式肉类pH计(带35 mm不锈钢刀头),用蒸馏水冲洗肉样上的血渍,并用干净滤纸吸干表面残留水分,随机选择3个不同部位的肉样将pH计探头插入肉中进行测定,并使电极与肉样接触良好,待其读数稳定后记录,取平均值。
1.3.4色度
采用CR-400型色差仪进行测定。测量前先用标准白板对色差仪进行校正,每个肉样选取3处测定求其平均值,包括亮度L*、 红色度a*、 黄色度b*。
1.3.5系水率
选取不同成熟时间点的样品,切成约1 cm2小块,精确称取10 g于离心管中,2 500g、4℃下离心30 min,取出肉样用定性分析滤纸吸去表面渗出的多余水分,称量并测定失水率。每个样品做3个平行,取平均值。水分含量测定参照GB/T 9695.15—2008《肉与肉制品 水分含量测定》。
式中A——系水率,%
B——含水率,%
C——失水率,%
D——离心前样品质量,g
E——离心后样品质量,g
1.3.6剪切力
取厚约4 cm、质量100 g左右的肉样(除去表面脂肪和结缔组织),装入蒸煮袋中,将温度计插入至肉样中心,用夹子封口,放入80℃水浴锅中进行蒸煮,当肉样中心温度达到70℃时开始计时,使肉样中心温度保持在70℃继续煮30 min后,取出冷却至室温,后用1.27 cm的取样器沿肌纤维方向钻取测定样品,用嫩度仪测定剪切力,每组重复3次,取平均值。
1.3.7肌原纤维小片化指数
参照DELGADO等[13]及孙志昶等[14]的研究方法,取0.8 g肉样,用8 mL的MFI(肌原纤维小片化指数)缓冲液(100 mmol/L KCl、20 mmol/L K3PO4、1 mmol/L EDTA(乙二胺四乙酸)、1 mmol/L MgCl2、1 mmol/L NaN3,pH值7.1),将肉研磨均质化。所得悬浊液在1 000g、4℃下离心15 min,弃去上清液,沉淀后再用8 mL的MFI缓冲液使其重新处于悬浊态,再于1 000g、4℃离心15 min,弃去上清液。沉淀后用5 mL的MFI缓冲液使之重新处于悬浊态,用200目尼龙筛网过滤该悬浊液,另用5 mL MFI 缓冲液帮助肌原纤维蛋白通过滤网。过滤所得的肌原纤维蛋白悬浊液用双缩脲法测定其蛋白含量,然后用MFI缓冲液将其质量浓度稀释至0.5 mg/mL,最后在540 nm下测定其吸光度,将结果乘以200,就是肌原纤维小片化指数。
1.3.8糖原含量
取试样少许,解冻后经生理盐水漂洗再用滤纸吸干,然后精确称1 000 mg放入离心管内,加入5%的三氯醋酸4 mL,用组织分散器以26 000 r/min分散60 s,在15 000g、4℃下离心15 min,将上清液移入另一试管内。在沉淀内加入5%的三氯醋酸4 mL,匀浆1 min后,于上述条件(15 000g、4℃)离心15 min,将上清液移入试管内与第1次离心的上清液合并,用振荡混合器充分混匀。取上清液1 mL放入10 mL离心管中,加入95%乙醇4 mL,充分混匀至两种液体间没有分界面。用干净塞子塞上,室温下静置12 h。然后在15 000g、4℃下离心10 min,弃去上清液后,试管倒置10 min以控干后,逐次加入3 mL蒸馏水,振荡管子至糖原完全溶解,移入20 mL试管中。剩余步骤与标准曲线绘制的试验方法相同。用M×8/1000×0.9×100计算糖原含量(质量比,单位mg/g),其中M表示对照标准曲线查得1 mL提取液中的葡萄糖含量,单位mg。
1.4 统计分析
试验所得数值均采用平均值±标准差表示,采用Excel及SPSS 19.0数据统计分析软件进行统计分析。
2 结果与分析
2.1 Hsp70表达量
Hsp70具有抗细胞凋亡功能,保护组织免受氧化应激[15],蛋白质组学的研究证明,Hsp70是与嫩度有高度关系的蛋白,在剪切力低的肉中其表达量较低[16]。由图1(图中不同小写字母表示差异显著(P<0.05),下同)分析得出,宰后藏羊肉成熟过程中Hsp70的表达量总体呈逐渐下降的趋势,宰后12 h Hsp70的表达量达到最大,宰后12~120 h内Hsp70表达量表现为显著下降。相比于宰后12 h,宰后24、72、120 h的Hsp70表达量分别下降了38.84%、61.71%、91.72%。宰后初期,由于动物缺血缺氧引起应激反应,产生的Hsp70表达量迅速增加,阻止了细胞凋亡的发生,使肉的嫩度降低,之后随着成熟过程Hsp70表达量逐渐降低,嫩度逐渐升高。
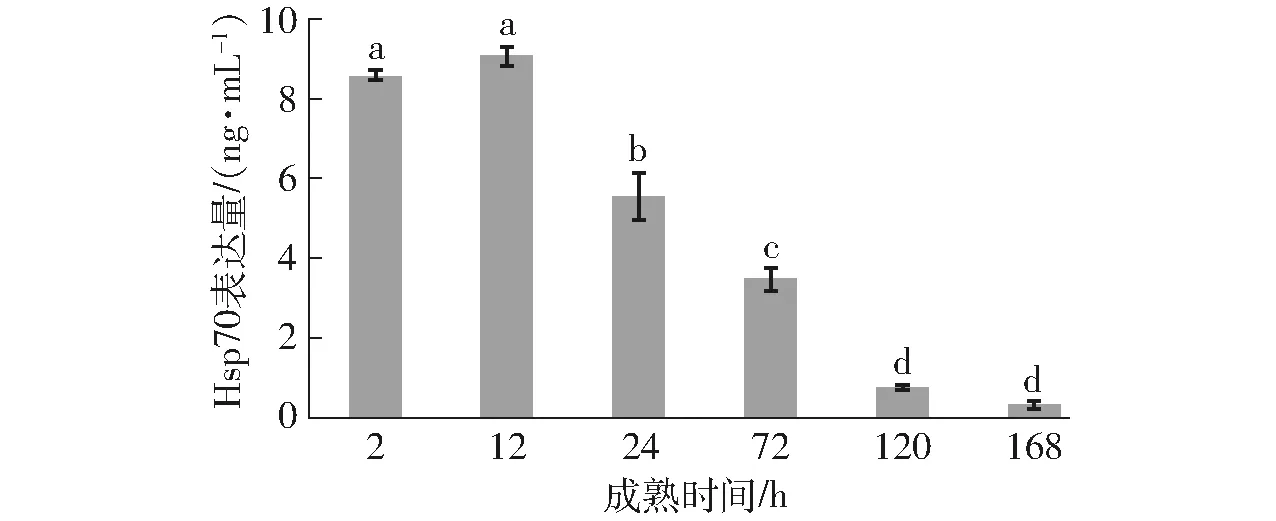
图1 宰后成熟过程藏羊肉Hsp70表达量的变化Fig.1 Change of Hsp70 concentration of Tibetan sheep meat during postmortem aging
2.2 pH值
pH值是反映动物屠宰后糖元酵解速度和强度的重要指标,能更直观地体现机体生成乳酸的含量,动物在宰后由于糖原的酵解,发生无氧呼吸产生乳酸等物质,肌肉的pH值不断下降,用pH值可以判断宰后肉品的成熟情况。如图2所示,随着成熟时间的延长,宰后2~24 h藏羊肉的pH值显著降低,此结果与王薇等[17]对宁夏滩羊成熟过程pH值变化的研究结果一致。宰后肉品随着成熟的进程,24 h后pH值逐渐上升。宰后初期由于供氧中断糖原被分解而产生大量乳酸,pH值大幅度下降,直到肌动球蛋白等电点,随着H+浓度的升高,与糖酵解相关的酶被钝化酵解速度和程度逐渐减小,pH值回升。

图2 宰后成熟过程藏羊肉pH值的变化Fig.2 Change of pH value of Tibetan sheep meat during postmortem aging
2.3 色度
由图3可知,宰后成熟过程中藏羊肉L*、a*及b*均有一定的变化。L*变化呈先升高后降低的趋势,24 h时达到最大值,这与李泽等[18]对宰后羊肉、吴菊清等[19]对牛肉及猪肉和田甲春等[20]对牦牛肉中L*的研究结果相似。肉色变化主要是由肌红蛋白在脱氧、氧合和高铁肌红蛋白3种形态之间变化所决定的[21]。a*的变化与肌红蛋白的含量和化学状态密切相关,成熟初期因亚铁肌红蛋白结合氧生成氧合肌红蛋白,a*逐渐升高,随着成熟过程中与空气的接触,鲜红色的氧合肌红蛋白逐渐变成高铁肌红蛋白,a*降低。

图3 宰后成熟过程藏羊肉色度的变化Fig.3 Change of chromaticity of Tibetan sheep meat during postmortem aging
2.4 系水率
肉的系水率可以表征肌肉受到外力(压力、切碎、冷冻、解冻、贮存、加工等)作用时,其保持原有水分与添加水分的能力。由图4可知,宰后2 h藏羊肉的系水率最高,保水性最好,随着成熟的进程,在2~24 h系水率显著降低,72 h时系水率达到最低,之后有显著回升。动物宰后肌肉中因糖酵解生成的乳酸使肉 pH值迅速降低,肉中肌浆蛋白凝结到肌原纤维上,蛋白质溶解度下降,造成了水分的流失,系水率下降。同时pH值的快速下降,破坏了肌肉蛋白质电荷间的平衡,蛋白质带净负电荷的数量减少,pH值下降到接近肌肉蛋白质的等电点(5.4)时,蛋白质的净电荷为零,大量水分被压迫挤出,此时系水率最低,保水性最差[22-23]。
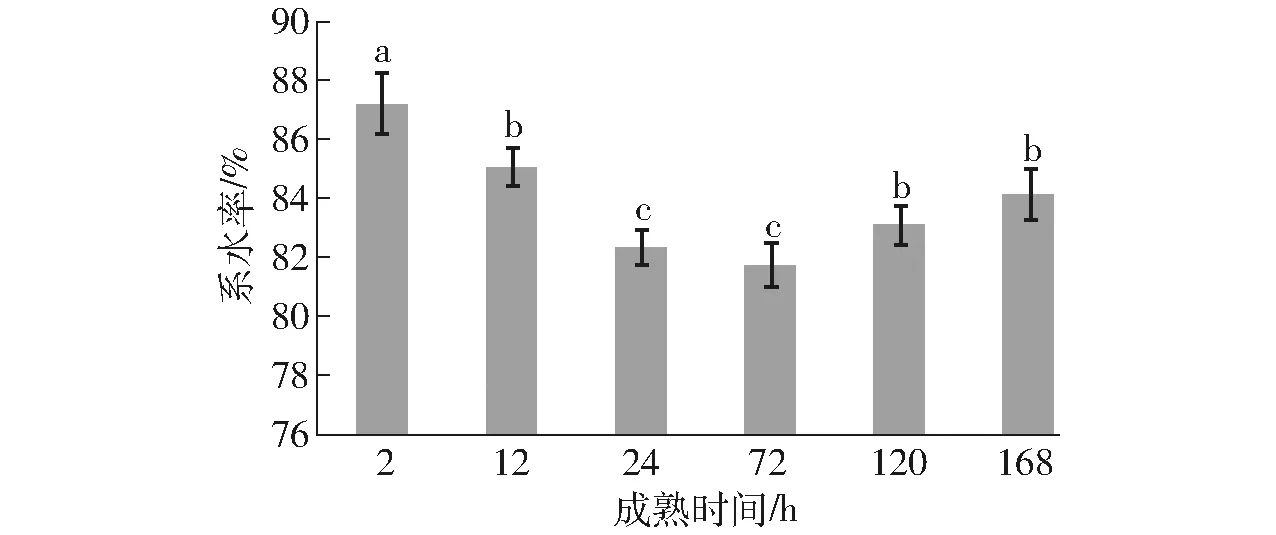
图4 宰后成熟过程藏羊肉系水率的变化Fig.4 Change of WHC of Tibetan sheep meat during postmortem aging
2.5 剪切力
嫩度是消费者在选择肉品时非常关注的重要指标之一,而剪切力是评价肉品宰后成熟过程中嫩度的重要而广泛使用的指标[24]。由图5可知,剪切力呈先增大后显著减小的趋势,宰后24 h达到最大值7.37 N。其原因是成熟初期,因为肌节的收缩会进入僵直状态,肌肉中肌球蛋白、肌动蛋白等达到等电点,蛋白凝固、肌纤维硬化,此时嫩度最差,另一方面,在成熟2~12 h,Hsp70表达量升高,抑制了细胞凋亡的发生,系水能力加强,使得剪切力升高,嫩度降低。随之,Hsp70表达量逐渐降低,细胞凋亡酶发生作用,将肌肉结构破坏,剪切力逐渐降低,嫩度增加。YANG等[25]用NaN3处理牛肉,经过单层融合、成肌细胞融合等前处理的细胞,细胞内Hsp70 表达量增加,因Hsp70与缺氧条件下的细胞凋亡相关,被认为是与宰后早期的蛋白降解和肉的嫩度有关。PICARD等[26]和CARVALHO等[16]的研究也验证了宰后初期Hsp70 表达量的增加引起肉剪切力的增大。

图5 宰后成熟过程藏羊肉剪切力的变化Fig.5 Change of shear force of Tibetan sheep meat during postmortem aging
2.6 肌原纤维小片化指数
MFI可直接反映肌原纤维蛋白被降解及肌原纤维结构破坏的程度,可以衡量嫩度的高低。本研究发现,藏羊宰后MFI显著升高主要发生在成熟约120 h以内,之后上升的速率和幅度减弱,如图6所示,这与VEISETH等[27]对绵羊背最长肌的研究结果一致。在肉品宰后成熟过程中,MFI与钙激活酶活性呈极显著相关[19],随着钙激活酶被激活,作用于肌原纤维结构的Z线后,使之受到持续的张力,导致其断裂、崩解,MFI随之增大。KEMP等[28]研究显示细胞凋亡过程中 caspase-3 表达水平的升高和肌细胞凋亡小体的形成使凋亡程度加深,破坏肌原纤维蛋白结构,也会使MFI增大。

图6 宰后成熟过程藏羊肉MFI的变化Fig.6 Change of MFI of Tibetan sheep meat during postmortem aging
2.7 糖原含量
糖原作为肌肉主要的储能物质,宰后胴体通过无氧酵解来提供胴体生化反应所需的能量。如图7所示,宰后成熟过程藏羊肉中糖原含量整体呈下降趋势。糖原在成熟初期糖酵解速率下降显著;宰后3 d之后随成熟时间的延长,糖原含量的下降速率逐渐趋于零。原因主要是肌糖原在无氧酵解过程中产生大量乳酸,导致胴体的pH值下降,当达到酸性极限pH值时,将会抑制参与无氧糖酵解酶的活性。

图7 宰后成熟过程藏羊肉糖原含量的变化Fig.7 Change of glycogen of Tibetan sheep meat during postmortem aging
2.8 Hsp70表达量与肉品质参数的相关分析
由表1可知,藏羊在宰后成熟过程中Hsp70表达量与MFI呈极显著负相关(P<0.01),与L*呈显著负相关(P<0.05),与剪切力、糖原含量呈显著正相关(P<0.05),与系水率呈极显著正相关(P<0.01),与a*、b*无显著相关性。Hsp70 是一类能特异性表达、具有抗细胞凋亡功能的热休克蛋白,能保护组织免受氧化应激,是反映肉品质的一个潜在生物标志物,通过对细胞凋亡和细胞膜的调控,会对肉品保水性和嫩度产生一定影响[5,26,29]。GUILLEMIN等[30]通过基因组学等分析牛肉嫩化的细胞途径时发现,牛半腱肌中 Hsp70表达量与肉嫩度强负相关。本试验结果显示Hsp70表达量与剪切力呈显著正相关(P<0.05),与MFI呈极显著负相关(P<0.01),这与D’ALESSANDRO等[31]和CARVALHO等[16]的研究结果一致。上调Hsp70表达量有助于维持肌细胞的完整性,修复变性的蛋白,抑制细胞凋亡的发生,阻止肌原纤维蛋白的降解[32]。DI等[5]通过蛋白质组学对不同滴水损失的猪肉在成熟过程中保水性的研究发现,热休克蛋白丰度下降引起滴水损失的增加,二者呈负相关,滴水损失大则系水率低,与本文研究结果Hsp70表达量与系水率呈极显著正相关(P<0.01)相一致。ZHANG等[33]研究表明鸡胸肉中Hsp70表达量与滴水损失呈正相关,与本结果不一致,可能是试验材料存在差异或样品处理方式不同所导致。

表1 Hsp70表达量与肉品质的相关性分析Tab.1 Correlation analysis between Hsp70 concentration and meat quality
3 结论
(1)藏羊背最长肌宰后成熟过程中,Hsp70表达量在宰后最初的2~12 h升高达到最高量之后显著下降(P<0.05),120 h后下降趋势缓慢。
(2) Hsp70表达量与MFI呈极显著负相关(P<0.01),与L*呈显著负相关(P<0.05),与剪切力、糖原含量呈显著正相关(P<0.05),与系水率呈极显著正相关(P<0.01)。

