乳清分离蛋白限制性脱酰胺及一些性质的表征
李丹,易伟民,范馨文,翟爱华,关琛
(黑龙江八一农垦大学食品学院,黑龙江大庆163319)
乳清分离蛋白(whey protein isolated,WPI)是一种优质的动物性蛋白资源,由于其具有营养价值高、易消化吸收、含有多种活性成分等特点,乳清分离蛋白日渐受到重视[1]。资料显示,每年美国由制作干酪而产生的乳清达3 300万吨,但仅有55%的乳清得到了进一步加工,其余未加工的乳清随污水排放,既造成资源浪费又造成环境污染[2]。因此,生产一些高附加值产品使乳清蛋白被充分利用显得尤为重要。近年来,与乳清分离蛋白有关的研究也有很多[3-4],然而几乎没有与脱酰胺有关的研究。
酶法脱酰胺主要使蛋白质分子侧链的谷氨酰胺转化为谷氨酸,使肽链内的负电荷有所增加,最终使得蛋白质的许多功能性质,如溶解性、表面疏水性、抗氧化性、与二价金属离子螯合的能力等特性均受到不同程度的影响[5]。Matsudomi[6]、Hamada[7]等指出,脱酰胺作用基本不影响蛋白的一级与二级结构,食物蛋白的脱酰胺度达2%~6%时就能显著提高食物中蛋白质的相关功能特性,尤其是溶解性。聂小华等[8]采用HCl对大米蛋白进行脱酰胺处理,结果表明,脱酰胺处理使大米蛋白功能性质均得到显著提高,而且脱酰胺大米蛋白的表面疏水性也发生了明显下降。
本研究采用谷氨酰胺酶(EC 3.2.1.5),对乳清分离蛋白进行限制性脱酰胺,从而制得具有较低脱酰胺度的蛋白产物,并对其产物的界面性质及Fe2+/Zn2+等二价金属离子的螯合能力进行了评价和比较。研究结果可以为多功能食品的开发提供很好的基料,为乳清分离蛋白更好地应用于食品加工业提供理论基础。
1 材料与方法
1.1 材料与仪器
乳清分离蛋白:天津银河伟业进出口有限公司;3-(2-吡啶基)-5,6-双(4-苯磺酸)-1,2,4-三嗪(Ferrozine)、谷氨酰胺酶(EC 3.2.1.5,酶活为 17.3 U/g):美国Sigma公司;大豆油:九三集团;其他试剂均为国产分析纯。
UV-2401PC紫外-可见分光光度计:日本岛津公司;Kjeltec TM 3200全自动凯氏定氮仪:瑞士Foss公司;AR224CN型电子天平:奥豪斯国际贸易(上海)有限公司;JJ-1型精密定时电动搅拌器:江苏省金坛市荣华仪器制造有限公司;LD4-1.8型台式离心机:北京京立离心机有限公司。
1.2 方法
1.2.1 乳清分离蛋白限制性脱酰胺
将一定量的乳清分离蛋白溶液与超纯水、不同体积的谷氨酰胺酶溶液(浓度为0.1 g/mL)混合,配制成乳清分离蛋白浓度为5%、酶添加量分别为0.2、0.4、0.6、0.8、1.0 U/g乳清分离蛋白的反应体系。体系分别在 30、33、36、39、42 ℃下反应 1 h~20 h,按照以下方法分别测定产物的脱酰胺度。以未加谷氨酰胺酶溶液的乳清分离蛋白溶液为空白。
1.2.2 蛋白质含量测定
蛋白质含量测定采用凯氏定氮法GB/T 5009.5-2016《食品安全国家标准食品中蛋白质的测定》)[9]。
1.2.3 脱酰胺度测定
脱酰胺度测定采用苯酚-次氯酸盐法[10]。
分别准确称取5.0 g苯酚、25 mg亚硝基铁氰化钠,并加入双蒸水定容至500 mL配制试剂A备用。准确称取2.5 g NaOH并溶于双蒸水中,移取4.2 mL次氯酸钠溶液加入到NaOH溶液中,并容至500 mL配制试剂B。
准确移取5.0 mL试剂A于试管中,加入20 μL不同浓度的硫酸铵标准溶液(或待测样品),充分振荡、混匀。然后准确移取5.0 mL试剂B加入到上述混合溶液中,充分振荡、混匀。迅速转移至水浴锅中,在37℃下水浴显色20 min。然后冷却至室温,在625 nm处测定溶液吸光值。每个浓度做3个平行。
根据所测定的样品游离氨含量及总酰胺含量,计算脱酰胺度,计算公式见式(1)。

1.2.4 Fe2+螯合能力测定
采用Ferrozine显色法测定二价铁螯合能力[11],略有改动。
准确吸取0.25 mL样品溶液(1 mg/mL,终浓度0.10 mg/mL) 与0.15 mL 1 mmol/L的 FeSO4·7H2O 溶液(终浓度0.03 mmol/L,现用现配)混合。加入1.20 mL超纯水,使反应体系终体积为1.50 mL。混匀后放置2 min,再加入1.00 mL 0.50 mmol/L的Ferrozine显色剂水溶液(终浓度0.20 mmol/L),充分振荡、混匀。室温下静置反应10 min,使Fe2+与Ferrozine充分结合,形成稳定的Fe2+-Ferrozine复合物,紫外分光光度法562 nm下测定吸光值。样品对Fe2+的螯合效率计算公式见式(2):
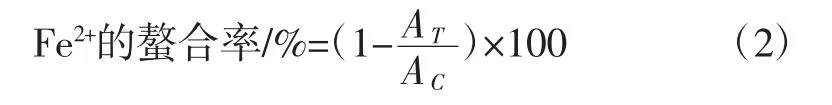
式中:AT为样品吸光度;AC为对照样吸光度。
1.2.5 Zn2+螯合能力测定
样品锌离子螯合能力的测定参照Wang等[12]的方法,计算方法略有改动。
锌-肽螯合反应:分别取1.0 mL 0.05 mol/L ZnSO4(乙醇溶解)于4个25 mL离心管中,并分别缓慢滴入10 mL 2%的乳清分离蛋白和3份不同脱酰胺度的脱酰胺乳清分离蛋白样品溶液(用体积分数为50%的乙醇溶解),室温下搅拌反应1 h,直至有白色沉淀生成。
螯合锌含量的测定:分别取上述反应液5 mL于4个烧杯中浓缩至近干,加入15 mL无水乙醇,混匀后5 000 r/min离心20 min,取沉淀并用蒸馏水定容至50 mL。用乙二胺四乙酸(elhylene diamine tetraacetic acid,EDTA)络合滴定法测定螯合态锌的含量。移取20 mL容量瓶中的溶液至锥形瓶中,加两滴二甲酚橙指示剂(0.5%水溶液),滴加质量分数为20%的六亚甲基四胺-盐酸缓冲液(pH 5.0)至溶液呈稳定的紫红色后再加入4 mL缓冲液,用已标定的0.001 mol/L EDTA溶液滴定至溶液由紫红色变成黄色,记录EDTA的消耗量。样品的Zn2+螯合能力计算公式见式(3):

式中:AP为沉淀中Zn2+含量,mg;P为样品蛋白质含量,g。
1.2.6 界面性质测定
1.2.6.1 乳化性及乳化稳定性的测定
分别配置浓度为0.01%、0.02%、0.03%和0.04%的脱酰胺蛋白溶液。取150 mL蛋白溶液与50 mL大豆油混合,12 000 r/min均质 1 min,静置,在 0 min和10 min时从容器底部取50μL乳状液于试管中,加5mL 0.1%的十二烷基磺酸钠(sodium dodecylsulphate,SDS),充分混匀,于500 nm处测定吸光度值(以0.1%的SDS调整仪器零点)[13]。乳化活性指数及乳化稳定性的计算方法见公式(4)、(5)。
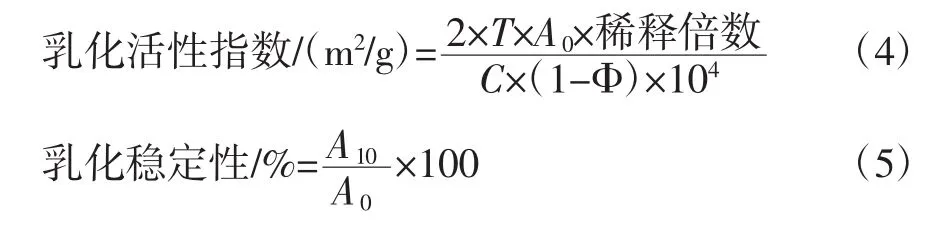
式中:T=2.303;A0为零时刻的吸光度值;C为蛋白质浓度,g/mL;Φ为溶液中油的体积分数;A10为静置10 min后的吸光度值。
1.2.6.2 起泡性及泡沫稳定性的测定
准确称取2 g乳清分离蛋白(脱酰胺乳清分离蛋白),加入100 mL水,置于装料杯中,在高速组织捣碎机中搅打1 min,迅速倒入500 mL量筒中,记录泡沫体积a;静置10 min后,再次测量泡沫体积b[14]。起泡性与泡沫稳定性计算公式见公式(6)、(7)。

1.3 统计分析
采用SPSS16.0软件中的单因素方差分析(Oneway ANOVA)和Duncan’s多重比较法进行数据统计分析,p<0.05为差异显著,p<0.01为差异极显著。所有指标的数据均以平均值±标准偏差表示。用Excel 2007软件作图。
2 结果与分析
2.1 乳清分离蛋白限制性脱酰胺反应条件
通过研究发现,酶添加量分别为 0.2、0.4、0.6、0.8、1.0 U/g乳清分离蛋白时,谷氨酰胺酶对乳清分离蛋白的脱酰胺作用随酶添加量的增加而增大(如图1),而酶添加量分别为0.8、1.0 U/g乳清分离蛋白时,脱酰胺度没有大幅度变化,基本一致。
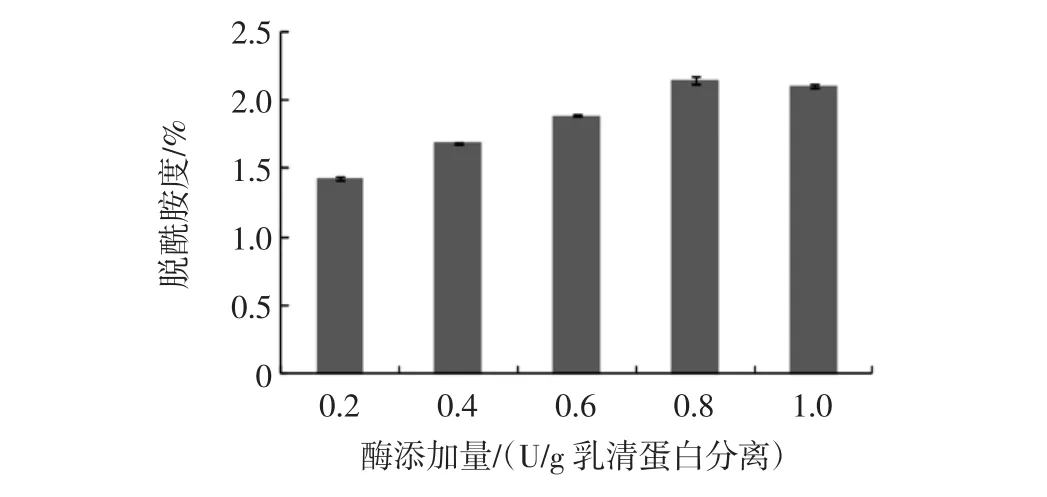
图1 酶添加量对乳清分离蛋白脱酰胺度的影响(n=3)Fig.1 The effect of addition level of glutaminase on the degree of deamidation of WPI(n=3)
脱酰胺度随反应时间的延长而增加(如图2)。
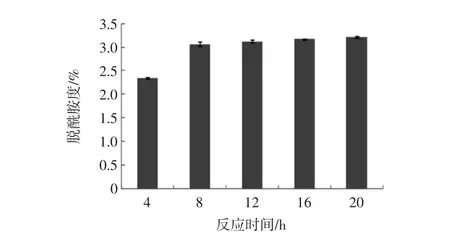
图2 反应时间对乳清分离蛋白脱酰胺度的影响(n=3)Fig.2 The effect of reaction time of glutaminase on the degree of deamidation of WPI(n=3)
当反应达到8 h以上时,脱酰胺度趋于平缓状态。说明即使继续延长反应时间,也不会增加脱酰胺度。因此,酶添加量选取0.8 U/g乳清分离蛋白、反应时间在8 h以下为宜。
乳清分离蛋白的脱酰胺反应还与反应温度及pH值有关(如图3、图4)。
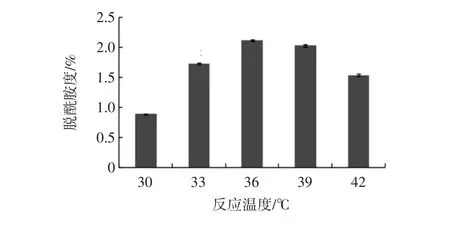
图3 反应温度对乳清分离蛋白脱酰胺度的影响(n=3)Fig.3 The effect of reaction temperature on the degree of deamidation of WPI(n=3)
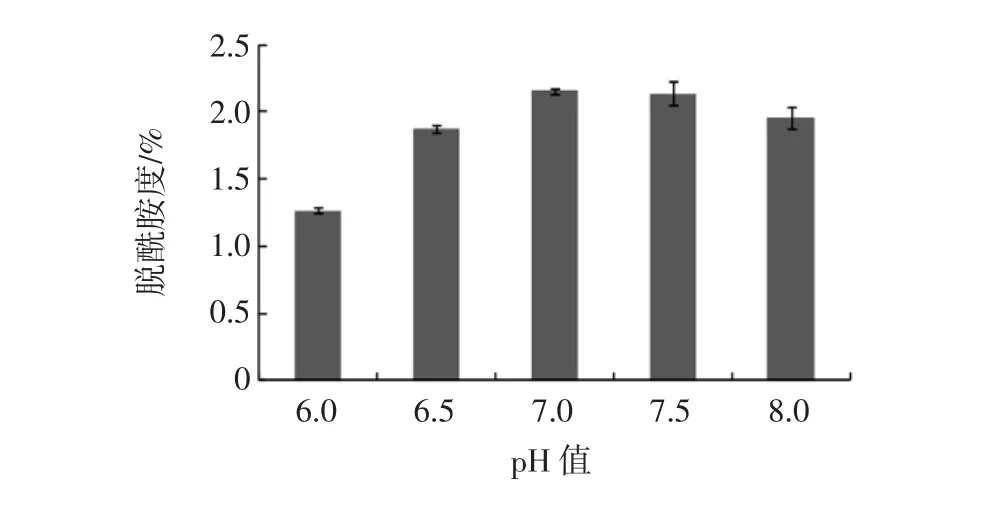
图4 反应pH值对乳清分离蛋白脱酰胺度的影响(n=3)Fig.4 The effect of pH on the degree of deamidation of WPI(n=3)
随着反应温度的提高,乳清分离蛋白脱酰胺度呈先上升后下降的趋势,当温度为36℃时,脱酰胺度(2.1%)达到最高。另外,反应pH值对乳清分离蛋白脱酰胺度也有不同程度的影响。当pH值为7时,乳清分离蛋白脱酰胺度达到最高,这说明,谷氨酰胺酶在pH7条件下作用于乳清分离蛋白时,其酶活性达到最高。
因此,可以初步确定乳清分离蛋白限制性脱酰胺反应的适宜条件为:乳清分离蛋白溶液浓度5%、酶添加量0.8 U/g乳清分离蛋白、反应温度36℃、反应pH为7。在此条件下,反应分别进行1、4、8 h时,乳清分离蛋白脱酰胺度分别为1.5%、2.3%、2.9%,在以后的研究中分别称为脱酰胺乳清分离蛋白(deamidated whey protein isolated,DWPI)1、2、3(或 DWPI 1、DWPI 2、DWPI 3)。
2.2 脱酰胺对乳清分离蛋白界面性质的影响
2.2.1 乳化性质
食品蛋白质的功能特性与分子结构具有高度相关性,因此脱酰胺反应也必定影响到乳清分离蛋白的功能性质。乳清分离蛋白、脱酰胺乳清分离蛋白的乳化活性及乳化稳定性的相关评价结果如图5、图6所示。本研究选取脱酰胺反应1 h和8 h的乳清分离蛋白制品DWPI 1、DWPI 3作为分析对象。
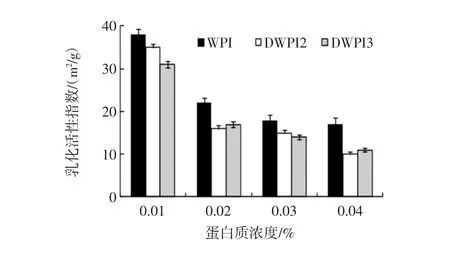
图5 乳清分离蛋白与脱酰胺乳清分离蛋白的乳化活性指数(n=3)Fig.5 Emulsifying activity index of WPI and DWPI products(n=3)
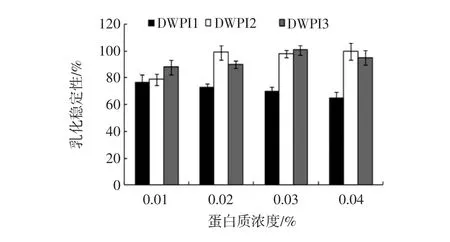
图6 乳清分离蛋白与脱酰胺乳清分离蛋白的乳化稳定性(n=3)Fig.6 Emulsifying stability index of WPI and DWPI products(n=3)
由图5可知,与乳清分离蛋白相比,4个浓度下的脱酰胺乳清分离蛋乳状液的乳化活性指数均呈降低趋势,而乳化稳定性都有不同程度的升高,尤其在高浓度下,脱酰胺乳清分离蛋白较乳清分离蛋白而言具有非常高的乳化稳定性。当蛋白质浓度为0.03%时,DWPI 1和DWPI 3的乳化稳定性接近100%,而WPI的乳化稳定性仅为70%。这一结果显示,经谷氨酰胺酶脱酰胺的乳清分离蛋白制品提高了乳化稳定性,而削弱了乳化活性。乳清分离蛋白经脱酰胺后,会生成更多的谷氨酸残基,从而乳清分离蛋白分子增加了许多带负电荷的羧基。从而导致修饰后的蛋白质分子疏水性降低,蛋白质分子间的静电斥力增大,与水结合的能力有所提高。从理论上讲,蛋白质的疏水性降低会导致蛋白质修饰产物的乳化活性降低,而蛋白质间的静电斥力和与水结合的能力增加,导致乳化稳定性提高。这也解释了,脱酰胺乳清分离蛋白的乳化活性比乳清分离蛋白的低,而乳化稳定性有所提高的原因。
2.2.2 泡沫性质
经过对比乳清分离蛋白与脱酰胺乳清分离蛋白制品(DWPI 1、DWPI 3)的另外一个界面性质—泡沫性质发现,在同一浓度下,脱酰胺乳清分离蛋白的起泡性比乳清分离蛋白的起泡性有所提高,并且随着脱酰胺度的增加,起泡性随着增加,而泡沫稳定性随脱酰胺度的增加有所降低(如图7)。
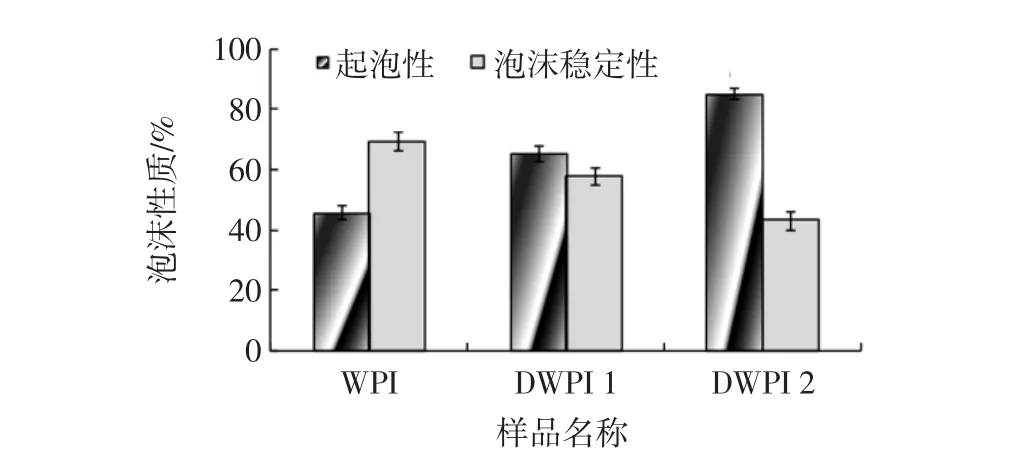
图7 乳清分离蛋白与脱酰胺乳清分离蛋白的泡沫性质(n=3)Fig.7 Foam properties of WPI and DWPI products(n=3)
本研究中,DWPI 3的起泡性为85.2%,为WPI的1.86倍;而WPI的泡沫稳定性是DWPI 3的1.6倍。究其原因,起泡性的提高与脱酰胺度有关。
2.3 乳清分离蛋白及脱酰胺乳清分离蛋白对Fe2+/Zn2+的螯合能力
有研究表明,蛋白质水解物具有与金属离子如铁、锌等螯合的能力,进而提高矿物质的溶解性和生物利用率[15]。本试验测定了乳清分离蛋白及脱酰胺乳清分离蛋白产物DWPI 1、DWPI 2、DWPI 3与二价金属离子的螯合能力,研究脱酰胺度对乳清分离蛋白与二价金属离子螯合能力的影响,结果如表1所示。
从表1中能够看出,与乳清分离蛋白相比,脱酰胺乳清分离蛋白螯合二价铁的能力略有增加,当脱酰胺度达到2.9%时,DWPI 3与Fe2+螯合能力达到(2.98±0.19)%,比乳清分离蛋白的螯合能力提高了49.7%,即乳清分离蛋白残基上谷氨酰胺转化为谷氨酸的量越多,与二价铁螯合能力越强。

表1 乳清分离蛋白与脱酰胺乳清分离蛋白产物的Fe2+、Zn2+螯合能力(n=3,p<0.05)Table 1 Iron,zinc chelating activity of WPI or DWPI products(n=3,p<0.05)
同样,乳清分离蛋白及脱酰胺产物与Zn2+螯合能力的测定结果显示,随着脱酰胺度的增加,脱酰胺蛋白产物的Zn2+螯合能力呈现增大的趋势,DWPI 3的Zn2+螯合能力较WPI的螯合能力提高了27.3%。Wang等[16]研究结果表明,蛋白质水解物与Zn2+螯合能力不同,是由其游离氨基的含量引起的,因此脱酰胺乳清分离蛋白表现出不同的Zn2+螯合能力也可能与其游离氨含量不同有关。
食品蛋白质螯合金属离子能力越强,其相关生物活性就越强,如对Fe2+螯合能力越强,其蛋白质抗氧化能力越强;对Zn2+螯合能力越强,其蛋白质ACE抑制作用也相应提高[17]。因此,脱酰胺乳清分离蛋白与Fe2+/Zn2+的螯合能力有益于促进蛋白的其他生物活性。
3 结论
以脱酰胺度为评价指标,通过单因素分析考察酶添加量、反应温度、反应pH值及反应时间对乳清分离蛋白限制性脱酰胺的影响并确定适宜的脱酰胺条件:乳清分离蛋白的浓度为5%、谷氨酰胺酶添加量0.8 U/g乳清分离蛋白、36℃、pH 7。在此适宜反应条件下分别反应1、4、8 h,制得3种脱酰胺乳清分离蛋白,其脱酰胺度分别为1.5%、2.3%、2.9%。限制性脱酰胺对乳清分离蛋白的一些功能性质有了不同程度的改变,其中脱酰胺反应提高了乳清分离蛋白的乳化稳定性、起泡性及对二价金属离子Fe2+/Zn2+的螯合能力,并随着脱酰胺度的增加而增加;而脱酰胺乳清分离蛋白的乳化活性及泡沫稳定性由于限制性脱酰胺作用而有所下降。研究结果可以为开发多功能食品提供很好的基料以及理论基础。

