亚麻籽粕木酚素的纯化及对DNA氧化损伤保护
张永超 张 利 张云松 姜媛媛 吴一超
(四川农业大学理学院,四川 雅安 625014)
亚麻籽是亚麻科(Linaceae)亚麻属(LinumL.)一年生草本植物亚麻(LinumusitatissimumL.)的成熟种子,其成分主要包括油脂、蛋白质、矿物质、亚麻籽胶、维生素、木酚素等[1-2]。木酚素是一类由双分子苯丙素合成的天然酚类化合物,具有C6—C4—C6的基本骨架(图1),广泛分布在多种植物中,其中亚麻籽中含量最高[3-4]。作为植物雌激素及良好的天然抗氧化剂,木酚素具有多方面的药理活性,包括抗肿瘤[5]、预防心血管疾病[6]、预防骨质疏松和糖尿病[7-8]等。传统亚麻籽的应用仅局限于榨油,榨油后的副产物亚麻籽饼粕除少量用于动物饲料外,一般作为肥料或者废物处理,造成了资源的极大浪费[9-10]。因此,以亚麻籽饼粕为原料建立快速分离制备木酚素的方法对提高资源的有效利用率具有重要意义。
传统分离纯化亚麻木酚素的方法多采用C18填充柱色谱、制备型C18色谱柱和硅胶层析柱色谱。上述方法虽样品处理量大,但操作较为繁琐、分离效率较低[11]。Andreas等[12]采用高速逆流色谱对亚麻木酚素提取物进行纯化,产品纯度达到90%以上,该方法虽消除了不可逆吸附,但在选择两相溶剂系统时由于缺乏理论指导而较为困难,且往往需要在分离之前采用吸附树脂进行初步分离(富集)。张文斌等[13]采用X-5型大孔吸附树脂分离纯化亚麻木酚素,产品纯度达到了65.7%。大孔吸附树脂虽然具有吸附性能好、效率高、解吸方便等优点,但是多适用于样品的粗分离,如需含量更高的产品应结合其它分离方法[14]。大孔吸附树脂或硅胶柱层析与半制备高效液相色谱法(HPLC)联用具有分离速度快、产品纯度和回收率高等优点,已被广泛应用于植物有效成分的分离制备中[15],然而目前未见文献报道采用大孔吸附树脂与半制备高效液相色谱联用纯化亚麻木酚素。
机体受到辐射或免疫力低下时,体内的自由基会大量产生,如短时间难以消除将会氧化体内大分子进而损伤组织或器官,如:自由基引起脂质过氧化、诱导DNA损伤等[16-18]。DNA的持续损伤,可能会引起DNA复制或翻译错误,从而导致点突变或染色体重排及经由各种信号途径引起应激反应,引起细胞衰老,引发老年病[19]。木酚素作为植物雌激素及良好的天然抗氧化剂,具有一定消除过氧化的能力[5-8]。因此,本研究拟采用大孔吸附树脂与半制备高效液相色谱联用技术纯化亚麻木酚素,并探究其对质粒DNA氧化损伤的保护作用,旨在为亚麻籽饼粕的高效开发利用提供一种新思路。
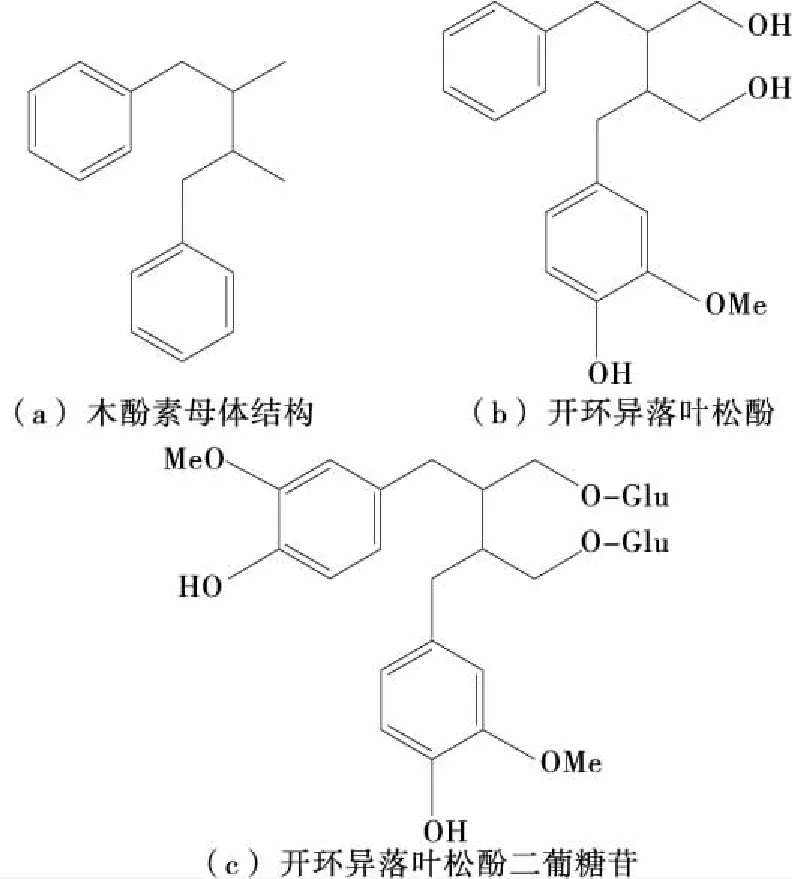
图1 木酚素母体结构及亚麻籽中主要的木酚素
1 材料与方法
1.1 材料与仪器
亚麻籽粕:菏泽中禾健元生物科技有限公司;
亚麻木酚素标准品:纯度≥98%,成都曼思特生物科技有限公司;
乙腈、磷酸:色谱纯,赛默飞世尔科技(中国)有限公司;
NaOH、HCl、甲醇、乙醇、乙酸乙酯:分析纯,成都市科隆化学品有限公司;
pH 5.5~9.0精密试纸:上海三爱思试剂有限公司;
D101型大孔吸附树脂:天津波鸿树脂科技有限公司;
质粒DNA:由四川农业大学生命科学学院提供;
琼脂糖、6×DNA Loading Buffer、λ DNA/Hind III Marker:宝生物工程(大连)有限公司;
高效液相色谱系统:LC-20A型,包括SPD-20A紫外—可见光检测器、SIL-20A自动进样器、2LC-10ADvp泵,日本岛津公司;
半制备液相色谱系统:D-P6100型,配有2台NP7000输液泵、NU3000C紫外检测器,江苏汉邦科技有限公司;
旋转蒸发器:RE52CS-1型,上海亚荣生化仪器厂;
真空冷冻干燥机:LGJ-12型,北京松源华兴科技发展有限公司;
恒温水浴锅:B-260型,上海亚荣生化仪器厂;
紫外可见分光光度计:A390型,上海翱艺仪器有限公司;
循环水式多用真空泵:SHZ-D(III)型,巩义市英峪高科仪器厂;
高速冷冻离心机:HC-3018R型,安徽中科中佳科学仪器有限公司;
电泳仪及凝胶成像系统:Bio-Rad型,美国伯乐公司;
电子分析天平:BSA124S型,北京赛多利斯仪器系统有限公司;
玻璃层析柱:2.5 cm×40 cm,上海华美实验仪器厂。
1.2 方法
1.2.1 亚麻木酚素HPLC检测方法的建立 精密称取适量亚麻木酚素标准品,用甲醇定容于10 mL容量瓶中,制成0.144 mg/mL 的标准品储备液,于4 ℃保存备用。通过对标准品储备液全波长扫描,确定HPLC分析波长。选用Agilent C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为乙腈(A)-0.1%磷酸水(B),进样量10 μL,流速1.0 mL/min,柱温35 ℃。考察等度洗脱(0~30 min,20% A∶80% B)和梯度洗脱(0~10 min,15%~20% A;10~15 min,20%~80% A)2种方式对亚麻木酚素的分离效果,从而建立亚麻木酚素HPLC检测方法。
1.2.2 亚麻籽粕中木酚素的提取 称取亚麻籽粕50 g,按1∶10 (g/mL)的料液比加入70%甲醇溶液浸泡3 h,回流提取1 h,过滤,滤渣二次提取,合并滤液。滤液加入4 mol/L的NaOH溶液至最终碱浓度为0.1 mol/L,碱解30 min,加入10% HCl调pH至5.0~5.5,静置30 min,离心(4 500 r/min,10 min),浓缩滤液至原体积的1/20。浓缩液用乙酸乙酯萃取3次,得亚麻木酚素萃取液,备用。
1.2.3 大孔吸附树脂与半制备HPLC联用纯化亚麻木酚素
亚麻木酚素萃取液经D101型大孔吸附树脂洗脱(树脂的预处理参考文献[20~21])。先用蒸馏水以1 mL/min 的速率除去多糖、蛋白质等杂质,然后在相同条件下依次采用10%,20%,30%,40%的乙醇进行洗脱,每个梯度1.5个柱体积。收集洗脱液,进行检测后合并目标组分洗脱液,浓缩、冷冻干燥得到亚麻木酚素纯化物I,4 ℃保存备用。
称取淡黄色的亚麻木酚素纯化物I适量,70%甲醇溶液溶解稀释至42 mg/mL。以Megres C18(30 mm×250 mm,10 μm)为色谱柱,乙腈(A)-0.1%磷酸水(B)为流动相,检测波长280 nm,柱温30 ℃,通过改变流动相的组成(15%~25% A∶85%~75% B)、流速(35,40,45 mL/min)、上样量(采用体积超载的方式,固定样品溶液的浓度为42 mg/mL,依次进样1,2,3 mL)确定半制备HPLC分离亚麻木酚素的最优条件。在该条件下收集主色谱峰洗脱液,冷冻干燥,得到亚麻木酚素纯化物II。
1.2.4 亚麻木酚素纯化物II对质粒DNA氧化损伤的保护作用 采用琼脂糖凝胶电泳法研究亚麻木酚素纯化物II对质粒DNA氧化损伤的保护作用,参照张溢等[22]方法并作适当修改。
对H2O2诱导的质粒DNA氧化损伤的保护作用:精密量取2 μL质粒DNA,加入4 μL不同浓度的亚麻木酚素水溶液(0.40,0.35,0.30,0.25,0.20,0.15,0.10,0.05,0.00 μg/μL),混匀,迅速加入10%的H2O22 μL,用灭菌水补足反应体系至10 μL。37 ℃水浴20 min后,90 V电压下琼脂糖凝胶电泳30 min,结束后在凝胶成像系统下观察电泳结果。
对光解条件下H2O2诱导的质粒DNA氧化损伤的保护作用(H2O2在光解作用下可以产生羟基自由基)[23]:将上述方法中亚麻木酚素水溶液的浓度变为0.07,0.09,0.12,0.15 μg/μL,37 ℃水浴20 min变为水浴10 min后紫外光照射10 min,其它条件不变。
2 结果与分析
2.1 亚麻木酚素HPLC检测方法的建立
通过对标准品储备液全波长扫描,确定亚麻木酚素在280.5 nm处具有最大吸收波长(图2)。因此,选择280 nm作为检测波长。结果表明:采用梯度洗脱,0~10 min,15%~20% A;10~15 min,20%~80% A时,亚麻木酚素可以在15 min内获得良好的分离度。在此条件下,亚麻木酚素标准品的色谱图见图3。
2.2 半制备HPLC分离亚麻木酚素条件的优化
2.2.1 流动相的组成 在上样量1 mL,流速35 mL/min的条件下,考察了流动相的组成对亚麻木酚素分离效果的影响,结果见图4。由图4可知,采用等度洗脱时分离度较低,且若增大流动相中B的比例可以使分离时间明显缩短,但与此同时亚麻木酚素与其附近杂质峰之间的分离度也逐渐下降。采用梯度洗脱时,5 min以后再将乙腈的比例由20%增至25%时分离度(1.67)及分离时间(10.136 min)均比较理想。故最优洗脱条件为梯度洗脱,0~5 min,15%~20% A;5~10 min,20%~25% A;10~15 min,25% A。
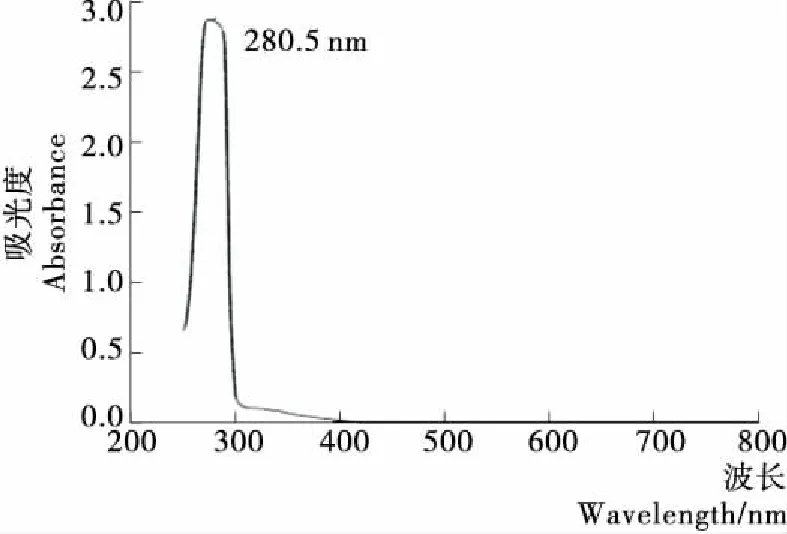
图2 亚麻木酚素标准品的紫外光谱图
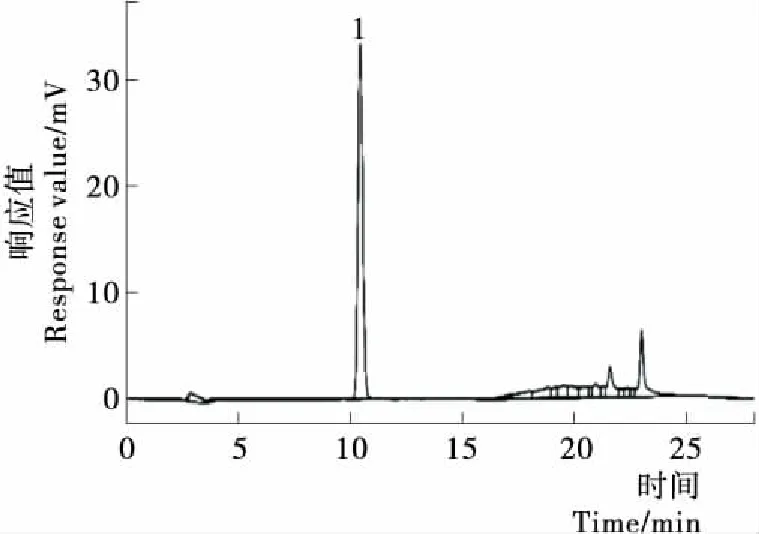
图3 亚麻木酚素标准品的色谱图
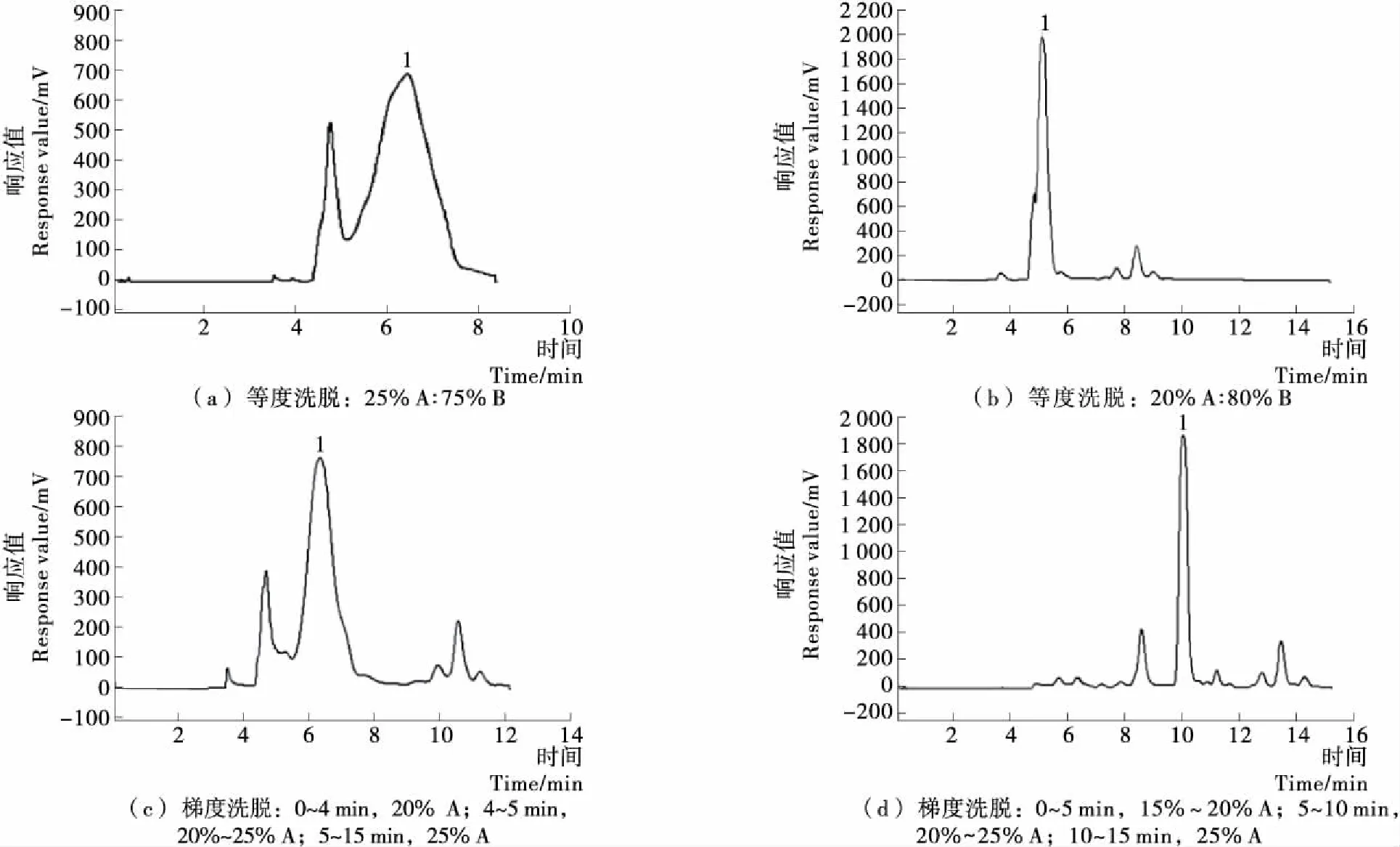
图4 流动相的组成对分离效果的影响
2.2.2 流动相的流速 在上样量1 mL,最优洗脱条件时,考察了流动相流速对分离效果的影响,结果见图5。图5(a)、(b)的流速分别为40,45 mL/min。由图5可知,随着流速的增加,分离时间逐渐缩短,但亚麻木酚素与其附近杂质峰之间的分离度也逐渐下降。比较图5(a)、(b)与图4(d),发现当流速为35 mL/min时,亚麻木酚素的分离度(1.67)及分离时间(10.136 min)均比较理想,故选择35 mL/min为最佳流速。
2.2.3 上样量 在流速35 mL/min,最优洗脱条件时,考察了上样量对分离效果的影响,结果见图6。图6(a)、(b)的上样量分别为84,126 mg。由图6可知,随着上样量的增加,相邻2组分间的分离度减小,当上样量到达一定量时,相邻组分无法实现分离。上样量为126 mg时,亚麻木酚素与其附近的杂质峰分离度较低,考虑产品的纯度及分离效率,选择上样量为84 mg。
综上,使用半制备HPLC分离亚麻木酚素的最佳条件为:Megres C18(30 mm×250 mm,10 μm)色谱柱,流动相乙腈(A)-0.1%磷酸水(B)进行梯度洗脱0~5 min,15%~20% A;5~10 min,20%~25% A;10~16 min,25% A,检测波长280 nm,进样量2 mL,流速35 mL/min,柱温30 ℃。在该条件下,收集色谱图中标1的组分[图6(a)],冷冻干燥获得亚麻木酚素纯化物II。
2.3 纯度分析
采用已建立的亚麻木酚素含量检测HPLC方法,绘制亚麻木酚素的标准曲线Y=4.369 1×106X-1.187 2×102,R2=0.999 99,线性范围5.76 ~144.00 μg。亚麻木酚素标准品、萃取液、纯化物I、纯化物II的色谱图见图7。图7中标1的色谱峰峰保留时间一致,均在10.5 min。定量分析结果表明:亚麻木酚素萃取液、纯化物I、纯化物II的纯度依次为18%,60%,98%。
大孔吸附树脂是一类新型高分子材料,具有吸附性能好、效率高、解吸方便等优点,在分离纯化中草药活性成分方面显示出极大的优越性,但是所得的样品纯度往往不高,多适用于粗分离[14]。半制备高效液相色谱分离纯化具有速度快、产品纯度和回收率高等优点,目前已被广泛应用于植物有效成分的分离制备中,但是成本较高且分离量有限[15]。若使样品在进行半制备高效液相色谱纯化之前先得到粗分离(富集),则可以取得更好的纯化效果。因此,本试验通过大孔吸附树脂与半制备高效液相色谱联用技术纯化亚麻木酚素,产品纯度可达到98%,与杨雪艳(纯度59.30%)[20]、杨宏志(纯度66.71%)等[21]比较具有较大优势。
2.4 亚麻木酚素纯化物II对质粒DNA氧化损伤的保护作用
亚麻木酚素对H2O2诱导的质粒DNA氧化损伤的保护作用见图8(a)。质粒DNA在自然状态下为超螺旋结构[24],电泳结果显示为一条谱带(泳道10)。在诱导处理过程中部分DNA由超螺旋结构变为开环结构,呈现出2条谱带,如图8(a)泳道8和泳道9显示。此外,电泳条带的亮度反映了DNA含量的多少,条带越亮说明DNA含量越高;反之,含量越低[25-26]。因此,由图8(a)可知:当亚麻木酚素浓度为0.05 μg/μL时,对H2O2诱导的质粒DNA氧化损伤无保护作用;当浓度在0.1~0.4 μg/μL时,亚麻木酚素对H2O2诱导的质粒DNA氧化损伤具有显著保护作用(与泳道10对比)。
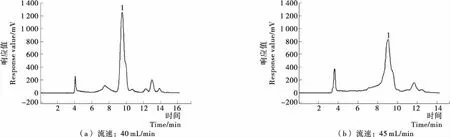
图5 流动相的流速对分离效果的影响

图6 上样量对分离效果的影响
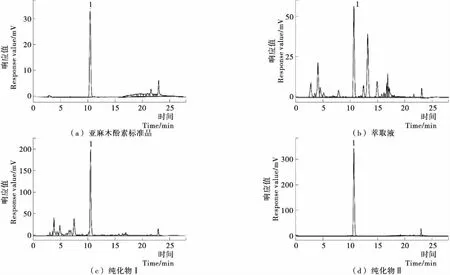
图7 HPLC色谱图
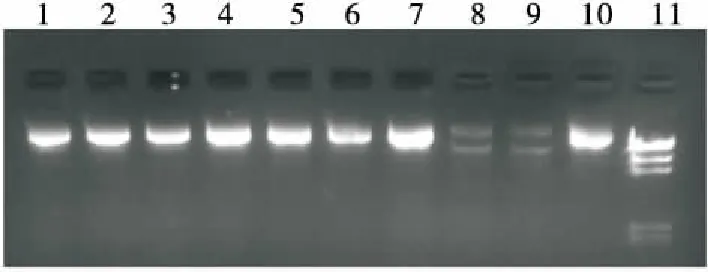
泳道1~9. DNA+H2O2+不同浓度亚麻木酚素(0.40,0.35,0.30,0.25,0.20,0.15,0.10,0.05,0.00 μg/μL) 泳道10. DNA 泳道11. λDNA/Hind III Marker
(a) H2O2诱导质粒DNA损伤
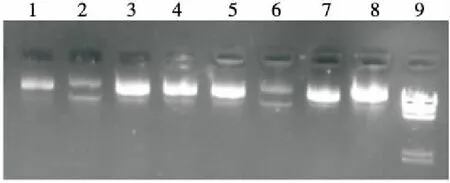
泳道1、3、5、7. DNA+H2O2+不同浓度亚麻木酚素(0.07,0.09,0.12,0.15 μg/μL) 泳道2、4、6. DNA+H2O2+UV+不同浓度亚麻木酚素(0.07,0.09,0.12 μg/μL) 泳道8. DNA 泳道9. λDNA/Hind III Marker
(b) H2O2光解反应诱导质粒DNA损伤
图8 不同浓度亚麻木酚素水溶液对质粒DNA损伤保护作用的电泳图
Figure 8 Electrophoretic pattern of Plasmid DNA in the presence or absence of SDG
根据亚麻木酚素对H2O2诱导质粒DNA氧化损伤的保护作用的研究结果,进一步探讨了亚麻木酚素对光解条件下H2O2诱导质粒DNA氧化损伤的保护作用,结果见图8(b)。由图8(b)可知,浓度在0.07 ~0.12 μg/μL时,亚麻木酚素对H2O2诱导的质粒DNA氧化损伤具有保护作用,但对光解条件下H2O2诱导的质粒DNA氧化损伤并无显著的保护作用。
通过研究亚麻木酚素对H2O2诱导的质粒DNA氧化损伤以及H2O2光解反应诱导的质粒DNA氧化损伤的保护作用,可间接说明其是否具有抗氧化能力。本研究结果表明,亚麻木酚素对H2O2诱导的质粒DNA氧化损伤的保护作用较H2O2光解反应诱导的质粒DNA氧化损伤的强。一方面是由于DNA在紫外光处理下更易遭到破坏[24],另一方面可能是设置的亚麻木酚素浓度太低,未能起到保护作用或是亚麻木酚素在紫外光照射下发生了分解[27-28],导致其丧失了原有的抗氧化能力,但需要试验进一步验证。
3 结论
本研究以亚麻籽粕为原料,采用回流法提取木酚素,提取液经乙酸乙酯萃取、D101型大孔吸附树脂柱分离后,再通过半制备HPLC纯化,获得了纯度为98%的亚麻木酚素。优化得到半制备HPLC纯化亚麻木酚素的条件为:Megres C18(30 mm×250 mm,10 μm)为色谱柱,乙腈(A)-0.1%磷酸水(B)为流动相进行梯度洗脱0~5 min,15%~20% A;5~10 min,20%~25% A;10~16 min,25% A,检测波长280 nm,柱温30 ℃,流速35 mL/min,进样量2 mL。亚麻木酚素质量浓度>0.07 μg/μL时,对H2O2诱导的质粒DNA氧化损伤具有较好的保护作用,但在测定浓度范围内(0.07~0.12 μg/μL)亚麻木酚素对光解条件下H2O2诱导的质粒DNA氧化损伤的保护作用不显著。本研究为亚麻籽粕中木酚素的分离纯化提供了新思路。

