北沙参多糖的提取工艺、理化性质及生物活性研究
景永帅苏 蕾韩 钰张丹参张瑞娟吴兰芳郑玉光秦 璇
(1. 河北科技大学化学与制药工程学院,河北 石家庄 050018;2. 河北中医学院药学院,河北 石家庄 050200;3. 石家庄市第二医院康复国际部,河北 石家庄 050062)
北沙参为药用植物珊瑚菜(GlehnialittoralisFr. schmidt ex Miq.)的根,被《本草纲目》列为五参之一,是卫生部公布的药食两用资源,具有清补肺阴、和中降逆、涵养肝阴等效果[1-2]。主要有效成分为挥发油类、香豆素类、多糖类、苷类和聚炔类等,其中多糖类是含量最高的成分,具有抗氧化和调节机体免疫等功能[2-3]。
目前,对于北沙参多糖的研究,主要集中于提取工艺优化和生物活性研究,如荣立新等[4]通过制备阴虚小鼠模型,检测脾脏NK细胞杀伤活力、T淋巴细胞转化功能和小鼠血清抗绵羊红细胞抗体IgM含量,发现北沙参多糖具有一定的免疫调节活性。相美荣等[5]通过星点设计-响应面法,优化了北沙参多糖的热水浸提工艺,得到北沙参多糖的最大提取率为10.78%。与传统的热水浸提工艺相比,超声波辅助提取法因具有效率高、操作时间短、设备简单等优势,在食品和中药行业中有较好的应用[6]。但是,对于超声波最优工艺提取的北沙参多糖的理化性质和生物活性未见相关研究报道。
本试验拟选用超声波辅助提取法提取北沙参多糖,采用单因素试验和响应面法对北沙参多糖的提取工艺进行优化,并测定北沙参多糖的理化性质和生物活性,为北沙参多糖成分的进一步开发利用提供理论依据。
1 材料与方法
1.1 药品与试剂
北沙参:河北安国产,经河北中医学院药学院生药教研室郑玉光教授鉴定为伞形科珊瑚菜(GlehnialittoralisFr. schmidt ex Miq.)的根;
α-葡萄糖苷酶:1.0×105U/g,上海源叶生物科技有限公司;
1,1-二苯基-2-苦味基肼(DPPH):色谱纯,上海阿拉丁生化科技股份有限公司;
对硝基苯-α-D-吡喃葡萄糖苷(PNPG):分析纯,上海阿拉丁生化科技有限公司;
其他试剂为国产分析纯。
1.2 试验仪器
恒温水浴锅:HH-2型,江苏金坛宏华仪器厂;
旋转蒸发仪:EYELAN-1100型,东京理化株式会社;
超声波清洗器:KS-300DE型,昆山洁力美超声仪器有限公司;
多功能中药粉碎机:400Y型,永康市铂欧玉金制品有限公司;
紫外-可见分光光度计:UV-2550型,岛津仪器制造有限公司;
高速离心机:TGL-15B型,上海安亭科学仪器厂;
电子分析天平:AL204型,梅特勒-托利国际贸易有限公司;
差热—热重联用热分析仪:STD-2960型,美国TA仪器公司;
傅里叶变换红外光谱仪:S-100型,珀金埃尔默仪器有限公司。
1.3 方法
1.3.1 样品前处理 取北沙参药材200.0 g,粉碎,过40目筛,用3倍体积的95%乙醇回流提取2次,除去脂溶性成分,药渣50 ℃干燥后,备用。
1.3.2 单因素试验
(1) 超声提取时间对多糖提取率的影响:固定超声提取温度60 ℃,液料比20∶1 (mL/g),分别考察超声提取时间(10,20,30,40 min)对多糖提取率的影响。
(2) 超声提取温度对北沙参多糖提取率的影响:在液料比20∶1 (mL/g)、超声提取时间20 min的条件下,分别考察超声提取温度(20,40,60,80,90 ℃)对多糖提取率的影响。
(3) 液料比对多糖提取率的影响:固定超声提取温度60 ℃,超声提取时间20 min,分别考察液料比为[10∶1,15∶1,20∶1,25∶1,30∶1 (mL/g)]对多糖提取率的影响。
1.3.3 响应面分析 在单因素考察的基础上,以北沙参多糖提取率作为响应值,采用三因素三水平的响应面分析法,得到回归方程,确定多糖的最佳工艺条件,并重复最优工艺进行验证实验。所有试验均重复3次,利用统计分析软件Design Expert 8.0及Excel对试验结果进行分析。
1.3.4 北沙参多糖的理化性质测定
(1) 紫外-可见光谱分析:配制0.1 mg/mL的北沙参多糖溶液,用紫外-可见分光光度计在200~700 nm扫描[7]。
(2) 红外光谱分析:称取1.0 mg的北沙参多糖,与KBr粉末混匀后压片,红外光谱仪在4 000~500 cm-1波数内扫描[8]。
(3) 总糖含量的测定:采用苯酚-硫酸法[9]。
(4) 蛋白含量的测定:采用考马斯亮蓝法[10]。
(5) 热重分析:称取2.0 mg的北沙参多糖,温度由室温升至800 ℃,升温速率为10 ℃/min,进行热重分析,包括:差示扫描量热分析(differential scanning calorimetry,DSC)和热解重量分析(thermal gravimetric analysis,TGA)[11]。
1.3.5 北沙参多糖的生物活性
(1) DPPH自由基清除能力:参照文献[12]。
(2) OH自由基清除能力:参照文献[13]。
(3) 对α-葡萄糖苷酶活性抑制:取pH 6.81缓冲溶液3 mL 和2 mmol/L PNPG溶液0.8 mL,37 ℃孵育20 min,加入40 U/mLα-葡萄糖苷酶溶液1 mL,继续反应20 min,加1.0 mol/L碳酸钠1 mL终止反应,紫外-可见分光光度计在400 nm测吸光度值,为对照组A1。将体系中1 mLα-葡萄糖苷酶换为1 mL蒸馏水,其余条件不变,测定吸光度值,为空白组A2。
取pH 6.81缓冲溶液2 mL、2 mmol/L PNPG 0.8 mL,分别加入1 mL浓度分别为8.0,4.0,2.0,1.0,0.5 mg/mL的多糖溶液,同上法进行反应,并测吸光度值,为样品组A3。将体系中1 mLα-葡萄糖苷酶换为1 mL蒸馏水,其余条件不变,测定吸光度值,为样品对照组A4[14]。阿卡波糖作为阳性对照品。按式(1)计算抑制率。
(1)
式中:
R——抑制率,%;
A1——对照组的吸光度;
A2——空白组的吸光度;
A3——样品组的吸光度;
A4——样品对照组的吸光度。
2 结果与分析
2.1 单因素试验
2.1.1 提取时间对多糖提取率的影响 由图1可知,随着超声提取时间的延长,多糖提取率先上升后又趋于平缓,当提取时间超过20 min时,多糖的提取率不再发生明显的变化。因在一定的时间内,超声波的空化作用可提高多糖的提取率,但时间过长会由于机械剪切作用和热量聚集,降解多糖,从而使得多糖提取率不再增加,甚至降低。因此,选取20 min的超声提取时间作为Box-Behnken Design(BBD)试验设计的中心点。
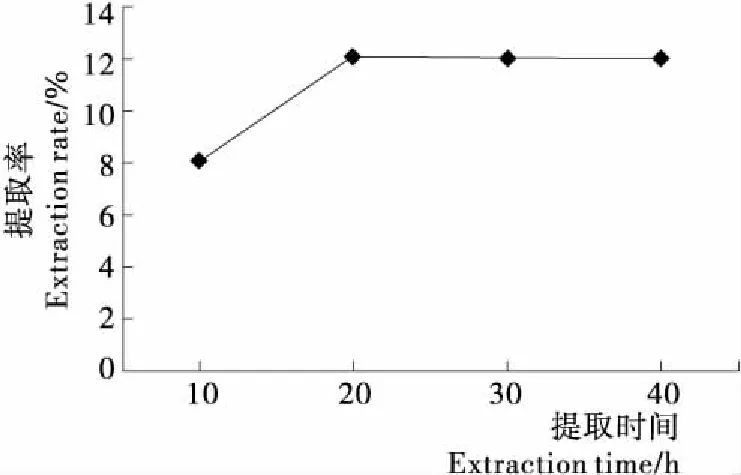
图1 提取时间对北沙参多糖提取率的影响
Figure 1 Effect of extraction time on extraction rate of polysaccharide fromRadixGlehniae
2.1.2 提取温度对多糖提取率的影响 由图2可知,随超声提取温度的增加,多糖提取率先上升后趋于平缓,这是由于升高温度有助于传质过程的发生,可加剧分子扩散,从而加快溶剂的渗透以及多糖类物质的溶出。当提取温度超过60 ℃ 时提取率上升已不明显,而且提取温度过高会难以控制试验条件,浪费资源,所以选取60 ℃提取温度为后续BBD试验设计的中心点。
2.1.3 液料比对北沙参多糖提取率的影响 由图3可知,多糖提取率随提取液料比的增加而增加,当液料比大于20∶1(mL/g)时,提取率趋于平缓。溶剂量的增加使得北沙参与提取溶液的接触面积增大,溶剂传质推动力增强,可使得多糖提取率和溶出速度增加。但溶剂体积过大可导致物料吸附溶剂的量也增大,多糖被物料吸附不易溶出。因此,选取20∶1 (mL/g)的液料比作为后续BBD试验设计的中心点。
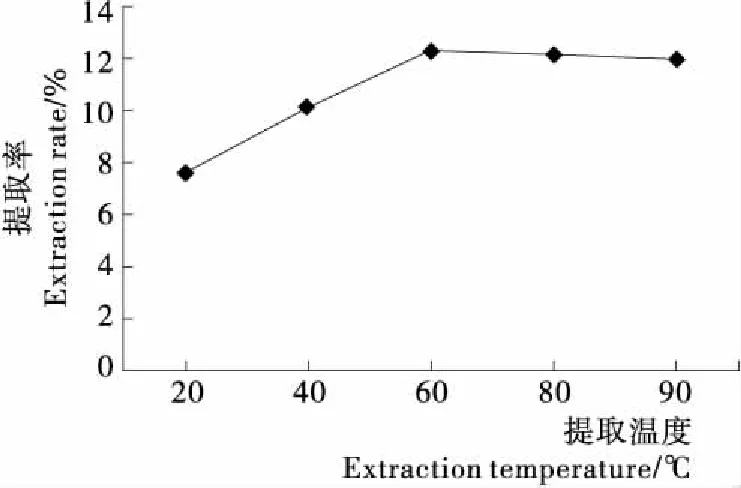
图2 提取温度对北沙参多糖提取率的影响
Figure 2 Effect of extraction temperature on extraction rate of polysaccharide fromRadixGlehniae

图3 液料比对北沙参多糖提取率的影响
2.2 北沙参多糖提取工艺优化
2.2.1 数学模型的建立与检验 基于上述单因素试验结果,采用响应面法对北沙参多糖提取工艺进行优化,以提取温度、提取时间、液料比为自变量,多糖提取率(Y)为响应值,根据BBD试验设计方法和原理,得出北沙参多糖提取率响应面分析试验设计因素与水平表(表1)。
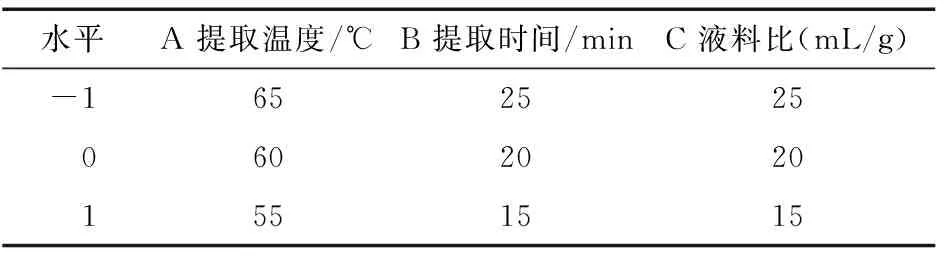
表1 响应面分析试验设计因素与水平
采用BBD试验设计方法设立17组试验,各因素和响应面值(多糖提取率)如表2所示,对数据进行二次回归拟合,分析各因素的效应,最后得到北沙参多糖提取最优工艺。
2.2.2 回归方程的建立与方差分析 利用软件对试验结果进行回归分析,拟合得到北沙参多糖提取率的二次多元回归方程为:
Y=11.76+0.62A+0.33B+0.25C+0.35AB+0.79AC-0.060BC-0.64A2-0.75B2-0.96C2。
(2)
表2 多糖提取率响应面试验设计和结果
Table 2 Response surface experimental design and result of polysaccharide extraction rate ofRadixGlehniae
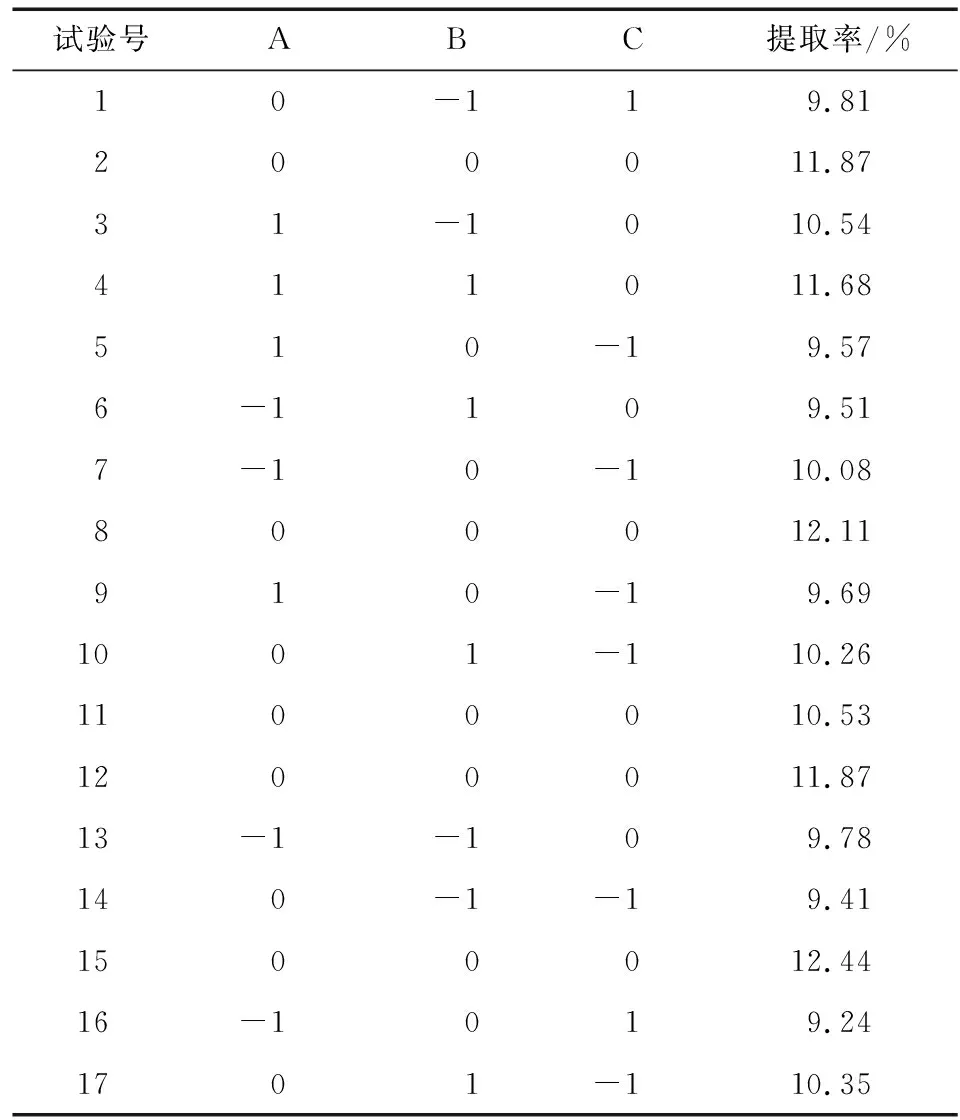
试验号ABC提取率/%10-119.81200011.8731-1010.54411011.68510-19.576-1109.517-10-110.08800012.11910-19.691001-110.261100010.531200011.8713-1-109.78140-1-19.411500012.4416-1019.241701-110.35
2.2.3 响应面分析 图4~6是因素(提取温度、提取时间、液料比)交互影响的响应面图和等高线图。由图4可知,随超声提取温度的升高,多糖提取率呈现先有所增加后缓慢降低的趋势。超声提取时间为15~25 min时,提取率呈现先增大后减小的趋势;等值线区域水平,表示两因素间具有显著的交互作用。由图5可知,随提取温度的升高,提取率呈现先增大后趋于平稳的趋势;随液料比的加大,提取率呈现先增大后减小的趋势。由图6可知,随液料比的加大及超声提取时间的延长,提取率呈现先增大后减小的趋势。
2.3 最佳工艺参数及验证
通过对二次多项式回归分析求最大值,得到超声波辅助提取多糖的最佳工艺为:液料比22∶1 (mL/g)、超声提取时间22.07 min、超声提取温度64.5 ℃,在此条件下,北沙参多糖提取率的理论预测值为12.17%,结合最优工艺参数与实际生产可操作性,对各因素的取值进行修正,最终确定超声波辅助提取最优工艺为:液料比22∶1 (mL/g)、超声提取时间22 min、提取温度65 ℃,经3次重复实验验证,北沙参多糖平均提取率为12.13%,与预测值相近,说明优化工艺重复性良好,最优工艺的结果可靠。
表3 北沙参多糖提取率回归模型方差分析
Table 3 Analysis of extraction rate regression model variance ofRadixGlehniaepolysaccharide
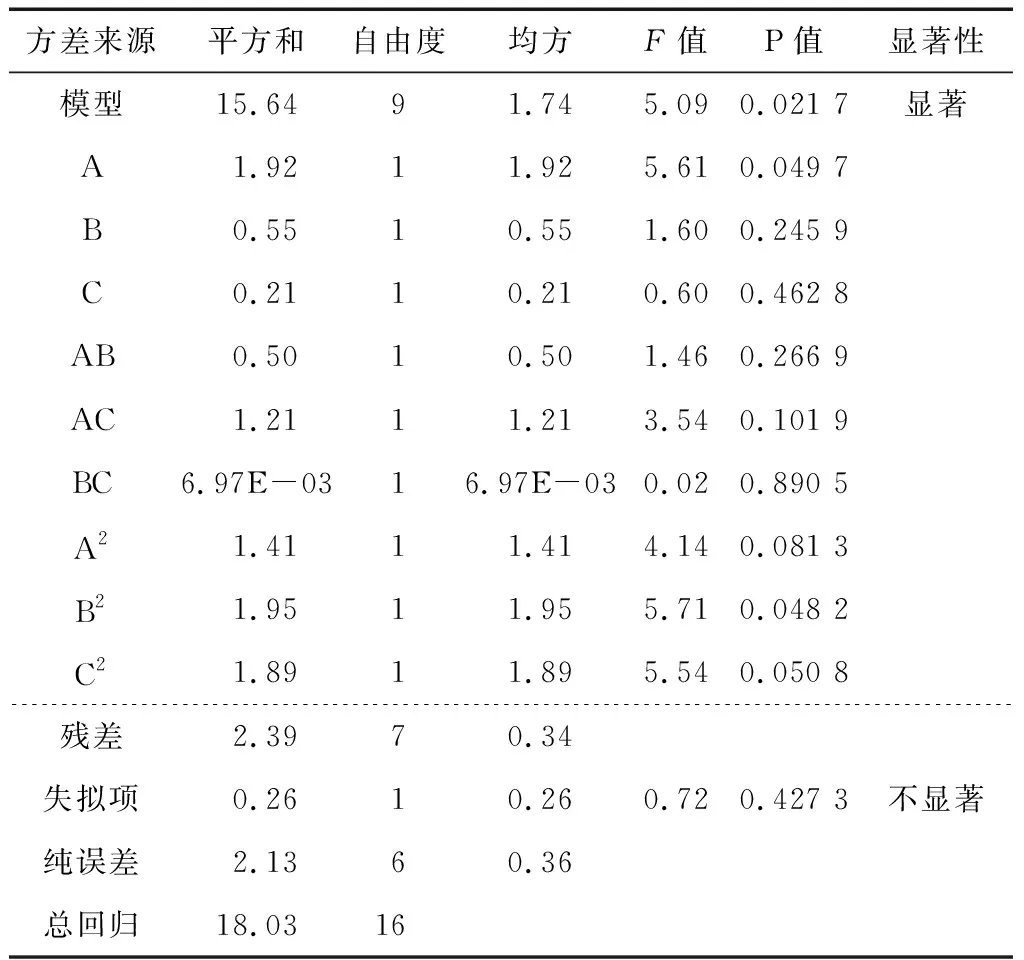
方差来源平方和自由度均方F值P值显著性模型15.6491.745.090.021 7显著A1.9211.925.610.049 7B0.5510.551.600.245 9C0.2110.210.600.462 8AB0.5010.501.460.266 9AC1.2111.213.540.101 9BC6.97E-0316.97E-030.020.890 5A21.4111.414.140.081 3B21.9511.955.710.048 2C21.8911.895.540.050 8残差2.3970.34失拟项0.2610.260.720.427 3不显著纯误差2.1360.36总回归18.0316
2.4 紫外-可见光谱分析蛋白类成分
由图7可知,北沙参多糖在280 nm处有一定的吸收峰,说明其可能含有蛋白类成分,蛋白含量采用考马斯亮蓝法测定。
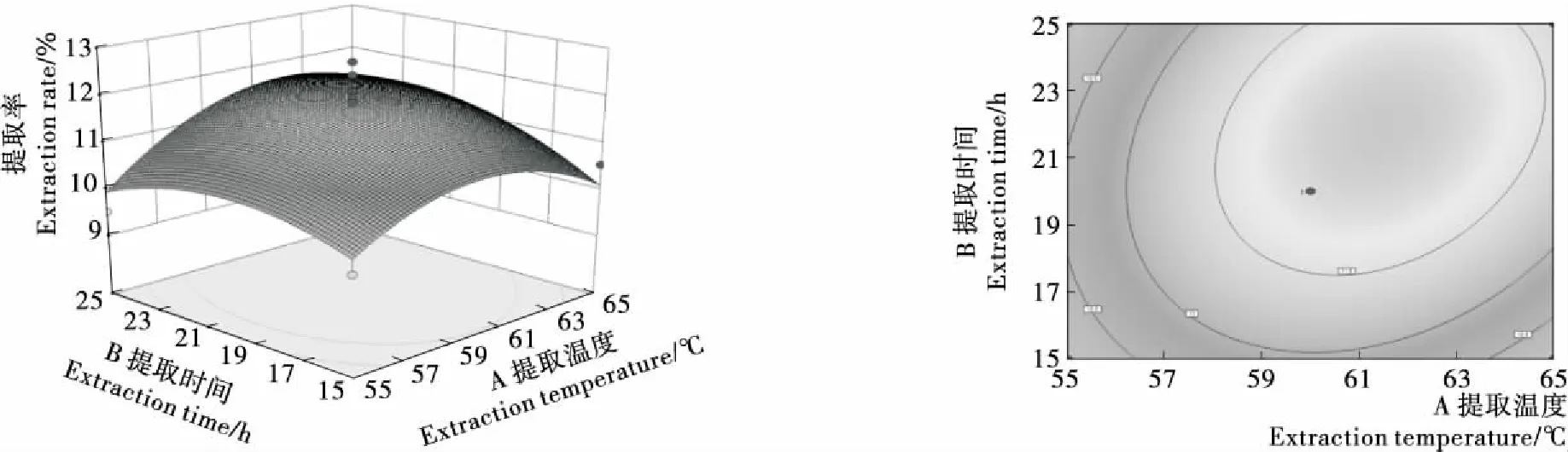
图4 提取温度和提取时间对北沙参多糖提取率的交互影响

图5 提取温度和液料比对北沙参多糖提取率的交互影响

图6 提取时间和料液比对北沙参多糖提取率的交互影响
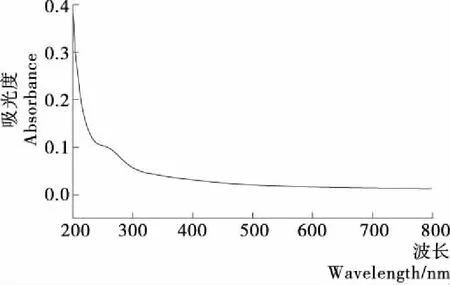
图7 北沙参多糖紫外-可见光谱图
2.5 北沙参多糖中蛋白质含量
由标准曲线得到的回归方程为y=0.690 71x+1.103 5(R2=0.991)。经计算样品中蛋白质的含量为1.22%。
2.6 北沙参多糖中总糖含量
由标准曲线得到的回归方程为b=9.1a+0.082 4(R2=0.998)。经计算样品中总糖含量为90.40%。
2.7 红外光谱分析特征官能团
从图8可以看出,在1 021.28 cm-1处吸收峰是醇羟基的C—O伸缩振动,1 155.97 cm-1处为环上C—O的振动峰,1 638.05 cm-1附近为—OH的弯曲振动吸收峰,1 414.14 cm-1处为C—H键的弯曲振动吸收峰,2 930.43 cm-1附近为多糖的C—H伸缩振动吸收峰,3 409.19 cm-1附近为O—H的伸缩振动峰,结果表明,样品具有多糖类物质典型特征峰[15-16]。
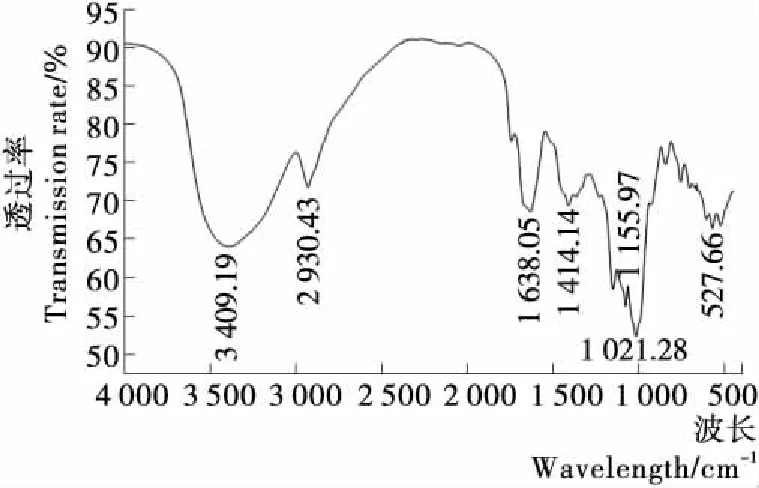
图8 北沙参多糖红外图谱
2.8 羟基自由基清除能力
由图9可知,随着样品浓度的升高,北沙参多糖对羟基自由基的清除作用也逐渐增强,呈现浓度依赖性,当浓度为4.00 mg/mL时,北沙参多糖对羟基自由基的清除率为78.9%,北沙参多糖对羟基自由基的半数清除率浓度IC50值为1.71 mg/mL,但清除效果弱于对照品VC(IC50值为0.072 mg/mL)。
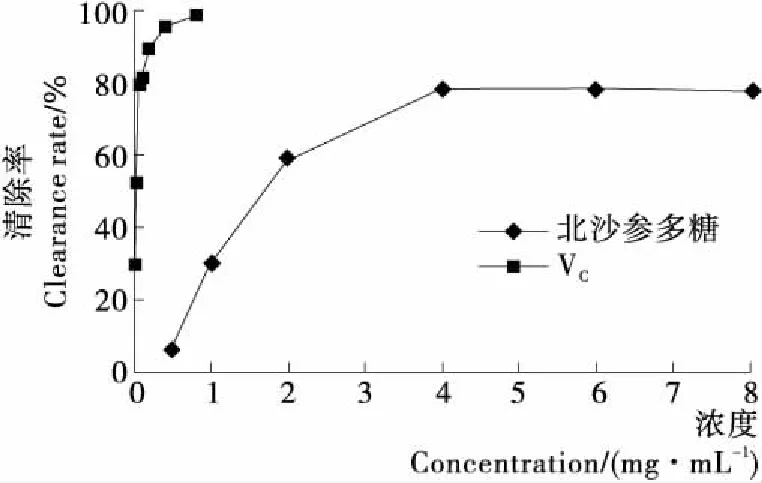
图9 北沙参多糖和VC对羟基自由基的清除作用
Figure 9 The scavenging rates on hydroxyl radical ofRadixGlehniaepolysaccharide and VC
2.9 DPPH自由基清除能力
由图10可知,随着样品浓度的升高,北沙参多糖对DPPH自由基的清除作用也逐渐增强,呈现浓度依赖性,当浓度为4.00 mg/mL时,北沙参多糖对DPPH自由基的清除率为70.2%,北沙参多糖对DPPH自由基的半数清除率浓度IC50值为1.99 mg/mL,但清除效果弱于对照品VC(IC50值为0.005 mg/mL)。

图10 北沙参多糖和VC对DPPH自由基的清除作用
Figure 10 The scavenging rates on DPPH radical ofRadixGlehniaepolysaccharide and VC
2.10 对α-葡萄糖苷酶的活性抑制
由图11可知,北沙参多糖对α-葡萄糖苷酶具有一定的抑制作用,随着浓度的升高,抑制作用也增强,整体呈线性关系。北沙参多糖对α-葡萄糖苷酶的半数抑制率浓度IC50值为5.23 mg/mL。阿卡波糖的IC50值为0.501 mg/mL,对比可得,北沙参多糖低于阳性对照阿卡波糖对α-葡萄糖苷酶的抑制作用。试验结果表明北沙参多糖具有潜在的降血糖活性。
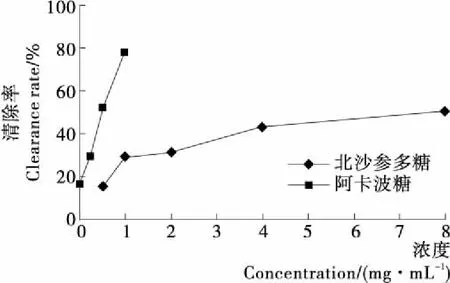
图11 北沙参多糖与阿卡波糖对α-葡萄糖苷酶的抑制作用
3 结论
本研究在单因素试验的基础上,利用响应面法对超声波辅助提取北沙参多糖工艺进行了优化,并对北沙参多糖的抗氧化活性及降血糖活性进行了测定。结果表明:北沙参多糖的最优提取工艺为提取温度65 ℃,提取时间22 min,液料比22∶1 (mL/g),在此条件下多糖提取率为12.13%。最优工艺条件下制备的北沙参多糖具有多糖的典型特征吸收峰,总糖含量为90.4%,蛋白质含量为1.22%,热降解温度为300.32 ℃。北沙参多糖具有一定的清除羟基自由基和DPPH自由基的能力和潜在的降血糖活性(对α-葡萄糖苷酶抑制率的IC50值为5.23 mg/mL)。
本试验仅在体外对北沙参多糖的活性进行了测定,并未进行体内试验,后续将对北沙参多糖的体内抗氧化及降血糖活性进行研究。

