玛咖对SD雌性大鼠体内能量代谢的影响及机理
朱玉竹朱 萍
(1. 云南农业大学附属中学,云南 昆明 650200;2. 重庆大学生物工程学院,重庆 400044)
玛咖(LepdiummeyeniiWalp, Maca) 原产于海拔3 500~4 000 m 的秘鲁安第斯山脉(AndesPeru),为十字花科(Brassicaceae)独行菜属(Lepidium)草本植物[1-2]。自2011年中国卫生部批准玛咖粉作为新食品原料以来,中国玛咖种植和加工均迎来了快速的发展。玛咖含有丰富的多糖、玛咖烯、玛咖酰胺等是药食同源作物,具有增强性功能[3],抗疲劳、抗氧化[4],减缓更年期综合症[5]等作用。已研究表明,云南产不同色型(紫、白、黄、黑),不同产地(会泽、丽江、文山等)的玛咖在营养物质及生理功能上存在差异,如:云南产玛咖生物碱含量依次为黄色(2.224 1 mg/g)、白色(2.919 3 mg/g)、紫色(4.407 8 mg/g),差异达到极显著水平(P<0.01)[6];多糖含量为紫色(7.02%)>黑色(6.93%)>绿色(6.75%)>黄色(6.53%)[7];另外,不同色型(紫、黄、白)玛咖在抗疲劳、降血脂、抗氧化、增强免疫等方面的效果也存在差异,其中紫色玛咖效果最好,白色玛咖效果较差[8]。徐梓荷[9] 49-62研究了云南产不同色型和产地玛咖对性功能效果的影响,结果表明不同产地效果大小排序为:会泽>丽江>秘鲁;不同颜色效果大小排序为:黑色玛咖>紫色玛咖>黄色玛咖。
机体功能的发挥与机体内能量代谢紧密相关,而哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)途径和腺苷酸活化的蛋白激酶(AMP activated protein kinase, AMPK)途径在细胞内共同构成一个能量合成与分解代谢的开关[10]。在营养充足的情况下,ATP的合成增加,mTOR被激活,磷酸化一系列蛋白底物,刺激细胞利用营养物质[11]。而mTOR-AMPK信号通路又受上游营养因子、生长因子和能量等刺激的影响,而玛咖对机体内能量代谢是否有影响,以何种细胞刺激信号进行,尚不清楚。本试验拟研究云南产不同色型玛咖对SD雌性大鼠机体能量代谢的影响及机理,以期为玛咖的应用与开发提供理论支撑。
1 材料与方法
1.1 材料与试剂
SD雌性大鼠:体重150~160 g,40只,动物许可证号 SCXK (渝)20120008,重庆腾鑫生物技术有限公司;
基础饲料:重庆腾鑫生物技术有限公司;
玛咖:云南省刚捷生物科技有限公司;
RNase Inhibitor(RNA酶抑制剂):美国普洛麦格公司;
胰岛素样生长因子-1(IGF-1) Elisa试剂盒、胰岛素(InS) Elisa试剂盒:上海桥杜生物科技有限公司;
肝/肌糖原测定试剂盒:南京建成生物工程研究所;
M.MLV反转录酶:美国普洛麦格公司;
荧光定量试剂/膜/板子、SYBR Green Supermix:美国Bio-Rad公司;
Trizol:美国Invitrogen公司。
1.2 仪器与设备
微量紫外分光光度:Nano Drop 2000型,美国 Thermo 公司;
冷冻离心机:3-18k型,德国Sigma公司;
荧光定量 PCR 仪:Light Cycler Nano型,美国罗氏公司;
梯度PCR仪:S1000型,美国Bio-Rad公司;
全自动生化分析仪:HITACHI-7020型,日本株式会社日立制作所;
全自动氨基酸分析仪进行:L-8800型,日本株式会社日立制作所;
酶标仪:H1MG型,美国基因有限公司。
1.3 方法
1.3.1 试验样品的制备与剂量确定 将玛咖切片后于50 ℃烘干至恒重,经中药粉碎机粉碎后过150 目筛。取玛咖干粉6 g溶于1%羧甲基纤维素钠溶液并定容至50 mL,即得0.12 g/mL 样品悬浮液,4 ℃保存备用[9]51[12]。
玛咖成人每日推荐摄入量为25 g,中国人均体重60 kg[13],即成人每日用玛咖剂量为0.42 g/kg·BW[12,14]。
1.3.2 动物分组和饲养 将40只SD雌性大鼠按体重随机分为空白对照、黑玛咖、紫玛咖、黄玛咖、白玛咖组,每组8只。每只大鼠独立饲养于不锈钢笼(25 cm×15 cm×15 cm)里,动物房温度控制在(25±1) ℃,相对湿度55%,昼夜循环周期12 h,试验组每日灌胃0.42 g/kg·BW的1%羧甲基纤维素钠玛咖干粉(150目)悬浮液,空白组灌胃等体积1%羧甲基纤维素钠溶液,饲养期间自由采食基础饲料和饮水,每天记录大鼠采食量,每3 d称重1次,同时调整灌胃量,喂养28 d,禁食12 h后称重[12]。用乙醚麻醉后,断头,用含有肝素钠的采血管采血,4 000 r/min、4 ℃离心15 min后,-80 ℃ 冻存,备用。采完血后,快速将大鼠解剖,用4 ℃生理盐水清洗肝脏、骨骼肌、肾脏等组织表面血水,用吸水纸擦干,称总重;称取肝脏组织约100 mg,置于2 mL无RNA酶的微型离心管中,液氮速冻后,-80 ℃冻存,备用。
1.3.3 腹脂率和相对组织重的测定 参考文献[15],按式(1)、(2)计算腹脂率和相对组织质量。
(1)
(2)
式中:
c1——腹脂率,%;
c2——相对组织质量,%;
m1——附睾周围脂肪质量,g;
m2——肾脏周围脂肪质量,g;
m3——组织质量,g;
m——活体质量,g。
1.3.4 生理生化指标分析 采用尾部静脉采血,血糖仪测定其空腹血糖;肝/肌糖原采用蒽酮比色法测定,具体操作按试剂盒操作说明书进行;胰岛素和胰岛素样生长因子-1 (IGF-1)采用酶联免疫法测定,操作方法按试剂盒说明书进行;血清及组织中氨酸含量采用全自动氨基酸分析仪测定。
1.3.5 肝脏中关键基因qRT-PCR分析 根据文献[15]修改如下,利用Qiagen试剂盒提取和反转录获得cDNA后,RNA浓度和纯度(OD260 nm/OD280 nm)采用紫外分光光度计进行测定;实时定量PCR测定各组织mRNA含量;内参基因为β-肌动蛋白(ACTB),qRT-PCR引物序列见表1。qRT-PCR在实时定量PCR仪上进行分析。10 μL的qRT-PCR反应体系包含:4.2 μL SYBR Green Supermix,4.2 μL DEPC水,100 ng/μL cDNA模板1.0 μL,20 μmol/L上、下游引物各0.3 μL。qRT-PCR反应条件:95 ℃预变性30 s;40次循环包含95 ℃ 5 s,60 ℃ 30 s;65 ℃ 5 s;95 ℃ 5 s。每个样品均设置3次重复。
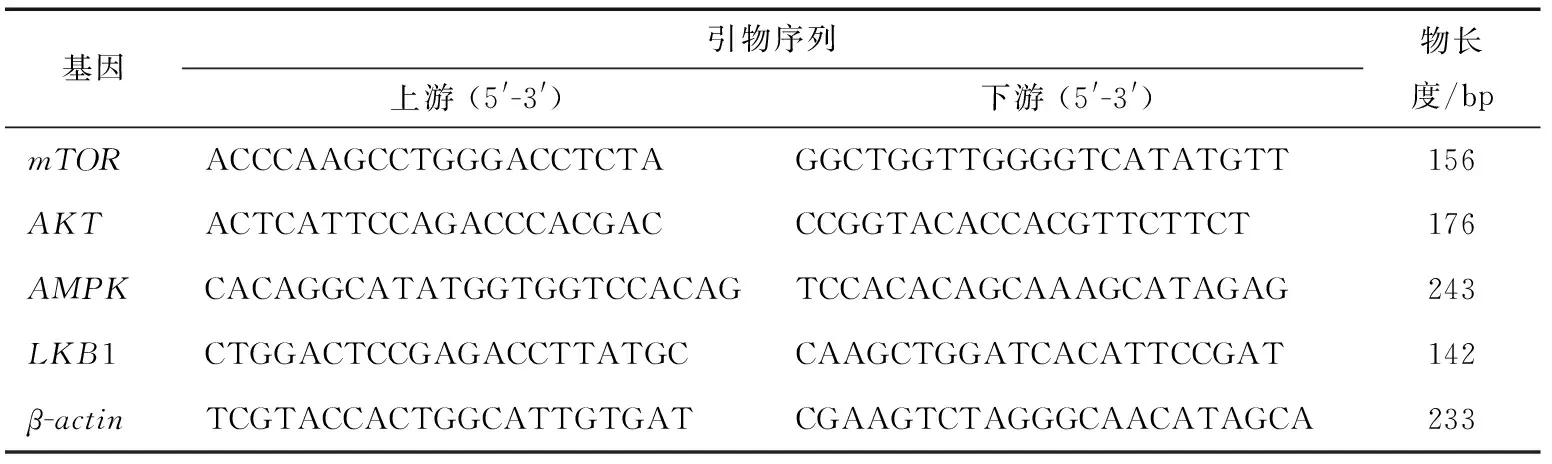
表1 各基因引物序列及产物长度
1.4 统计分析
试验结果以mean±SD表示,各组间比较采用单因素方差分析,用Duncan法分析显著性,P<0.05被认为有显著差异,各组间差异显著性采用SPSS 21.0软件分析,Origin 9作图。
2 结果与分析
2.1 玛咖对试验大鼠生长的影响
由表2可知,与空白对照组相比,试验组大鼠体重均有增加趋势,其中黑玛咖、紫玛咖和黄玛咖对试验大鼠体重的增加量影响显著(P<0.05);试验组大鼠相对骨骼肌均有增加趋势,其中黑玛咖和紫玛咖效果显著(P<0.05),而对肝脏和肾脏相对重量的影响不显著(P>0.05);各试验组均有降低腹脂率的趋势,提示玛咖可能通过调节能量分配来改变试验大鼠胴体的组成。
2.2 玛咖对试验大鼠生理生化指标的影响
玛咖对试验大鼠血糖和糖原含量的影响见表3。血糖和糖原水平在一定程度上反映了机体能量代谢的状态[16]。在动物体内,机体各组织细胞的活动及功能的发挥所需能量主要来源于血糖,而糖原是机体内糖的储存形式,在机体血糖降低时,肝糖原可迅速分解,以维持机体血糖水平的稳定[17]。试验结果表明,玛咖对试验大鼠血糖的影响不显著,但可增加肝糖原含量的趋势,其中黑玛咖、紫玛咖增加量显著(P<0.05),可能与玛咖中含有大量的多肽有关。现有研究[18-20]表明,玛咖多肽可促进小鼠肝内糖质新生,从而提高其肝糖原的储备。而体内糖原的储备水平,可直接影响机体的抗疲劳和运动能力[21-22]。Ins和IGF-1在机体肝脏、肌肉及脂肪组织中对糖、脂肪、蛋白质等营养物质的代谢和贮存起作关键作用[23]。灌胃玛咖后各试验组大鼠血清中Ins和IGF-1的含量变化均不显著(P>0.05)。可知,Ins/IGF-1并非灌胃玛咖促进机体能量代谢的主要信号因子。
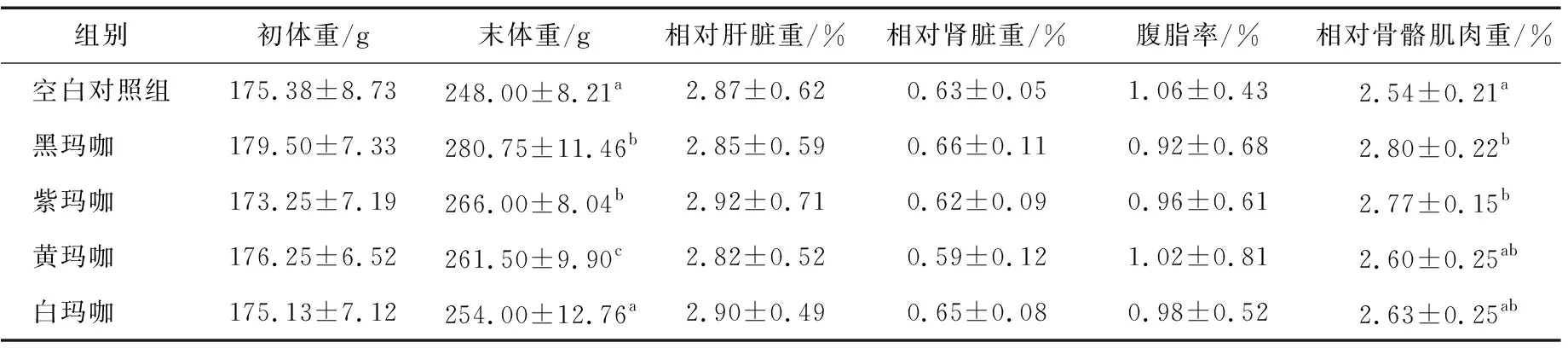
表2 玛咖对试验大鼠生长的影响†
† 同列a,b,c表示各组之间存在显著差异(P<0.05)。
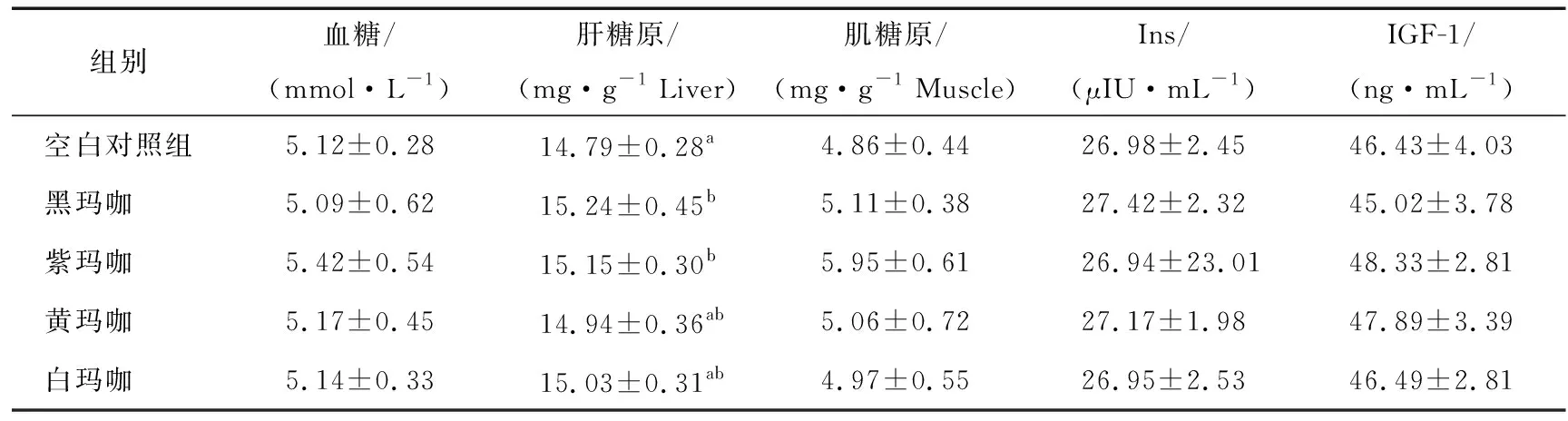
表3 玛咖对试验验大鼠血糖和糖原含量的影响†
† 同列a,b,c表示各组间存在显著差异(P<0.05)。
2.3 玛咖对试验大鼠血清和肝脏中氨基酸含量的影响
玛咖对试验大鼠血清和肝脏中氨基酸含量的影响见表4、5。生糖氨基酸可在机体内能够转化为葡萄糖,并供能。与空白对照组比,黑玛咖和紫玛咖可显著(P<0.05)血清中Asn、Arg和Ser的含量。另外,各试验组均有增加血清中Gln 的趋势,但不显著(P>0.05)。玛咖可增加试验大鼠肝脏中Asp、Ser、Thr和Ala的含量,其中黑玛咖和紫玛咖可显著(P<0.05)增加试验大鼠肝脏中Asp、Ser、Thr和Ala的含量;对其它各种检测到的氨基酸含量影响不显著(P>0.05)。黑玛咖和紫玛咖增加试验大鼠血清和骨骼肌中生糖氨基酸,多为非必需氨基酸。在机体内,非必需氨基酸可由体机相应的α-酮酸自身合成或者蛋白质的分解产生。
当机体能量充足时,氨基酸通常很少或不参与供能,而作为蛋白质合成原料,增加机体蛋白质合成[24],这与黑玛咖和紫玛咖可提高大鼠骨骼肌相对重量的结果相吻合。支链氨基酸(Branched-chain amino acid, BCAA)包括Leu、Ile 和Val。现有研究[25]表明,支链氨基酸不但是必需氨基酸,也是功能性氨基酸。本试验结果表明,各试验组玛咖均可有上调试验大鼠血清和骨骼肌中Leu和Val的含量。而亮氨酸可刺激mTOR信号通路[26],从而启动mTORC1 ser2448磷酸化[27]。
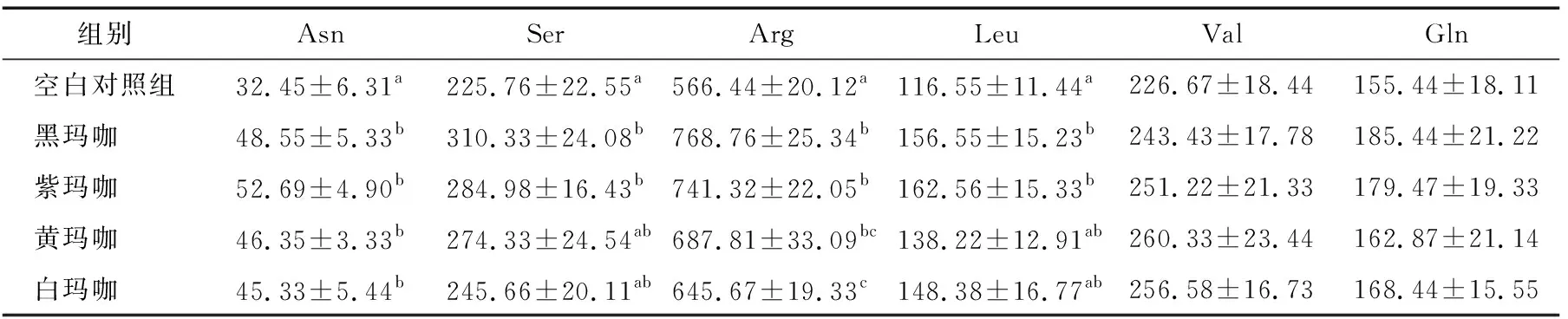
表4 玛咖对试验大鼠血清中氨基酸含量的影响†
† 同列a,b,c表示各组间存在显著差异(P<0.05)。

表5 玛咖对试验大鼠肝脏中氨基酸含量的影响†
† 同列a,b,c表示各组间存在显著差异(P<0.05)。
2.4 玛咖对试验大鼠肝脏组织中能量代谢关键基因mRNA表达量的影响
玛咖对试验大鼠肝脏组织中能量代谢关键基因mRNA的影响见图1。能量代谢平衡调控是由多个与之相关的信号通路所介导,其中AMPK信号通路和mTOR信号通路在细胞内共同构成一个合成代谢和分解代谢过程的开关。当机体[AMP]/[ATP]比值升高,可激活 LKB1,通过激活AMPK-TSC2,抑制mTOR活性。本试验结果表明,各试验组均显著 (P<0.05)上调试验大鼠肝脏mTORmRNA表达量;有上调AKTmRNA表达量的趋势,其中黑玛咖和紫玛咖上调显著(P<0.05)。而对AMPK、LKB1 mRNA表达量的影响不显著(P>0.05)。氨基酸和葡萄糖等能量底物通过三羧酸循环改变细胞内AMP和ATP的比例,能量水平降低时,v-ATPase-Ragulator接近LKB1 从而激活AMPK;能量水平较高时,mTORC1与之结合并被激活,开启合成代谢通路。同时,AMPK 是mTOR通路上游主要的激酶,被激活后能磷酸化TSC2蛋白,下调Rheb-GTP,从而抑制mTORC1活性;也可磷酸化接头蛋白Raptor从而阻碍Raptor与mTOR的结合[28]。另外,BCAA还可激活PI3K,进而磷酸化AKT(ser437),激活mTORC1[29-30],也可直接作用于mTOR,使mTOR活化[31-32]。综合以上结果表明,支链氨基酸是灌胃不同色型玛咖激活mTOR的信号因子。
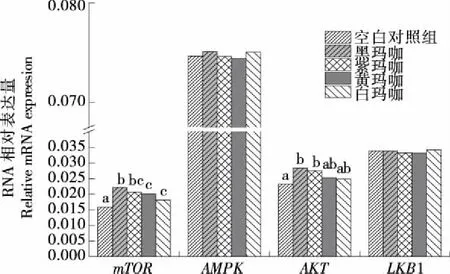
图1 玛咖对试验大鼠肝脏组织中能量代谢关键基因mRNA 相对表达量的影响
Figure 1 Effects of Maca on mRNA levels of key genes of energy metabolism in the liver of rats (n=8)
3 结论
食用玛咖可通过调节能量分配来改变机体的组成,其机理可能是通过BACC作用于mTOR,使mTOR活化;可能存在以下信号通路:① BACC激活PI3K后使AKT(ser 437) 磷酸化,激活 mTORC1;② BACC直接作用于mTOR;③ 以上2种情况并存。其中黑玛咖和紫玛咖对机体能量代谢的影响效果显著(P<0.05)高于黄玛咖和白玛咖。
本试验仅从mRNA水平进行了探索,下一步将从蛋白质水平、细胞水平、肠道健康、玛咖粉碎粒度,及食用时间对机体能量代谢的影响及机理进行深入研究。

