竹豆清蛋白提取工艺优化及亚基组成分析
姚海霞王 娟王立梅齐 斌
(1. 常熟理工学院生物与食品工程学院,江苏 常熟 215500;2. 吉林农业大学食品科学与工程学院,吉林 长春 130118)
竹豆(bamboo bean)为豇豆属,又称饭豆、爬豆等。其资源丰富、种植地广,目前全国各地,云南、吉林、山西、贵州等均有种植。竹豆营养丰富,其富含淀粉、蛋白质、钙、磷、铁及粗纤维、类胡萝卜素、VB1、VB2、VC等[1-2]。与绿豆、小豆相比,竹豆具有抗虫害、产量高、适应力强等优势[3],适合在高温干旱或土壤贫瘠地区种植。然而,它却只被当作饲料和绿肥,其种子资源未被有效开发和利用。
目前,国内外对竹豆的农艺性状[4]、栽培措施[5]、种质资源多样性[6]等均有报道,但关于竹豆清蛋白的研究报道几乎没有。植物清蛋白的研究大多集中在芸豆[7]、绿豆[8]11-48、米糠[9]、菜籽粕[10]等农作物,研究表明植物清蛋白具有较好的起泡性及乳化性,可部分替代动物鸡蛋蛋白,在食品应用上具有较大潜力,可应用于蛋糕、面包、冰淇淋或者饼干等食品[11-12],具有来源广、成本低的优势。国内外研究发现蛋白亚基对功能性质具有重要作用[13-14],在凝胶性和乳化性方面的研究已较为广泛[15-16]。本试验拟以竹豆为原材料,采用Osborne分级法[17]提取清蛋白,通过响应面试验优化提取工艺,进一步分析其亚基组成,以期为研究竹豆清蛋白的理化性质及功能性质提供依据。
1 材料与方法
1.1 主要材料与试剂
竹豆:购于云南昆明兰姐特产店;
乙醇、硼酸、盐酸、氢氧化钠、氯化钠:分析纯,江苏强盛功能化学股份有限公司;
甲基红、亚甲基蓝、溴甲酚绿:分析纯,国药集团化学试剂有限公司;
Tris[三(羟甲基)胺基甲烷]、SDS(十二烷基硫酸钠)、Glycine(甘氨酸):分析纯,美国Sigma公司。
1.2 仪器与设备
磁力加热搅拌器:RCT basic型,苏州赛恩斯仪器有限公司;
高速冷冻离心机:CR22GⅡ型,日本Hitachi公司;
冷冻干燥机:freezone 6 型,美国Labeonco公司;
pH计:FE20型,梅特勒-托利多国际贸易(上海)有限公司;
电子天平:MP10001型,上海舜宇恒平科学仪器有限公司;
超纯水仪:Milli-Q advantage型,美国Millipore公司;
电泳仪:Mini-PROTEAN Tetra型,美国Bio-Rad公司;
凝胶成像系统:BIO-RAD型,美国Bio-Rad公司。
1.3 方法
1.3.1 竹豆基本成分的测定 竹豆水分、灰分、蛋白、脂肪、淀粉的测定分别按照《食品安全国家标准》中直接干燥法(GB 5009.3—2016)、质量法(GB 5009.4—2016)、凯氏定氮法(GB 5009.5—2016)、索氏提取法(GB 5009.6—2016)和酸水解法(GB 5009.9—2016)进行测定。
1.3.2 竹豆清蛋白制备工艺流程
竹豆→粉碎机粉碎→过筛(60目)→石油醚室温脱脂[料液比为1∶3 (g/mL)]48 h→自然风干→脱脂竹豆→蒸馏水提取→离心(10 000 r/min,4 ℃,15 min)→取上清→调pH至4.0→离心(10 000r/min,4 ℃,15 min)→取沉淀→水洗→调至pH至7.0→冷冻干燥48 h→竹豆清蛋白
1.3.3 竹豆清蛋白等电点的测定 配置1 mg/mL竹豆清蛋白溶液,分别将pH调至3.0~5.6,每0.2一个梯度,静置1 h后离心取上清,采用考马斯亮蓝法测定蛋白含量,分别计算其溶解度,溶解度最低的pH即为等电点。
1.3.4 单因素试验提取
(1) 搅拌速率:固定料液比1∶8 (g/mL)、提取温度45 ℃、提取时间1 h,设置搅拌速率为200,400,600,800,1 000 r/min,考察搅拌速率对竹豆清蛋白提取率的影响。
(2) 搅拌温度:固定料液比1∶8 (g/mL)、搅拌速率600 r/min、提取时间1 h,设置提取温度为35,40,45,50,55 ℃,考察搅拌温度对竹豆清蛋白提取率的影响。
(3) 搅拌时间:固定料液比1∶8 (g/mL)、提取温度45 ℃、搅拌速率600 r/min,设置提取时间为0.5,1.0,1.5,2.0,2.5,3.0 h,考察搅拌时间对竹豆清蛋白提取率的影响。
(4) 料液比:固定提取温度45 ℃、搅拌速率600 r/min、提取时间1 h,设置料液比为1∶6,1∶8,1∶10,1∶12,1∶14(g/mL),考察料液比对竹豆清蛋白提取率的影响。
1.3.5 响应曲面试验优化工艺 根据单因素试验结果,本试验选取了搅拌速率、搅拌温度、搅拌时间、料液比4个因素作为工艺参数,以竹豆清蛋白的提取率为参考指标。根据Box-Behnken的原理进行试验设计,建立相关模型,确定最优提取工艺。
1.3.6 竹豆清蛋白提取率的计算
(1)
式中:
E——提取率,%;
m——竹豆清蛋白质量,g;
M——竹豆干豆的质量,g;
w——竹豆干豆中总蛋白质量分数,%(前期测得为20.5%)。
1.3.7 竹豆清蛋白的亚基组成 精确称取竹豆清蛋白1 g (精确至0.001 g)至100 mL蒸馏水中,超声提取15 min,离心(4 000 r/min, 4 ℃, 15 min)取上清,作为待测液。取100 μL 样液,加20 μL 5×Sample Loading Buffer[组分:250 mmol/L Tris-HCl (pH 6.8); 0.5% Bromophenol Blue; 10% SDS;50% Glycerol; 7.5% DTT],100 ℃煮沸5 min,取10 μL上样。分别制备5%浓缩胶和12%分离胶,对其进行不连续垂直电泳,设置浓缩胶电压70 V 分离胶110 V ,至溴酚蓝跑至分离胶底部1 cm处结束。采用考马斯亮蓝G-250染色,充分脱色后拍照保存。
2 结果与分析
2.1 竹豆基本成分
竹豆基本成分见表1。

表1 竹豆基本成分含量
2.2 竹豆清蛋白等电点
由图1可知,竹豆清蛋白在pH 3.5~4.5时有较低的溶解度,在pH 4.0时最低,该处即为其等电点。研究[18]表明大多数蛋白质在等电点处起泡性最差,但起泡稳定性较好;刘永创等[19]发现等电点处的大豆分离蛋白比中性条件下制备的乳液具有更高的乳化稳定性及储藏稳定性。因此,蛋白质的等电点对其功能性质的研究具有重要意义。
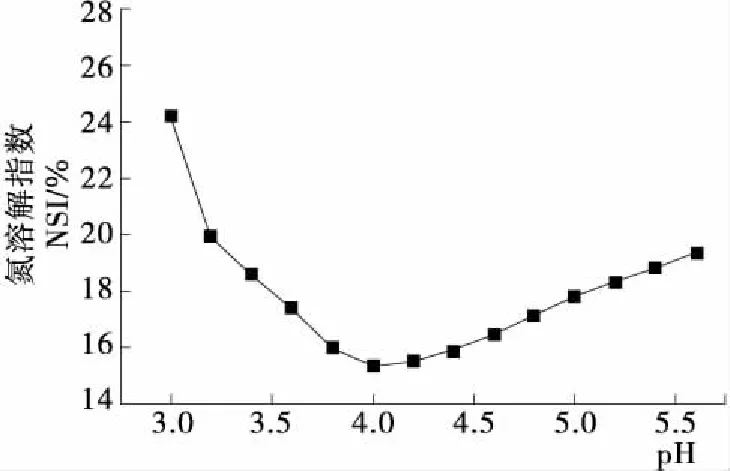
图1 竹豆清蛋白的等电点测定
2.3 单因素试验
2.3.1 搅拌速率对竹豆清蛋白的影响 由图2可知,竹豆清蛋白提取率随搅拌速率先上升后下降,最后趋于平稳,当搅拌速率为400 r/min时,提取率达到最高。在一定范围内,增加搅拌速度可以促进蛋白与水分子的接触,促进溶解,但达到一定限度后,过高的搅拌速率产生的剪切力可能导致蛋白变性,破坏其原有结构[20]144-153,使溶解度降低,提取率降低。
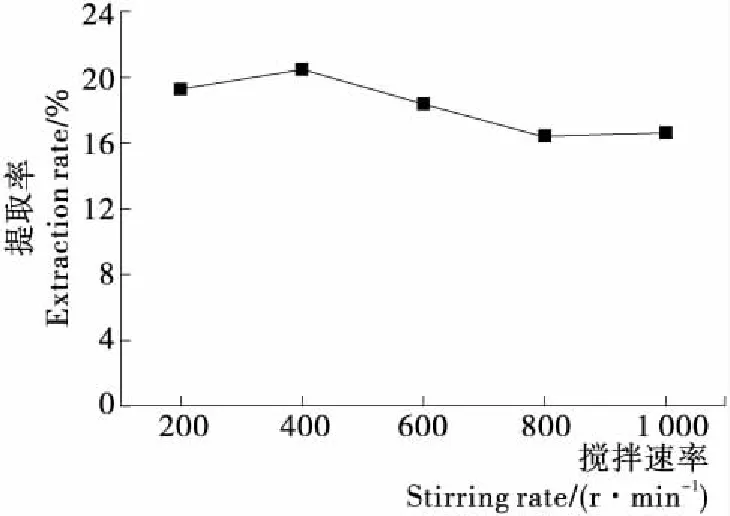
图2 搅拌速率对竹豆清蛋白提取率的影响
2.3.2 搅拌温度对竹豆清蛋白提取率的影响 由图3可知,在35~45 ℃时竹豆清蛋白提取率随温度升高而逐渐增大,在50 ℃时下降较为缓慢,而在55 ℃时急速下降。这是因为在35~45 ℃时,竹豆清蛋白的水合能力随着温度的升高而增强,而随着温度的进一步升高,氢键作用和离子基团的水合作用减弱,蛋白质水合能力下降[20]130-131,提取率随之下降。而在55 ℃时,下降极为显著,可能是此时温度过高,蛋白质的高级结构遭到破坏,导致变性聚集。
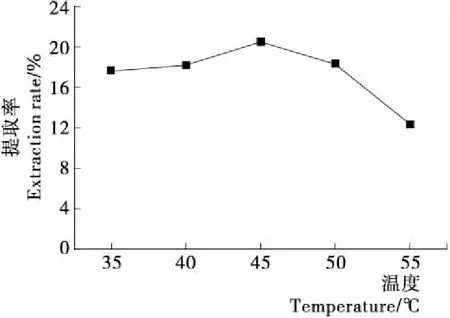
图3 搅拌温度对竹豆清蛋白提取率的影响
Figure 3 Effect of stirring temperature on the extraction rate of bamboo bean albumin
2.3.3 搅拌时间对竹豆清蛋白提取率的影响 由图4可知,竹豆清蛋白提取率在搅拌时间为1.5 h达到最大。当搅拌时间为0.5~1.5 h时,竹豆清蛋白充分展开,同水稳定结合,逐步接近饱和,提取率上升;而在1.5 h后,清蛋白与水分子结合达到饱和,增加搅拌时间只会破坏维持蛋白质结构作用力的平衡,部分基团的水化层被破坏,使原来结合好的蛋白质分子又脱离水分子,提取率下降。
2.3.4 料液比对竹豆清蛋白提取率的影响 由图5可知,竹豆清蛋白提取率随提取溶剂体积量增大而先增后降,且增减幅度较大,在料液比为1∶12 (g/mL)时达到最大。当溶剂较少时,竹豆清蛋白随着溶剂的增加充分浸出,同水结合越充分,提取率增大,在料液比为1∶12 (g/mL)时,同水结合力达到最大;而溶液较多时,竹豆清蛋白过度肿胀,与水结合力减弱,提取率下降。
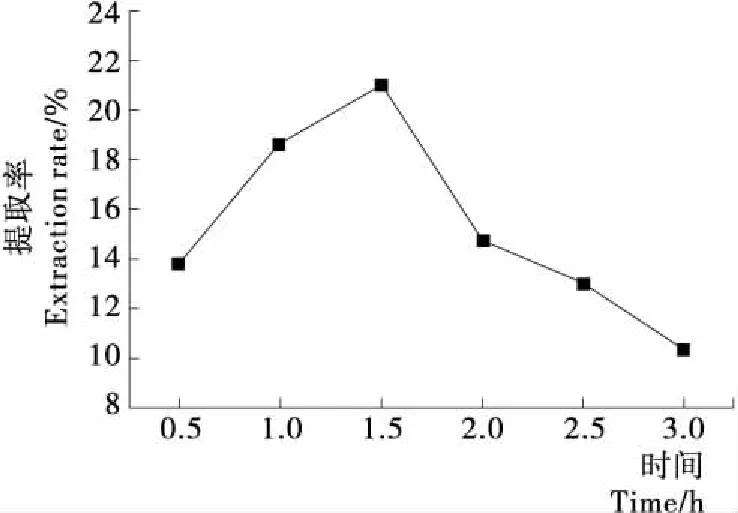
图4 搅拌时间对竹豆清蛋白提取率的影响
Figure 4 Effect of stirring time on the extraction rate of bamboo bean albumin
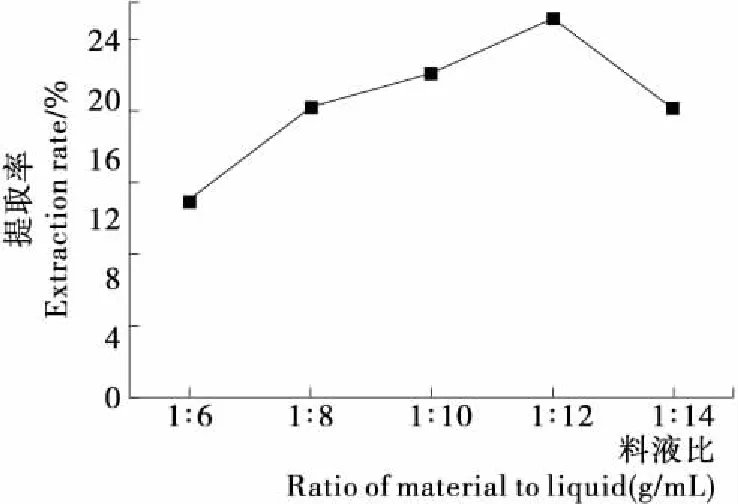
图5 料液比对竹豆清蛋白提取率的影响
Figure 5 Effect of ratio of material to liquid on the extraction rate of bamboo bean albumin
2.4 响应面试验
2.4.1 响应面试验设计与结果 响应面因素与水平的试验设计及相应试验结果见表2、3。
2.4.2 模型的建立与分析 采用Design-Expert 8.05b软件对表3数据进行拟合,得回归方程:
Y=26.55-0.022A-0.26B+1.54C-2.75D+0.56AB-0.58AC+0.96AD-0.32BC+0.19BD+0.21CD-1.36A2-1.32B2-5.19C2-3.73D2。
(2)
其中,校正系数R2=0.993 4,变异系数CV=1.88%,说明该模型拟合度较好,可对竹豆清蛋白的提取工艺进行分析和预测,能较好地反映真实值。
响应面数据的方差分析结果见表4,结果显示模型P<0.000 1,表明回归模型极显著。失拟误差P=0.092>0.05,表明所用模型与试验拟合误差不显著,未知因素对试验干扰少,数据较准确[21]。由表4可知,单因素对竹豆清蛋白提取率影响顺序依次为:D>C>B>A;因素之间交互作用大小依次为:AD>AC>AB>BC>CD>BD;各因素的二次方对提取率影响大小为: C2>D2>A2>B2。
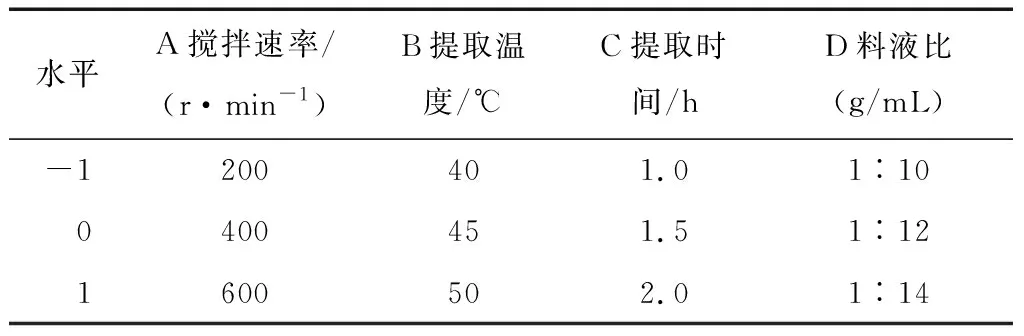
表2 响应面因素与水平的试验设计
2.4.3 响应曲面三维图和等高线分析 竹豆清蛋白提取的等高线图与响应面3D图见图6~8。由图6可知,响应曲面较陡峭,等高线形状为宽椭圆,表明搅拌速率和温度对竹豆清蛋白提取率具有较显著影响;由图7可知,响应曲面陡峭,等高线形状为较细椭圆,表明搅拌速率和时间交互作用显著,且时间对提取率的影响大于搅拌速率;由图8可知,响应曲面比之前更加陡峭,椭圆形状更细长,表明搅拌速率和料液比之间的交互作用更加显著,这也与方差分析结果相一致,表明了模型的可靠性与真实性。
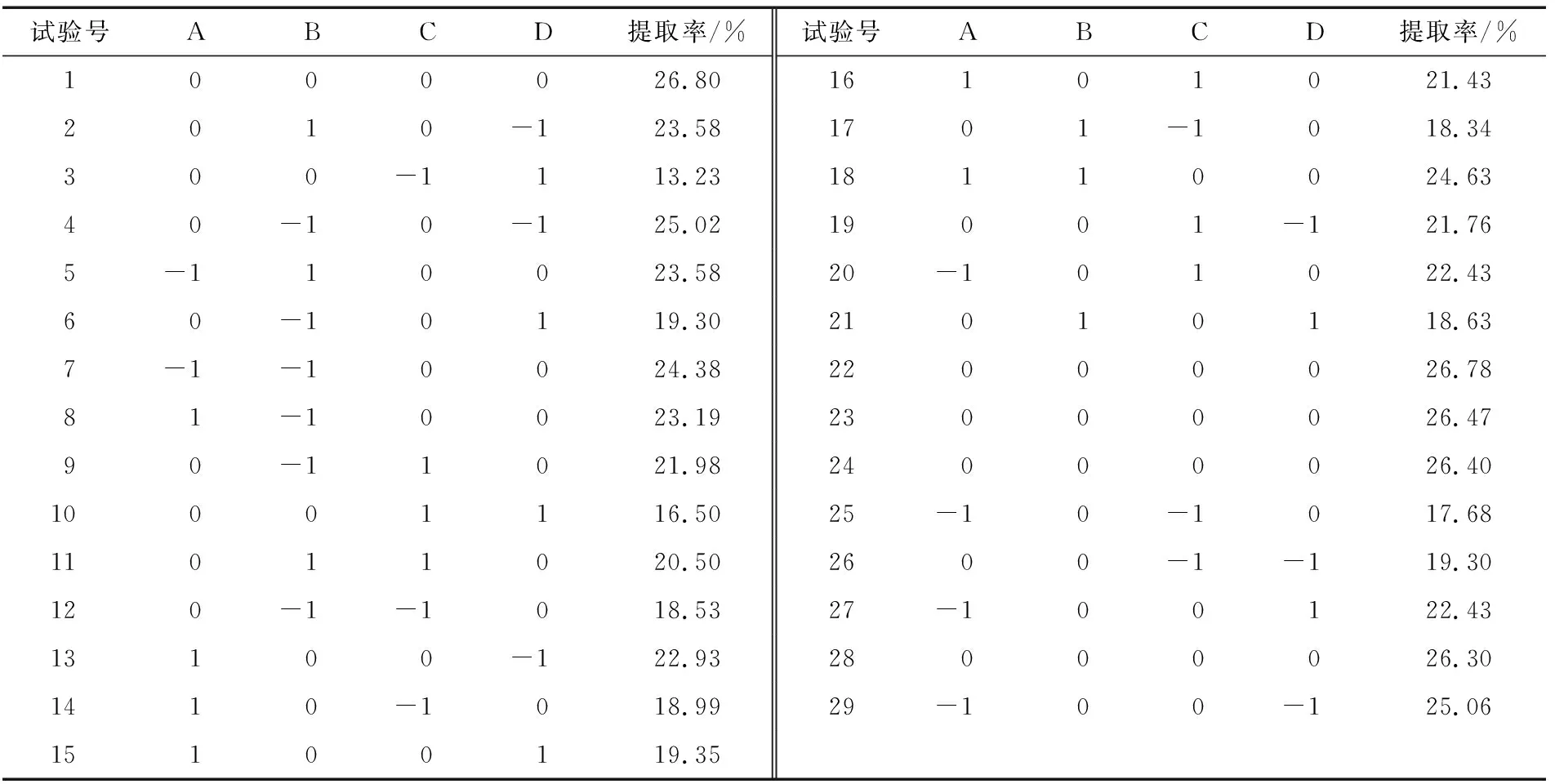
表3 响应面试验结果
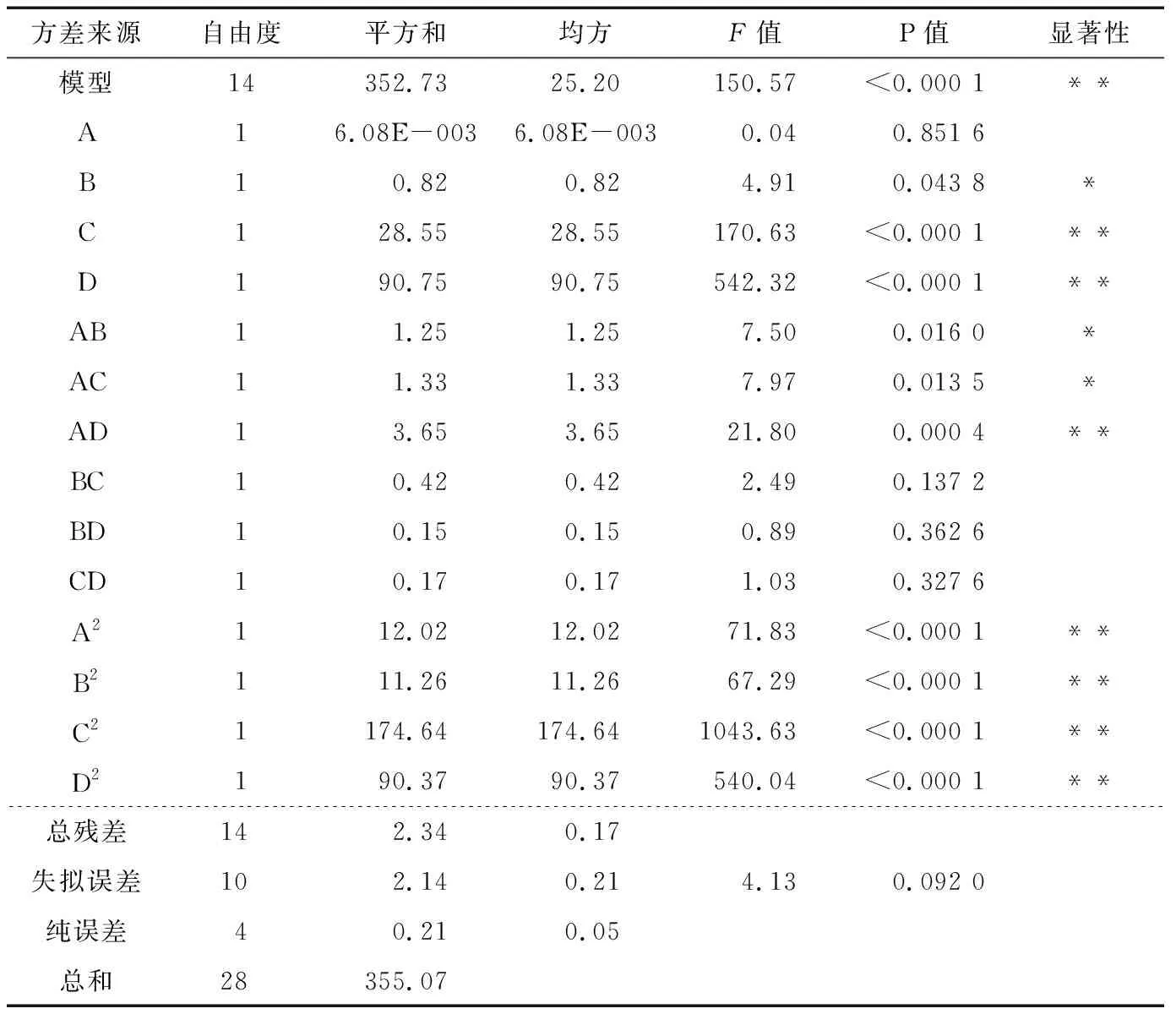
表4 方差分析表†
† *差异显著,P<0.05;** 差异极显著,P<0.01。
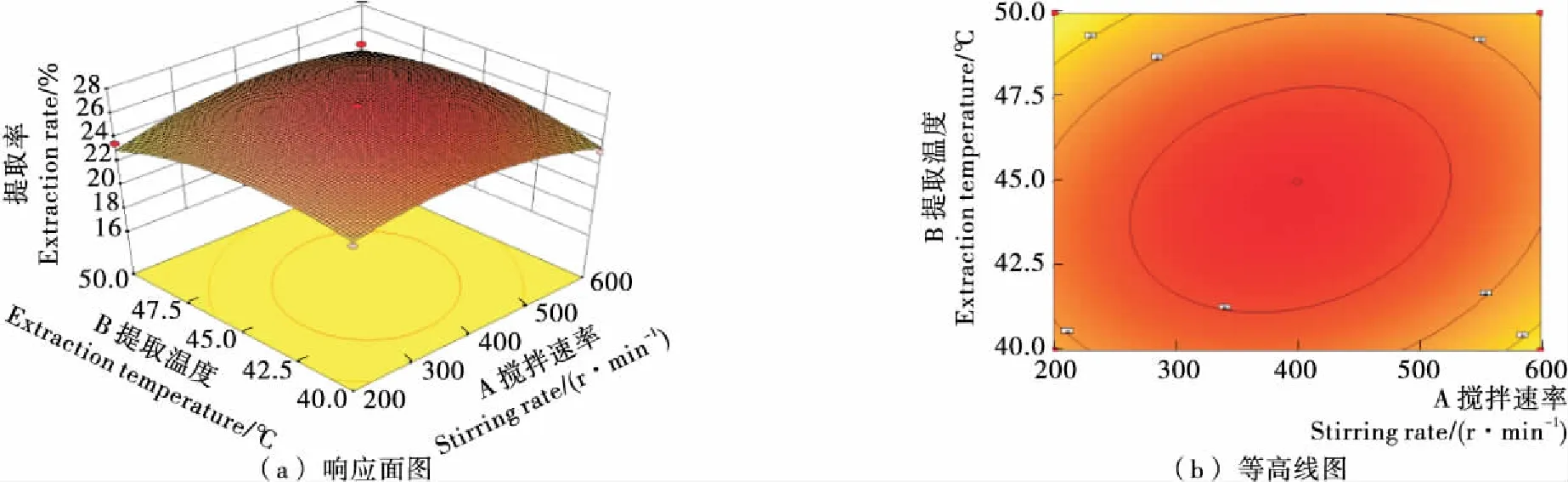
图6 搅拌速率和温度对竹豆清蛋白提取率的响应面与等高线图
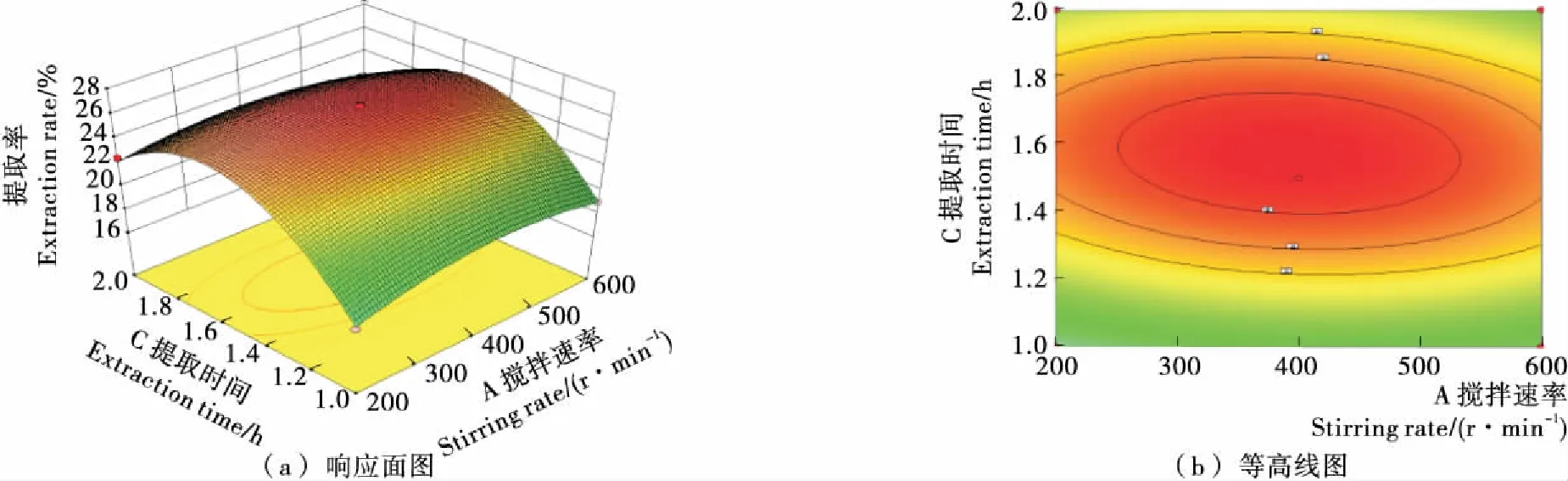
图7 搅拌速率和时间对竹豆清蛋白提取率的响应面与等高线图
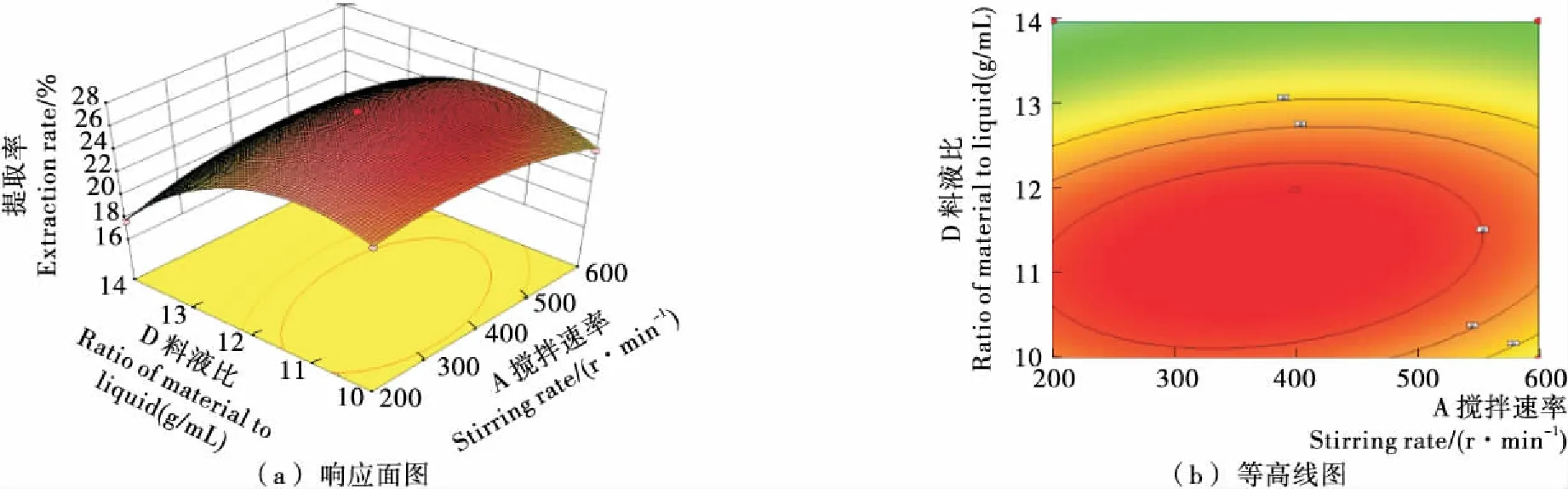
图8 搅拌速率和料液比对竹豆清蛋白提取率的响应面与等高线图
2.5 最佳工艺参数确定与模型验证
通过响应面模型可知,提取竹豆清蛋白的最佳工艺为:搅拌速率355.83 r/min、提取温度44.02 ℃、提取时间1.58 h、料液比1∶11.20 (g/mL),提取率的预测值为27.25%。为实际操作方便,将最佳参数调整为:搅拌速率356 r/min、提取温度44 ℃、提取时间1.5 h、料液比1∶11.20 (g/mL),此条件下提取率为27.56%(n=3),与预测值相差1.14%,说明该模型用于提取竹豆清蛋白是可靠的。最优条件下,竹豆清蛋白纯度为(86.50±2.17)% (n=3),与其他豆类蛋白[22]比较,纯度相差不大,可用于后续功能性质的研究。
2.6 竹豆清蛋白的亚基组成
竹豆清蛋白的SDS-PAGE电泳如图9所示,通过Image Lab软件,将蛋白质Marker的分子量对数(y)与条带相对迁移率(x)作标准曲线方程:y=-2.4x+2.88,R2=0.983 3。将竹豆清蛋白条带相对迁移率带入标准曲线方程,计算其主要亚基分子量。竹豆清蛋白含有9个亚基条带,分别为
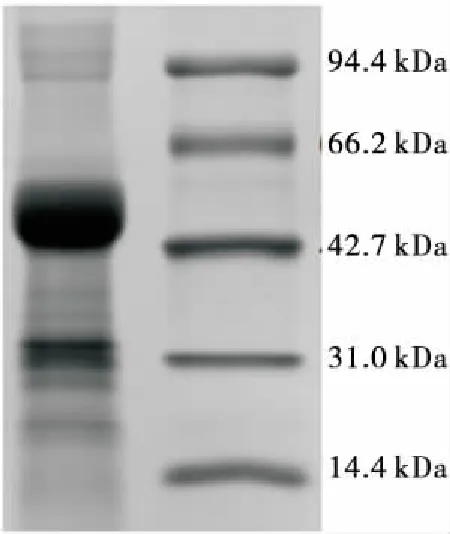
图9 竹豆清蛋白的SDS-PAGE还原电泳
1.3.3,103.5,94.6,49.6,35.3,32.3,27.6,24.0,19.7 kDa。其中最主要亚基分布在49.6,27.6 kDa,分别占总量的61.1%,20.6%,与李永武[8]42-45提取的绿豆清蛋白亚基分子量分布相似。
3 结论
通过响应面试验确定竹豆清蛋白的最佳提取工艺为:搅拌速率356 r/min、提取温度44 ℃、提取时间1.5 h、料液比1∶11.20 (g/mL),在此条件下提取率为27.56%,纯度为(86.50±2.17)%。SDS-PAGE电泳分析表明,竹豆清蛋白含有9个亚基条带,其中最主要亚基分布在49.6,27.6 kDa。
目前,关于竹豆清蛋白提取工艺报道几乎没有,通过优化其提取工艺,有助于获得更高产量的竹豆清蛋白;通过SDS-PAGE电泳进一步分析亚基组成,为进一步研究其功能性质及结构特征提供理论依据,有助于竹豆清蛋白在食品领域的加工及应用。

