多粘类芽孢杆菌XZ-2的生物学特性及其对3种大豆病原菌的拮抗作用研究
王 波,周涧楠,黄忠勤,王 幸,丁震乾,常 勇,苏在兴,周兴根
(江苏徐淮地区徐州农业科学研究所,江苏 徐州 221131)
【研究意义】采用植物内生菌防治植物病虫害已有较多的研究和报道。由于植物内生菌从植物体内分离得到,它们与宿主植物有密切的互惠共生关系,具有定殖能力强以及增殖和扩散迅速等优点,且不易受外界环境的影响,可以较长时间地发挥作用[1-2],弥补了化学防治带来的环境污染和抗药性产生等问题,因此,采用植物内生菌防控植物病害具有很好的科研和推广应用价值。【前人研究进展】大豆疫霉病(Phytophthora Root Rot)也叫大豆疫霉根腐病,广泛分布于世界各大豆主产区,是一种危害极其严重的土传性病害,病株率可达15 %以上,严重地块发病率甚至高达75 %,严重影响了大豆的产量和品质[3]。其病原菌Phytophthorasojae可侵染豆荚和根茎叶等组织,引起种子腐烂和幼苗倒伏、植株矮化甚至导致全株枯萎死亡[4]。目前对大豆疫霉病的研究主要集中在抗病品种选育和栽培措施改良以及化学防治方面,但是由于大豆疫霉病菌具有很高的小种变异性,单一抗性品种的有效期短,对大豆疫霉病不能达到较好的防效;栽培措施的改良并不能完全控制该病害的发生和为害;化学防治对部分生理小种有效,但不是对所有生理小种都能有效,并且化学防治存在农药残留、环境污染以及作物抗药性产生等问题,不利于农业的可持续发展。生物农药以其对环境友好对人畜安全等特点,在卵菌病害防控中已显示出独特优势,刘海龙等[5]从大豆根内和根际土壤中分离和筛选到部分生防细菌对大豆根腐病有较好的防效,且对大豆种子发芽没有抑制作用;温广月等[6]采用生防细菌防控该病害并发现其对大豆具有促生作用;郭荣君等[7]报道芽孢杆菌BH1对该病害的温室防效可达56.1 %,采用生防菌株进行大豆疫霉病生物防治已经显示出了较好的应用前景。大豆炭疽病(Soybean anthracnose)是大豆重要病害之一,我国各大豆产区均有发生。苗期可引起死苗,成株期可危害豆秆、豆荚,导致大豆产量和品质降低。选育和利用抗病品种是目前防治该病最经济有效的措施,但抗性品种连续种植几年以后其抗性便慢慢丧失,最终导致病害暴发流行。王国荣等人研究发现始花期与盛花期连续施用甲基托布津对大豆炭疽病的防治效果可超过95 %[8],但是,长期使用甲基托布津容易产生抗药性。目前,国内鲜有大豆炭疽病生物防治的相关报道,更未见多粘类芽孢杆菌用于防治大豆炭疽病的研究报道。大豆菌核病(Stem rot of soybean)由子囊菌亚门真菌(Sclerotiniasclerotiorum(Lib.) de Bary)引起,该病在我国各大豆产区均有发生,在流行年份发病率可达60 %~100 %[9-11],严重影响了大豆的品质,是我国大豆生产的重要病害之一,菌核病的发病部位主要在根茎部,一旦发病化学药剂的防治效果很不理想。【本研究切入点】XZ-2是江苏徐淮地区徐州农业科学研究所油料研究课题组从健康大豆植株中分离到的一株内生多粘类芽孢杆菌,已有的研究表明XZ-2对大蒜叶枯病菌等8种植物病原真菌具有较强的抑菌活性[12],本文拟进一步研究XZ-2的生物学特性和对3种大豆主要病害的室内拮抗作用。【拟解决的关键问题】明确菌株生长的最佳环境条件和对病害的生防潜力,为生防菌发挥其最佳防效以及生防制剂的研制提供理论依据,为徐淮地区大豆病害的绿色防控提供生防资源,为大豆病害生防菌剂的开发应用奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 生防菌株 生防菌株多粘类芽孢杆菌XZ-2由江苏徐淮地区徐州农业科学研究所油料研究课题组从健康大豆植株中分离、筛选和鉴定,并于-20 ℃冰箱中保存。
1.1.2 病原菌 供试病原菌大豆疫霉病菌、大豆炭疽病菌、大豆菌核病菌由南京农业大学植物保护学院杀菌剂实验室馈赠并于PDA斜面4 ℃冰箱保存。
1.1.3 供试培养基 XZ-2菌株培养使用LB液体培养基(胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠10.0 g/L)和LBA固体培养基(LB液体培养基加琼脂粉15 g/L),病原菌对峙试验使用PDA固体培养基(土豆20 g/L,葡萄糖20 g/L,琼脂粉15 g/L),将制备好的培养基采用121 ℃高压灭菌锅(Zealway GR85DA,America) 20 min后备用。
1.1.4 样品制备 发酵液:接种活化好的XZ-2菌液50 μl于25 mL LB液体培养基中,28 ℃、180 r/min摇培24 h,待用;发酵滤液:取发酵液,10 000 r/min,4 ℃,离心10 min,弃沉淀,得上清液,采用孔径为0.22 μm的细菌过滤器过滤得到XZ-2发酵滤液;病原菌菌碟:将活化的大豆疫霉病菌、大豆炭疽病菌、大豆菌核病菌接种到PDA培养基上,25 ℃恒温培养,2~ 3 d后用打孔器打取直径为6 mm的大豆疫霉病菌菌落边缘的菌碟备用;4~5 d后打取大豆炭疽病菌菌碟备用;2 d后打取大豆菌核病菌菌碟备用。
1.2 XZ-2的生物学特性研究
1.2.1 XZ-2生长对O2的需求 深层琼脂法[13]:将生防细菌制成菌悬液,微波溶好LBA培养基然后分装到灭菌试管中,待试管自然冷却到45~50 ℃时各吸取100 μl制备好的菌悬液加入试管中,快速搓动试管且避免震荡导致过多的空气混入培养基中,待菌液在培养基中混合均匀后,将试管置于冰浴中使培养基迅速凝固。将接种好菌液的试管置于28 ℃恒温生化培养箱内静置培养,48 h后开始观察生长状况,直至10 d 后结果清晰为止,试验重复3 次。根据在试管中的生长部位,判断该生防菌株对O2的需求。分类依据如下:好氧菌只在培养基表面生长;微好氧菌在培养基中部生长;兼性厌氧菌在培养基接近表面及上部生长旺盛,中下部也有少量生长;专性厌氧菌只在培养基底部生长;耐氧厌氧菌在培养基中均匀生长。
1.2.2 pH值对XZ-2生长的影响 设5~12等8个梯度,用0.1 mol/L HCl 和0.1 mol/L NaOH 调节LB 培养基的pH值。用三角瓶分别取25 mL各梯度pH的培养基,接种50 μl XZ-2种子液到各三角瓶中,每处理均设3次重复,28 ℃、180 r/min摇床中培养24 h后记录OD600。
1.2.3 氯化钠浓度对XZ-2生长的影响 以LB培养基为基础培养基,其中NaCl称取量分别设置0,5,10,15,20和25 g/L等6个梯度,接种50 μl XZ-2种子液到各三角瓶中,每处理均设3次重复,28 ℃、180 r/min摇床中培养24 h后记录OD600。
1.2.4 光照条件对XZ-2生长的影响 接种50 μl XZ-2种子液到LB培养基中,分别设置光照、黑暗和12 h光照12 h黑暗光暗交替3个处理,每处理均设3次重复,28 ℃、180 r/min摇床中培养24 h后记录OD600。
1.2.5 XZ-2致死温度测定 设置45、50、55、60、65、70、75、80、90和100 ℃共10 个温度梯度,无菌条件下取100 μl XZ-2种子液置入1.5 mL灭菌离心管中盖好,分别水浴10 min,然后取出涂板,将处理好的平板置于28 ℃恒温生化培养箱中培养2 d以上,观察有无菌落长出,根据菌落生长与否,确定致死温度,每处理均设3次重复。
1.3 拮抗活性测定
拮抗活性测定方法参考Yang等[14]方法,此处不再赘述,每个处理3个平板即3次重复,将接种好的平板置于28 ℃恒温生化培养箱中培养,待对照中两病原菌菌丝交接时,测定抑菌带直径并记录分析。
1.4 受拮抗的病原菌菌丝及孢子显微观察
采用倒置显微镜(Leica DMILLED,Germany)观察XZ-2发酵滤液对大豆疫霉病菌、大豆炭疽病菌、大豆菌核病菌菌丝形态的影响,以及对大豆炭疽病菌产孢及孢子萌发的影响,以清水处理为对照,每处理3次重复,记录并拍摄照片[14]。
2 结果与分析
2.1 XZ-2的生物学特性
2.1.1 XZ-2生长对O2的需求 从48 h至10 d连续每天观察XZ-2在试管内的生长状况,发现XZ-2在深层琼脂培养基接近表面及上部生长旺盛,中下部也有少量生长,因此鉴定XZ-2为兼性厌氧菌。

图1 不同pH值对XZ-2生长的影响Fig.1 Effect of different pH on the growth of XZ-2

图2 不同浓度NaCl对XZ-2生长的影响Fig.2 Effect of different concentration of NaCl on the growth of XZ-2
2.1.2 pH 值对XZ-2生长的影响 从图1可以看出,在pH 5~12等8个梯度的LB液体培养基中,XZ-2在pH 6,7,8的培养基中生长最好,菌液OD600分别为0.359,0.375,0.377;在pH 5的条件下生长较差,菌液OD600为0.206;pH 9,10,11,12时菌液OD600值迅速降低,分别为0.048,0.0477,0.0477,0.0477,说明该菌株在pH 9以上基本不生长。
2.1.3 氯化钠浓度对XZ-2生长的影响 如图2所示,XZ-2随着氯化钠浓度的增加,其生长逐渐被抑制。在供试的6种氯化钠梯度浓度的LB液体培养基中,XZ-2在氯化钠浓度为0~15 g/L的生长情况相对较好,菌液OD600分别为0.365,0.345,0.345,0.328;在氯化钠浓度为20 g/L时菌液OD600为0.292;在氯化钠浓度为25 g/L时生长最差,菌液OD600为0.219。
2.1.4 光照条件对XZ-2生长的影响 从图3可以看出,XZ-2在24 h黑暗条件下生长最好,菌液OD600为0.318;其次为12 h光暗交替的条件,菌液OD600为0.309;在24 h光照的条件下生长最差,菌液OD600为0.293,总体而言,该菌株对光照的敏感性不强。
2.1.5 XZ-2致死温度 调查结果显示,经过90 ℃以下温度水浴处理10 min后涂板,在LBA上仍能长出菌落,而经过100 ℃,10 min处理后涂板,看不到菌落的形成,由此鉴定该菌株的致死温度为100 ℃,10 min。
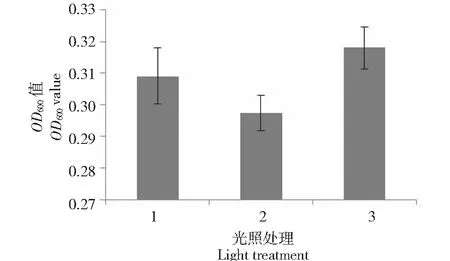
1.12 h光照和12 h黑暗;2.24 h光照;3.24 h黑暗1.12 hours light and 12 hours dark; 2.24 hours light; 3.24 hours dark图3 不同光照处理对XZ-2生长的影响Fig.3 Effect of different light treatments on the growth of XZ-2
2.2 XZ-2拮抗活性测定
待对照中两病原菌菌丝交接时,测定抑菌带直径(表1),XZ-2对供试的3种大豆主要病害的病原菌均有较强的抑制活性,对大豆疫霉病菌、大豆炭疽病菌和大豆菌核病菌的抑菌带直径分别为22.3、24.2和23.6 mm。抑菌照片如图4所示,说明XZ-2对3种供试大豆病原真菌抑制效果很强,均显示出了非常明显的抑菌带。

表1 XZ-2对3种大豆病原菌的拮抗活性
2.3 XZ-2对3种大豆病原菌的菌丝形态及孢子萌发的影响
2.3.1 XZ-2发酵滤液对大豆疫霉病菌的菌丝形态的影响 显微镜观察(图5)表明,对照菌丝纤细光滑,粗细均匀,末端尖细,而经菌株XZ-2发酵滤液处理的菌丝膨大、畸形,分枝增多。
2.3.2 XZ-2发酵滤液对大豆炭疽病菌的菌丝形态以及孢子萌发的影响 显微镜观察(图6)表明,对照菌丝纤细光滑,粗细均匀,末端尖细,而经XZ-2发酵滤液处理的菌丝则膨大、畸形,出现原生质浓缩和内含物释放的现象,发酵液处理的孢子不能正常萌发,并且经发酵滤液处理后的菌丝产孢数量明显少于对照(图7),说明XZ-2还可以抑制大豆炭疽病菌孢子的产生。
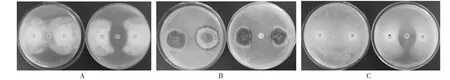
4-A, 4-B, 4-C的指示病原菌分别为大豆疫霉病菌,大豆炭疽病菌,大豆菌核病菌;每个图中左边平板为对照,右边平板为XZ-2处理4-A, 4-B and 4-C represented as antibiotic activity of XZ-2 against Phytophthora sojae, Glomerella glycines and Sclerotinia sclerotiorum, in each figure the left pictures represented as control and the right pictures represented as pathogens treated by XZ-2图4 XZ-2的拮抗活性测定Fig.4 Analysis of antibiotic activity of XZ-2

5-A: 对照;5-B: XZ-2发酵液处理后的菌丝膨大,畸形;5-C:XZ-2发酵液处理后的菌丝分枝增多5-A: Control; 5-B: Hyphae treated by fermentation liquid of XZ-2 were swelled and deformed; 5-C: Branches of hyphae treated by fermentation liquid of XZ-2 increased图5 XZ-2发酵滤液对大豆疫霉病菌的菌丝形态的影响Fig.5 Effects of fermentation liquid of XZ-2 on hyphae morphology of Phytophthora sojae

6-A: 对照,Control; 6-B: XZ-2发酵液处理后的菌丝膨大,畸形6-A: Control; 6-B: Hyphae treated by fermentation liquid of XZ-2 were swelled and deformed图6 XZ-2发酵滤液对大豆炭疽病菌的菌丝形态的影响Fig.6 Effects of fermentation liquid of XZ-2 on hyphae morphology of Glomerella glycines

7-A: 对照,Control; 7-B: XZ-2发酵液处理后的孢子基本不萌发7-A: Control; 7-B: Spores treated by fermentation liquid of XZ-2 nearly ungerminated图7 XZ-2发酵滤液对大豆炭疽病菌孢子萌发的影响Fig.7 Effects of fermentation liquid of XZ-2 on spores germination of Glomerella glycines
2.3.3 XZ-2发酵滤液对大豆菌核病菌的菌丝形态的影响 显微镜观察(图8)表明,对照菌丝纤细光滑,粗细均匀,末端尖细,而经菌株XZ-2 发酵滤液处理过的菌丝膨大、畸形,菌丝分枝增多。
3 讨 论
生防因子的稳定性对于生防效果至关重要,抗生因子在土壤中的有效存活期是生防因子保持稳定拮抗活性的关键因素之一。因此,生防菌剂引入到土壤环境之前,应该首先考虑对土壤环境的适应性[15],适宜的环境能使生防菌在根系中较长时间内保持较高的种群密度。本课题组前期从江苏省徐州市铜山区班井村健康大豆植株中分离筛选得到的拮抗效果较好的生防菌株XZ-2。生物学特性研究结果表明该菌株在pH 6~8生长情况最佳,但是pH 8以上该菌株基本不生长,说明该菌株耐弱碱性;在氯化钠浓度为0~15 g/L的生长情况相对较好,在氯化钠浓度为25 g/L的情况下仍然可以较好的生长;致死温度为100 ℃,10 min,说明该菌株具有较好的高盐和高温抗性。明确生防因子对环境因子(如pH、盐碱地、需氧量等)适应能力,可为该生防菌株的应用生态环境的选择提供理论依据。拮抗活性测定显示该菌株对引起大豆主要病害的大豆疫霉病菌、大豆炭疽病菌和大豆菌核病菌均有较强的抑制作用,抑菌圈直径均达到20 mm以上。显微观察发现XZ-2发酵滤液可导致病原菌的菌丝膨大,畸形以及分枝增多,并且该菌株可抑制大豆炭疽病孢子产生和孢子萌发。

8-A:对照;8-B:XZ-2发酵液处理后的菌丝膨大,畸形;8-C:XZ-2发酵液处理后的菌丝分枝增多8-A: Control; 8-B: Hyphae treated by fermentation liquid of XZ-2 were swelled and deformed; 8-C: Branches of hyphae treated by fermentation liquid of XZ-2 increased图8 XZ-2发酵滤液对大豆菌核病菌的菌丝形态的影响Fig.8 Effects of fermentation liquid of XZ-2 on hyphae morphology of Sclerotinia sclerotiorum
4 结 论
本试验表明XZ-2是1株具有很好的生防应用前景的菌株。下一步将开展大豆病害田间防治试验,针对Yim等[16]关于生防菌Methylobacteriumspp.可以调控番茄中病程相关蛋白(pathogenesis- related protein,PRs)基因表达的相关报道,还将对XZ-2处理的大豆植株进行病程相关蛋白基因的时空表达分析,探索该菌株是否能诱导植物抗病性的产生,为进一步研究XZ-2 的生防机理奠定基础。同时,对大豆促生作用、产量及品质影响以及对大豆根围土壤微生物生态多样性的调节进行研究,为该菌株的开发应用奠定基础。

