小分子海洋抗菌肽鲎素Ⅰ里氏木霉表达系统构建
张丽君,王 英,张 燕,简 琛,金 刚,代建国
(1.深圳职业技术学院应用化学与生物技术学院,广东深圳 518055; 2.广州城市职业学院食品系,广东广州 510405)
阳离子抗菌肽(antimicrobial peptide,AMP)鲎素Ⅰ(tachyplesin Ⅰ)由Nakamuro等首次从中国鲎(Tachypleustridentatus)血细胞分离纯化制得[1],分子量为2 263 u,一级结构由17个氨基酸残基构成,含有2个二硫键;二级结构呈典型的反平行β-折叠结构,疏水的氨基酸残基定位于平面一侧,分子中6个阳离子氨基酸残基主要分布在分子的尾部。鲎素Ⅰ具有抗细菌[2]、抗真菌[3]、抗病毒[4]、抑制肿瘤细胞增殖和诱导癌细胞分化[5]以及显著调控动物肠道微生物菌群[6]的功能,极具潜在广泛的应用价值。然而,天然鲎素Ⅰ来源非常受限,人工合成价格非常昂贵,因此基因重组制备成为规模化获取鲎素Ⅰ的重要途径。
鲎素Ⅰ对常见基因工程宿主的广泛和强烈的抑杀活性[7-8]使其高效表达异常艰难,融合表达虽可降低鲎素Ⅰ对工程宿主的抑杀活性,但因特异性蛋白酶价格昂贵和后续切割精度难以保证而无法得到有效应用。因此,从天然微生物筛选得到耐受鲎素Ⅰ抑杀的宿主以提高鲎素Ⅰ的表达效率值得期待。本课题组比较了鲎素Ⅰ对大肠杆菌(BL21)、枯草芽孢杆菌(WB800、BS168)、酵母菌(GS115)、小球藻和丝状真菌里氏木霉(QM9414)等常见工程宿主的抑杀活性,发现丝状真菌里氏木霉对鲎素Ⅰ的耐受能力最强[7-8]。迄今为止,抗菌肽能否在里氏木霉中获得有效表达尚未见相关报道。本研究拟构建鲎素Ⅰ-里氏木霉表达系统,探索鲎素Ⅰ在此表达系统中的表达效率。
1 材料与方法
1.1 材料
1.1.1 试验材料 里氏木霉表达载体pAN-PSGT和里氏木霉(QM9414),均由深圳大学刘刚教授惠赠;大肠杆菌(Escherichiacoli) Competengt Cell JM109,购自大连TaKaRa公司。
1.1.2 试剂 质粒快速提取试剂盒、琼脂糖凝胶DNA纯化回收试剂盒、DNA连接试剂盒、Trizol试剂盒和两步法RT-PCR试剂盒以及蛋白质Marker,均购自TaKaRa公司;溶壁酶、氨苄青霉素和潮霉素,均购自Sigma公司;NotⅠ、SfiⅠ酶和X-gal,均购自TaKaRa公司。
1.2 方法
1.2.1 天然鲎素基因(Tac)序列的人工合成 从GenBank中获得鲎素Ⅰ的碱基序列,根据丝状真菌里氏木霉偏爱密码子优化其序列:在其5′端和3′端分别加上NotⅠ和SfiⅠ酶酶切位点,并补齐宿主中信号肽的部分序列,设计目的基因序列如下:
5′-GGCCTTCTTGGCCACAGCTCGTGCTAAGTGGTGCTT-CCGCGTCTGCTACCGCGGCATCTGCTACAGGCGATGTCGCTA-AGCGGCCGC-3′,该序列全长87 bp,委托大连宝生物公司人工合成。
1.2.2 鲎素-里氏木霉表达载体构建 pAN-PSGT全序列9 710 bp,包括Pgpd启动子序列(2 129 bp)、潮霉素抗性基因php序列(1 023 bp)、终止子序列TtrpC(770 bp)、PUC18中从SALI到ECORI之间的序列AP(2 648 bp)、gpd启动子序列(1 347 bp)、信号肽序列CBHⅠ sig(50 bp)、LacZ序列(1 132 bp)、Tcbh终止子(340 bp)。采用常规分子重组技术将鲎素Ⅰ基因Tac连接到gpd-sig和Tcbh中间,构建成一个新的表达载体pAN-PSGT-Tac,转化大肠杆菌JM109,采用α互补法(蓝/白斑筛选法)进行阳性克隆筛选。菌落PCR法鉴定转化子,用通用引物M13-47/RV-M进行PCR扩增。反应体系总体积50 μL,PCR反应条件为:94 ℃ 1 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min。用2%琼脂糖凝胶电泳检测PCR产物。PCR产物进一步经大连宝生物有限公司测定序列。
1.2.3 重组载体pAN-PSGT-Tac转化里氏木霉原生质体 里氏木霉原生质体的制备和转化在参考Penttila等的方法[9]基础上改造如下:里氏木霉孢子接种于PDA固体培养基,28 ℃ 培养7 d;无菌水制备孢子悬液,取0.8×108~ 1.0×108个孢子,接种到40 mL液体培养基中,于28 ℃、250 r/min 培养11~15 h;待孢子萌发,取25 mL菌液置于 25 mL 离心管,6 000 r/min 离心5 min;去上清,菌丝用1 mol/L MgSO4洗2遍,8 000 r/min 离心5 min;用10 mL酶解液(100 mg 溶壁酶溶于 10 mL 1 mol/L MgSO4后过滤除菌)重悬菌丝并置于100 mL三角瓶中,28 ℃、70 r/min培养2.0~2.5 h,镜检原生质体的情况。在酶解液中加入1~2倍体积的STC[1.2 mol/L山梨醇,10 mmol/L Tris·Cl(pH值为7.5),50 mmol/L CaCl2]8 000 r/min 离心15 min,沉淀原生质体。去上清,用STC溶液洗涤原生质体2次,8 000 r/min离心10~15 min,最后将原生质体悬浮于1 mL STC溶液中。调整原生质体的浓度为108个/mL,取200 μL,加入20 μg pAN-PSGT-Tac(总体积不超过20 μL),轻轻混匀;48 ℃热激2 min;加入50 μL 60%的PEG-4000(用pH值为7.5含50 mmol/L CaCl2和 10 mmol/L Tris·Cl的缓冲液配制),于室温静置20 min。溶液先转移到25 mL离心管中,再加入 2 mL 60%的PEG-4000,混匀后于室温静置5 min;加入 20 mL STC,11 000 r/min,离心15 min;用1 mL STC溶液重悬原生质体沉淀后加入到10 mL原生质体液体再生培养基中,于28 ℃、70 r/min条件下培养20~24 h(原生质体长成微小菌丝即可,若菌丝较大,则涂板后不易区分单菌落);8 000 r/min 离心10 min后用0.5~1.0 mL STC溶液悬浮沉淀,将悬浮液涂布于5个含 100 μg/mL 潮霉素B的PDA固体平板(不含STC)上,28 ℃培养2 d左右;待平板上长出菌丝(平板底部变黄),将菌丝连同其下方的一层薄薄的琼脂块一同挖下,菌丝朝下接到新的PDA固体小平板上(含80 μg/mL潮霉素B),28 ℃培养7 d左右。
1.2.4 里氏木霉转化子鉴定
1.2.4.1 转化子潮霉素基因鉴定 将筛选平板上长出的潮霉素抗性转化子分别转接到PDA平板上进行扩大培养,1周后首先将各转化子分别接种于液体基本培养基中,提取各转化子的基因组DNA作为模板,用引物HPH1和HPH2进行PCR扩增,扩增产物进行琼脂糖凝胶电泳检测[10]。
1.2.4.2 转化子的基因型鉴定 提取转化子基因组DNA作为模板,由于Tac基因太小,PCR扩增存在极大难度,本试验设计的鉴定方式为扩增Tac基因上下游的片段,分别为gpd-sig-tac-Tcbh、gpd-sig、gpd-sig-tac、tac-Tcbh和Tcbh,如果能扩增出这5种片段,则可确定鲎素Ⅰ基因Tac已成功同源替换到里氏木霉基因组DNA上了,并且插入方向正确。扩增片段、所需引物和预计扩增片段大小见表1。并将用引物GPD1和TRD3扩增所得的PCR产物进行核苷酸序列测定。
1.2.5 引物设计与合成 本研究过程所采用的引物序列见表2,各引物均由大连宝生物公司合成。

表1 扩增片段、所需引物和预计扩增片段大小

表2 引物序列
2 结果与分析
2.1 pAN-PSGT-Tac重组载体构建
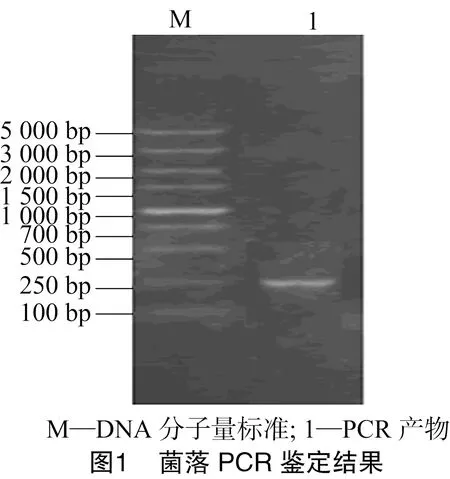
以重组载体为模板,采用PAN-PSGT通用引物M13-47/RV-M进行PCR扩增。通用引物扩增产物大小约 150 bp,加上鲎素Ⅰ基因87 bp,预计目的条带大小约为 240 bp,电泳结果见图1,在250 bp附近发现1条清晰的条带,初步确认其为目的条带。PCR产物测序结果与已知序列同源性达到100%,确认鲎素Ⅰ基因Tac已经正确连接至表达载体PAN-PSGT之中。
2.2 载体pAN-PSGT-Tac对里氏木霉原生质体转化后的鉴定
2.2.1 潮霉素基因的PCR扩增结果 提取筛选平板上长出的潮霉素抗性转化子的基因组DNA为模板,PCR扩增潮霉素抗性基因,引物为HPH 1和HPH 2。由图2可知,潮霉素抗性基因hph基因大小为1 023 bp,在1 000 bp处发现条带,可以证明潮霉素基因成功扩增,初步确定潮霉素基因已经成功转化。

2.2.2 转化子基因型鉴定 取潮霉素基因鉴定为阳性的菌株,提取其基因组DNA按“1.5.2”节进行基因型鉴定,由图3可知,以基因组DNA为模板,1泳道为扩增出的gpd-sig-tac-Tcbh片段,扩增条带在1 500~2 000 bp之间,符合预期大小1 824 bp;2泳道为扩增出的gpd-sig片段,大小在1 000~1 500 bp 之间,符合预期大小1 387 bp;3泳道为扩增出的gpd-sig-tac片段,大小在1 500 bp附近,符合预期大小 1 474 bp;4泳道为扩增出的tac-Tcbh片段,大小靠近 500 bp,符合预计大小427 bp;5泳道为扩增出的Tcbh片段,大小在250~500 bp之间,符合预计大小340 bp。5种扩增都验证为正确,即可初步确定鲎素Tac基因已正确同源整合到基因组DNA上。针对gpd-sig-tac-Tcbh的扩增产物测序结果与已知序列的同源性达100%,可以证明鲎素基因已经重组到基因组DNA上。

3 讨论
基因重组表达鲎素Ⅰ的研究开始于20世纪90年代,但重组鲎素Ⅰ商品至今尚未问世。总体而言,国内外对鲎素Ⅰ基因工程表达主要集中在以细菌、真菌和藻类为宿主的表达体系上。
张春义等首次在大肠杆菌中以包涵体形式表达了鲎素Ⅰ,但因需变性和复性,产品下游处理难度较大[11-12];Dai等在枯草杆菌WB800中分泌表达了鲎素Ⅰ,但表达量最高仅达到10 μg/mL,与酵母菌是否可分泌性表达鲎素Ⅰ报道结果[6]相差较大。张春义等报道鲎素基因可克隆至毕赤酵母表达载体,其诱导分泌产物有抑菌效果,但具体蛋白表达量均未提及[13-14];Xu等将鲎素Ⅱ克隆至毕赤酵母SMD1168,鲎素Ⅱ表达量经过甲醇诱导6 d可达150 mg/L[15];Dorrington未能在毕赤酵母发酵液中检测到鲎素Ⅰ[16];Gao等实现了鲎素Ⅰ基因和人溶菌酶基因在毕赤酵母的融合表达,虽然避免了鲎素Ⅰ对基因工程宿主的抑杀作用,但用特异性蛋白酶切割鲎素Ⅰ与融合蛋白时,容易造成氨基端出现多余的氨基酸,或切割效率低下,甚至不能切割等[17];吴顺章等[18]、邓祥元等[19]分别成功地将鲎素Ⅰ基因整合到坛紫菜(红藻门,多细胞真核藻)和海带配子体(褐藻门,单细胞真核藻)内,但前一研究仅在DNA和mRNA层面检测到鲎素Ⅰ基因整合到坛紫菜基因组中,未报告是否表达了鲎素Ⅰ,后一研究虽表达了具有活性的鲎素Ⅰ,但其表达量要低于大肠杆菌表达体系[11]和枯草杆菌表达体系[6,10,18-19]。
综上所述,本课题组观察了鲎素Ⅰ对大肠杆菌、枯草杆菌、酵母菌、小球藻和丝状真菌里氏木霉的抑杀活性,发现除丝状真菌里氏木霉外,鲎素Ⅰ对其余工程宿主的最小抑杀浓度均不超过20 μg/mL[7-8]。因此,本课题组猜想,鲎素Ⅰ可强烈抑杀工程宿主极有可能是其一直难以获得高效表达的主要原因。因此,找到比较耐受鲎素Ⅰ抑杀的工程宿主,如丝状真菌里氏木霉,可能是解决鲎素Ⅰ如何获得高效表达的关键。
丝状真菌里氏木霉生产纤维素酶、半纤维素酶和淀粉酶等已有多年的历史,该菌株在产酶条件下不产生毒素。实践还表明,经基因工程手段改造的里氏木霉表达系统能够实现异源蛋白过量表达。Emilio等将TrichodermaharzianumP1的几丁质酶编码基因置于里氏木霉CBH Ⅰ启动子之后,摇瓶产量可达130 mg/L(达到原产菌株的20倍)[20]。几丁质酶能抑制多种真菌的生长,但里氏木酶却能高效生产几丁质酶。可在里氏木霉中获得高效表达的异源蛋白还有肌醇六磷酸酶(2 g/L)、哺乳动物的牛凝乳蛋白酶(40 mg/L)、抗体片段(150 mg/L)和人N-乙酰葡萄糖苷转移酶等[21]。但迄今为止,抗菌肽能否在丝状真菌里氏木霉系统中得到高效表达尚不清楚。
本研究根据里氏木霉偏爱密码子优化了鲎素Ⅰ的基因序列,人工合成了该序列,采用酶切、连接等方法将鲎素Ⅰ基因成功连接至里氏木霉表达载体pAN-PSGT之上,构建了 pAN-PSGT-Tac重组表达载体。pAN-PSGT表达载体无需“共转法”,可“单转法”即直接用质粒转化里氏木霉原生质体;pAN-PSGT采用里氏木霉QM9414 CBH Ⅰ的信号肽来引导目的蛋白的分泌。Kuo等发现许多真菌的gpd启动子可用于重组蛋白的调控和转录过程中,提高目的产物的表达水平[22]。同时,信号肽可引导目的蛋白分泌到胞外,产物分离时不必破碎宿主细胞,同时分泌到胞外的蛋白往往都具有正确的空间折叠构象,利于下游的分离纯化;pAN-PSGT中带有LacZ基因,可通过蓝白斑筛选阳性克隆。
采用PEG介导法将重组表达载体pAN-PSGT-Tac转化至里氏木霉QM9414原生质体,潮霉素筛选得到了重组子,基因型鉴定结果表明,鲎素Ⅰ基因已经重组到基因组DNA上,说明本研究成功构建了鲎素Ⅰ里氏木霉表达系统。利用本系统表达鲎素Ⅰ蛋白的研究需要进一步研究。
4 结论
本试验成功构建了鲎素Ⅰ-里氏木霉表达载体,并成功转化至里氏木霉QM9414细胞中。这一结果为进一步改进鲎素Ⅰ在里氏木霉表达系统中表达研究奠定了基础,对于其他小分子肽类蛋白在丝状真菌表达系统中的表达也具有一定的指导意义。

