潮霉素B对拟南芥种子萌发及幼苗生长的影响
程琳琳, 王 璇, 彭文涛, 周立军, 王纪坤, 谢贵水, 安 锋
(1.中国热带农业科学院橡胶研究所, 海口 571101;2.农业农村部儋州热带作物科学观测实验站, 海南 儋州 571737;3.海南大学热带作物学院, 海口 570228)
潮霉素B(以下简称潮霉素)作为氨基糖苷类正糖霉素族Ⅱ类抗生素[1]的代表之一,被广泛应用于生物学领域,常作为转化的选择剂[2],具有重要的应用价值和商业价值。潮霉素在20世纪50年代被发现,它主要通过靶向细菌中的30 S核糖体亚基[3]和真核细胞中的核糖体[4],从而阻碍蛋白质的合成[5],最终致使细胞逐渐褐化直至死亡[6]。潮霉素具有抑菌、杀虫功能,可作为生物学研究过程中遗传操作选择剂[7],被广泛应用于畜牧业和生物工程中。拟南芥(ArabidopsisthalianaL. Heynh.)是十字花科拟南芥属的草本植物,因其体型小、生命周期短、易于种植管理、基因组仅有5条染色体并已完成测序等优点,成了遗传学的模式生物,对生物化学、植物生理、代谢组、发育生物、生物合成、基因工程等学科领域的发展具重要作用[8]。在对不同物种目的基因功能验证分析中,以具潮霉素抗性的载体进行农杆菌介导的拟南芥转化,适宜浓度的潮霉素筛选是获得转基因阳性株系的有效途径[9]。在拟南芥的潮霉素筛选中,贾庆利[10]发现,潮霉素浓度大于等于30 mg/L 时,野生型拟南芥种子放置于培养基上第10天,培养基上无绿色幼苗。徐晓寒等[11]以25 mg/L的潮霉素作为筛选剂,获得纯合的T3代转基因拟南芥种子。陈锡等[12]用30 mg/L的潮霉素对转基因拟南芥进行了筛选。张勇等[13]以添加50 mg/L潮霉素的MS培养基筛选转基因拟南芥抗性种子。武亚丹等[14]、张春微等[15]进行转基因拟南芥种子筛选的潮霉素浓度均为25 mg/L。Lin等[16]以50 mg/L的潮霉素对转基因拟南芥种子进行了筛选。适宜的潮霉素浓度既可保证拟南芥种子的正常萌发、胚根伸长、根系发育与幼苗生长,又可有效降低转基因种子的假阳性率,减少转基因株系后续筛选的工作量,提高以拟南芥进行目的基因功能验证的准确率与效率。然而,采用种子萌发及幼苗生长相关指标的差异性比较进行潮霉素适宜浓度的筛选,仅为同一指标间数据的比较,而且由于测定数据之间的误差,结果具有一定的局限性[17]。而变异系数-熵权法的复合权重协调分配各种指标的权重,避免单一指标差异过小的缺陷[18],再将变异系数-熵权组合权重运用到TOPSIS法(Technique for Order Preference by Similarity to Ideal Solution)中,最终得到优化的评价方案[19]。因此,以不同浓度潮霉素对拟南芥种子萌发及幼苗生长相关生理、形态指标差异性研究入手,结合基于变异系数-熵权法复合权重的TOPSIS法来评价相应指标的综合效果,确定拟南芥种子进行潮霉素筛选的最适宜浓度,并根据幼苗生长形态确定筛选时期,为拟南芥转基因阳性种子筛选及目的基因功能验证提供理论依据。
1 材料与方法
1.1 材 料
选取成熟度高、色泽度好、较饱满、整齐度较一致的野生型拟南芥(Columbia-0)种子为实验材料。
1.2 方 法
参照何云龙等[20]的方法对拟南芥种子进行灭菌,用牙签将种子分别点播于含有潮霉素(浓度为0,20,30,40,50 mg/L)的1/2 MS培养基上,潮霉素浓度分别为0(ck),20,30,40,50 mg/L,分别记为M0、M1、M2、M3、M4,3次重复。点播后放入光照培养箱中,参照徐晓寒等[11]的参数设置光照培养箱。从点播的第2天开始,每天统计种子发芽数,种子萌发以胚根突破种皮为标准[21]。参照李云等[22]的方法统计第3天发芽势。第7天,采用Leica M 205 FA荧光体视显微镜观察幼苗生长及根系发育情况,并以LAS图像采集分析系统测定主根长度;采用METTLER TOLEDO MX 5百万分之一天平,参照高俊凤[23]的方法测定幼苗鲜重、干重并计算其相对含水率。连续3 d发芽数无变化,发芽结束[24],参照岳永江等[25]的方法统计种子的萌发率。第13天,统计各处理幼苗的失绿死亡个数,并计算各处理的幼苗失绿死亡率。在点播的第2,3,7,13天以LAS图像采集分析系统拍摄种子萌发及幼苗生长情况。
1.3 数据统计与分析
采用IBM SPSS Statistics 25.0软件进行数据显著性方差分析(多重比较采用Duncan’s新复极差法),用OriginPro 2018软件进行绘图,所有数据均为3次重复的平均值。
参照叶惠娟等[26]的方法对所有数据进行归一化处理(以获得适宜的潮霉素筛选浓度为目标,由此以抑制种子萌发和幼苗生长的指标为正向指标,以促进种子萌发和幼苗生长的指标为负向指标),萌发率、第3天发芽势、第7天鲜重、干重、含水率、主根长度、第13天植株失绿死亡等7项指标所有数据标准化后的指标值分别记为X1、X2、X3、……、X7;参照张媛媛等[19]的方法进行变异系数-熵权法组合权重及TOPSIS法的综合得分计算,各指标的变异系数法权重记为dj(j=1,2,3,……,7),各指标的熵权法权重记为ej(j=1,2,3,……,7),各指标的复合权重记为Wj(j=1,2,3,……,7),不同处理与正/负理想解的欧式距离、接近度分别记为Dj+、Dj-、Cj,计算过程中需修正部分数据[27]。
2 结果与分析
2.1 不同浓度潮霉素对拟南芥种子萌发率和发芽势的影响
种子萌发率可以有效衡量种子质量。在种子点播的第2天,不同浓度潮霉素处理下,拟南芥种子均开始萌发。随着潮霉素浓度的不断增大,萌发率呈逐渐下降的趋势。M1、M2、M3、M4的萌发率均低于M0的萌发率。M0、M1、M2的萌发率分别与M4的萌发率差异达显著水平(p<0.05),但这3个处理之间的差异并不显著。M0、M1分别与M3、M4的萌发率差异达显著水平(p<0.05)。从图1可看出,20~30 mg/L的潮霉素对拟南芥种子的萌发无显著影响,而40~50 mg/L的潮霉素会显著影响种子的萌发率。在第2天种子开始萌发时,5种处理的拟南芥种子的外观形态也无显著差异(图2)。

图1 不同浓度潮霉素对拟南芥种子萌发及幼苗生长的影响

注:每一行从左至右依次为处理M0、M1、M2、M3、M4;每一列从上至下依次为培养的第2,3,7,13天;图中红色标尺代表1 mm。
发芽势为判定种子发芽整齐度和发芽速度的重要指标。如图1所示,在添加不同浓度潮霉素的处理中,拟南芥种子第3天的发芽势均低于对照。而且,随着潮霉素浓度的增加,第3天发芽势呈先增后降的趋势。M0和M2分别与另外3种处理相比,第3天发芽势的差异均达显著水平(p<0.05),但二者并无显著差异。添加30 mg/L的潮霉素处理第3天的发芽势最高,达42.716 3%,显著高于20 mg/L、40 mg/L、50 mg/L处理的16.361 8%,19.566 9%,22.326 8%。第3天,拟南芥种子在不同处理中生长状态具有明显的不同:M0的种子胚根根毛较为密集,而M1、M2的种子胚根根毛较M0的短且稀疏,M3、M4的种子胚根几乎无根毛(见图2)。潮霉素的添加明显抑制了种子胚根根毛的发育与生长。随着潮霉素浓度的增加抑制作用越明显。
2.2 不同浓度潮霉素对拟南芥幼苗鲜重、干重、相对含水率的影响
第7天,潮霉素对幼苗鲜重的影响如图1所示。潮霉素对拟南芥幼苗的鲜重具一定的抑制作用,随着潮霉素浓度的增加,幼苗的鲜重逐渐降低。4种浓度潮霉素处理的幼苗鲜重与对照的差异均达显著水平(p<0.05),但这4者之间的差异并不显著,即添加20~50 mg/L的潮霉素对拟南芥幼苗鲜重的影响差异不显著。
幼苗干重反映了植物利用种子贮藏物质和从外界吸收营养的能力。从图1可以看出,第7天幼苗干重随着潮霉素浓度的增加呈逐渐下降的趋势。潮霉素显著阻碍了幼苗吸收利用种子内和培养基中的营养物质,抑制了幼苗干物质的积累,并随着浓度的增加,抑制作用不断增强。M1处理下幼苗干重与M2、M3、M4处理的幼苗干重的差异达显著水平(p<0.05),但是M2、M3、M4处理之间的差异并不显著,即当潮霉素浓度大于等于30 mg/L时,潮霉素影响拟南芥幼苗干物质累积的效果差异不显著。
植物体内供水、保水机制综合作用的表现就是相对含水率。由图1可见,随着潮霉素浓度的升高,拟南芥幼苗的相对含水率逐渐降低。与对照相比,添加潮霉素显著影响到拟南芥幼苗从培养基中吸收水分与自身保水的能力。20 mg/L的潮霉素处理下拟南芥幼苗的相对含水率为82.823 4%,与40 mg/L、50 mg/L潮霉素处理下(76.106 5%,75.201 1%)相比,差异达显著水平(p<0.05),而与30 mg/L处理下(79.294 8%)相比,降幅为4.260 4%,并未达到显著水平;40 mg/L比30 mg/L处理的降幅为4.020 8%,50 mg/L比30 mg/L处理的降幅为5.162 6%。结果表明,40~50 mg/L的潮霉素会显著影响拟南芥幼苗从培养基内吸收水分及体内水分代谢的平衡。
2.3 不同浓度潮霉素对拟南芥幼苗主根长度的影响
种子萌发时,胚根最先突破种皮,然后伸长发育为主根,根系的生长发育情况决定着植物生长发育的多种生理功能。从图1可以看出,潮霉素严重抑制了根系的生长,随着潮霉素浓度的增加,幼苗主根长度急剧降低。与M0相比,M1、M2、M3、M4处理的幼苗主根长度分别降低了95.851 1%,98.614 5%,98.725 1%,98.931 5%,这4种处理与对照的差异均达显著水平(p<0.05);从M2(30 mg/L)开始降幅逐渐变小,M2比M1降低了66.606 3%,M3比M2降低了7.978 3%,M4比M3降低了16.195 6%,M1、M2、M3、M4之间的差异不显著。第7天,对照拟南芥幼苗已长出两片真叶,而其他处理均未出现真叶;M1、M2处理的绝大部分拟南芥幼苗子叶已展开,胚根已完全脱离种皮,而M3、M4处理的幼苗子叶并未展开,且大部分子叶还未突破种皮。由此可以看出,潮霉素极大程度上影响了幼苗根系的生长发育,继而影响幼苗的生长发育,除对照叶片浓绿外,其他处理的叶片颜色都有一定的变化,且子叶体型较小(见图2)。
2.4 不同浓度潮霉素对拟南芥幼苗失绿死亡的影响
潮霉素对拟南芥幼苗叶绿素的形成具有明显的抑制作用,使叶片无法进行正常的光合作用,导致幼苗停止生长并最终死亡。培养基中潮霉素的存在,致使幼苗出现不同程度的失绿。从第7天开始,各处理的幼苗从子叶开始出现失绿现象。第10天开始,幼苗呈现出白化、黄化、褐化现象,严重时会逐渐死亡。第13天,对照的拟南芥幼苗已长出3~4片真叶,各处理的拟南芥幼苗仅剩零星的存活(见图2)。随着潮霉素浓度的增大,不同处理的拟南芥幼苗失绿死亡率逐渐增大,M3、M4两种处理的幼苗失绿死亡率最高,达99.104 1%和100%,与其他处理的差异均达显著水平(p<0.05),但这两种处理间的差异并未达显著水平。
与M0相比,M1、M2处理的失绿死亡率也达到了显著水平(p<0.05),且二者之间也具有显著性差异(p<0.05),分别为12.326 2%和86.688 4%(见图1)。从图1可知,从30 mg/L潮霉素处理开始幼苗失绿死亡率急剧升高,与20 mg/L潮霉素处理相比,30 mg/L、40 mg/L、50 mg/L潮霉素处理的失绿死亡率增幅分别为603.285 7%,704.011 8%和711.280 0%。
2.5 不同浓度潮霉素处理对拟南芥种子萌发及幼苗生长的综合分析
由图1可知,拟南芥种子萌芽及幼苗生理、形态指标并不是随着潮霉素浓度的增加呈现同样的变化趋势,各处理间相应指标之间的差异性也不尽相同,单纯分析这些数据,无法准确判断何种浓度潮霉素适宜于转基因拟南芥的筛选。引入变异系数-熵权法复合权重的TOSIS法可以综合分析各指标,全面反映潮霉素抑制种子萌发和幼苗生长的情况。首先,对不同处理下拟南芥种子萌发及幼苗生理、形态指标进行无量纲化处理(见表1)。由表1可以得出,在抑制种子萌发和幼苗生长方面,并不是M4处理下的所有指标数据都是最大值,X2的最大值为M1处理,X3最大的是M3处理,X4最大的是M3处理。根据各指标的标准化数据计算出各指标的变异系数法权重、熵权法权重和组合权重(见表2)。由表2可知,最大与最小权重指标组合权重的差值为0.204 5,而其变异系数法、熵权法权重的差值分别为0.088 0、0.105 9;复合权重排名第1位的指标(种子萌发率)权重为0.286 1,分别是其变异系数法、熵权法权重的1.413 4倍、1.339 4倍;复合权重排名最后1位的指标(第7天主根长度)权重,分别是其变异系数法、熵权法权重的71.288 1%、75.682 7%。从最终复合权重计算出的各指标权重可以看出,在衡量潮霉素阻碍种子萌发和幼苗生长方面,种子萌发率、第13天失绿死亡率、种子第3天萌发势、第7天相对含水率为组合权重排序前4的指标。结合各指标无量纲化处理的数据及组合权重,可以得到各指标的加权规范化决策矩阵(也叫加权矩阵,见表3)。由各指标加权规范化决策矩阵可以看出,7个指标的正理想解依次为0.286 1、0.147 3、0.083 4、0.093 5、0.099 8、0.081 5、0.208 4,7个指标的负理想解均为0。最终,计算不同处理分别与正、负理想解的欧式距离和接近度,并进行排序(见表4)。根据接近度排序可知,随着潮霉素浓度的增大,对拟南芥种子萌发和幼苗生长抑制的作用逐渐增强, 30 mg/L潮霉素处理的接近度为0.531 5,最接近抑制效果的50%。综合考虑组合权重排序前4的指标,在1/2 MS培养基中潮霉素抑制拟南芥种子萌发和幼苗生长的临界浓度为30 mg/L,可以作为利用1/2 MS培养基进行含潮霉素抗性的转基因拟南芥筛选的参考浓度值。同时,在种子点播的7~10 d,抗性幼苗需要及时移栽,以利于其后期生长。

表1 各指标无量纲处理
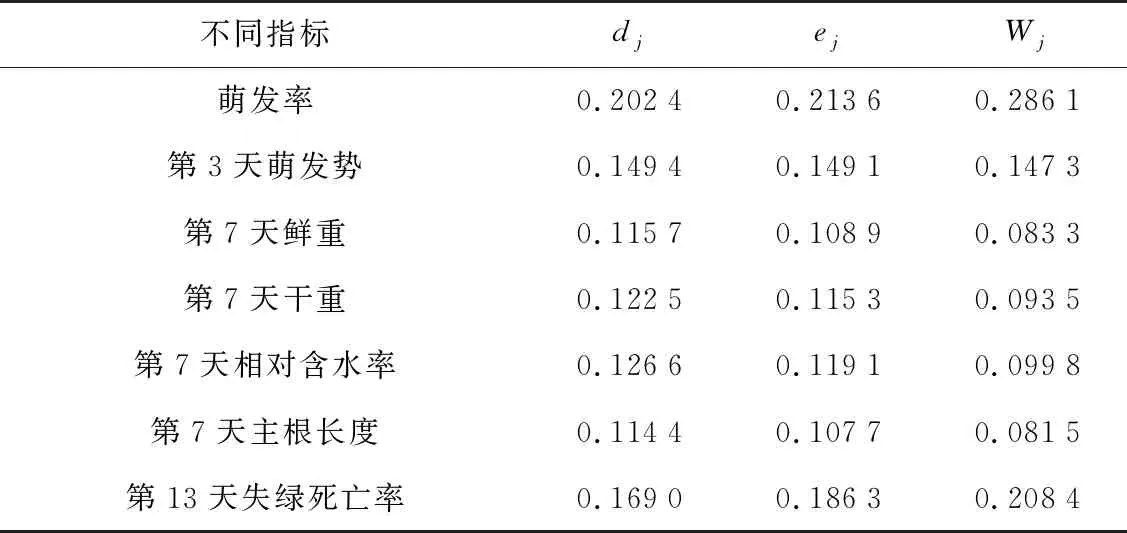
表2 各指标权重

表3 各指标加权矩阵

表4 不同处理的组合权重TOPSIS综合评价及排序情况
3 讨论与结论
种子萌发及萌发后的发育阶段对幼苗的形态建成至关重要,因此这两个时期对外界环境的刺激尤为敏感。一旦周围环境存在抗生素,其胁迫可对种子的生长发育产生相应的压力,即效应[28],由此而致种子生长发育变化或者下降,即协变[29]。种子萌发期及胚根伸长期的实验常用于对外界环境有害物质和受胁迫的植物受害程度的评估[30]。在氯霉素、螺旋霉素、壮观霉素、凡可霉素4种抗生素对番茄种子萌发和根系发育的影响研究中,一定浓度的抗生素(10 mg/L的壮观霉素、100 mg/L的氯霉素、1 000 mg/L的螺旋霉素和凡可霉素)作用7,10 d内,种子萌发不受影响,但根系伸长动力学和细胞分裂受到影响[31]。以莴苣、紫花苜蓿、胡萝卜为实验对象,评估10种抗生素(浓度均为0.1 μg/L、10 μg/L、0.1 mg/L、1 mg/L、10 mg/L)对种子萌发和幼苗早期生长的影响,发现种子萌发对抗生素浓度不敏感,即使是10 mg/L处理时,种子萌发率也无明显下降,但根系伸长为最敏感的节点[32]。5 μmol(2.22 mg/L)的四环素处理大白菜时,对照与处理之间萌发势无显著差异,但四环素通过降低细胞代谢活性而不是破坏细胞完整性来抑制胚根伸长[28]。潮霉素对拟南芥种子萌发影响实验中,1/2 MS培养基中添加30 mg/L的潮霉素不会显著影响拟南芥种子的萌发,但是20 mg/L的潮霉素就已致幼苗主根长度与对照的差异达显著水平(p<0.05),说明拟南芥根系对潮霉素较为敏感。在0,0.2,0.8,1.4,2.0 mg/L的环丙沙星对玉米种子萌发和根系发育的研究中发现,添加环丙沙星能促进种子中活性氧的积累,与对照相比,可以显著缩短萌发时间,0.8 mg/L的环丙沙星缩短萌发时间最明显[33]。在1/2 MS培养基中添加30 mg/L的潮霉素,虽然降低了第3天种子的发芽势,但是与对照相比未达显著水平,原因可能是一定浓度潮霉素胁迫下,种子积累的活性氧在一定程度上促进了种子的萌发,但也对细胞的代谢具有明显的抑制,所以添加潮霉素降低了拟南芥种子第3天的发芽势。
一旦植物受到环境的胁迫,植物进行生长防御的权衡后,将有限的可用能量转移到防御机制的启动中[34]。根系是植物与外界环境的第一接触点,在逆境胁迫中,根系对营养的吸收被抑制,植物的生长也随之受抑制,最终导致植物生物量的下降[35]。大于1 mg/L的环丙沙星即可对水培小麦的地上、地下部的鲜质量、干质量具有显著的抑制作用[36]。0.75 mg/L的土霉素和2 mg/L的恩诺沙星可以显著降低水培水芹地上部分的生物量[37]。本研究中,20 mg/L的潮霉素处理可显著抑制拟南芥幼苗干物质的积累,≥30 mg/L的潮霉素致幼苗干重降低差异不显著,即30 mg/L为潮霉素在1/2 MS培养基中抑制拟南芥幼苗干物质积累的临界点。植物的含水率代表了植物从周围环境中吸收水分及进行物质代谢的能力[38]。在添加卡那霉素的培养基中培养7 d的大白菜幼苗主根和下胚根均缩短,无侧根,根系不发达[39],这与本研究中看到的拟南芥幼苗受潮霉素胁迫后的表型是相似的。根系生长受到抗生素的抑制后,从周围环境中吸收水分的能力必然下降,导致植物相对含水率的降低。从实验结果可以看出,添加潮霉素显著降低了拟南芥幼苗的相对含水率。
50 mg/L的四环素阻止小麦细胞的有丝分裂,蛋白质的合成,降低生长相关酶的活性,使正常细胞器的功能紊乱,显著抑制小麦的生长[40]。红霉素和(或)金霉素处理大白菜种子,降低了大白菜叶绿素含量和光合效率,从而影响大白菜的生理活性[41]。潮霉素抑制蛋白质合成和氧化应激介导共同导致了水稻细胞的死亡[42]。从实验结果中发现,拟南芥幼苗随着潮霉素浓度增大,第13天失绿死亡率逐步增大,从30 mg/L处理开始,失绿死亡率急剧升高,这可能是潮霉素严重抑制幼苗植株蛋白质合成及植株活性氧的急剧积累所造成的结果。
变异系数权重法和熵权法是两种基于多样性的客观赋权方法,可以有效避免人为因素造成的偏差[43]。一般来说,熵权法中指标的信息越多,不确定性越小,熵越小,指标的离散程度越大,该指标相对应的权重在综合评价中就越大[44]。变异系数法中,某指标的变异系数越大,评价对象之间的差异越大,该指标就越难达到,所以该指标所占权重就愈大,对评价结果的影响力越大[45]。变异系数权重法和熵权法的结合可有效削弱异常指标的影响,确保权重结果的真实合理性[46]。实验从适宜于转基因拟南芥潮霉素浓度筛选的角度考虑,所以在最初正、逆向指标设定采用了逆向思维。组合权重的运用凸显了指标权重之间的差异,使得评价结果中指标权重的重要性判断更为明确。排序结果与相关案例[19,47]都说明了组合权重在指标评价中是较为合理的。TOPSIS方法在具有受限选项的多属性/指标决策问题解决方案判定时是可行的,即最佳的方案(处理)为最接近正理想解且最远离负理想解[48]。但是,单纯的TOPSIS方法被认为并未考虑多种方案向正理想解和负理想解分离的相对重要性[49],而组合权重的引入就解决了这一缺陷。将各方案(处理)中各属性/指标的权重融入正、负理想解的判定中,更加客观评价各属性/指标的重要性与方案(处理)的可行性。以组合权重应用到TOPSIS法中,可以作为耕地质量等级划分的有效手段[50],为森林火灾的易损性定量运算和定性分析提供了方法[51]。基于逆向思维的指标设定后,组合赋权的TOPSIS方法得出了不同处理对拟南芥种子萌发及幼苗生长抑制效果排序,抑制效果随着潮霉素浓度的降低而降低,30 mg/L的潮霉素处理接近度为0.531 5,抑制效果处于中位。
通过添加不同浓度潮霉素的1/2 MS培养基对拟南芥种子萌发及幼苗生长的影响研究可以看出,添加潮霉素抑制了拟南芥种子的萌发和幼苗子叶、真叶及根系的发育。随着潮霉素浓度的增加,种子萌发率逐渐降低,≤30 mg/L的潮霉素不能显著降低种子萌发率。添加潮霉素降低了种子第3天的发芽势,可能是受种子活性氧积累的影响,仅30 mg/L的潮霉素处理下种子第3天发芽势与对照相比未达到显著水平(p<0.05)。在潮霉素的胁迫下,拟南芥幼苗根系从1/2 MS培养基中吸收营养被抑制,幼苗生长随之被抑制,最终导致生物量积累的下降。虽然,各处理之间第7天幼苗鲜重的差异不显著,但是与20 mg/L潮霉素处理相比,从30 mg/L潮霉素处理开始,幼苗第7天干重被抑制的程度达到了显著水平(p<0.05)。与20 mg/L潮霉素处理相比,30 mg/L潮霉素处理不会显著影响到幼苗吸水和水分代谢的平衡。潮霉素通过降低细胞代谢来降低幼苗根系生长,从30 mg/L潮霉素处理开始,主根长度的降幅逐渐减小,与20 mg/L潮霉素处理相比仅为7.978 3%。潮霉素胁迫导致拟南芥幼苗失绿死亡,第7天幼苗开始出现失绿症状,第10天失绿症状逐渐严重,第13天添加潮霉素的各处理仅有零星存活。从30 mg/L潮霉素处理开始,幼苗第13天失绿死亡率急剧升高,与20 mg/L潮霉素处理相比增幅达603.285 7%。根据变异系数-熵权组合赋权的TOPSIS方法得出的不同浓度潮霉素抑制拟南芥种子萌发和幼苗生长的正理想解排序为:M4>M3>M2>M1>M0,最接近于50%抑制效果的为M2处理。根据潮霉素筛选的要求及实验相关的结果,适宜于1/2 MS培养基进行拟南芥抗性筛选的浓度为30 mg/L,且7~10 d为相应拟南芥幼苗移栽的适宜时期。

