废锂电池中钴锂的酒石酸浸出条件研究
程 前,罗小绒,庄汉文
(1.厦门理工学院环境科学与工程学院,福建 厦门 361024;2.福建省农村污水处理与用水安全工程研究中心,福建 厦门 361024)
在当今时代,人们的生活已经离不开各类电子产品,电子产品的加速普及促进了锂离子电池的需求,大量的废锂电池也应运而生。废锂电池中含有有机物和重金属元素,若不及时处理会对环境和人类健康造成威胁,同时也会造成资源浪费[1]。我国钴、锂资源有限,若不回收利用将会在未来的60年内出现资源短缺[2-3]。将这部份有价值的金属资源通过有效的回收手段进行回收利用,可以填补当前需求缺口。目前回收废锂电池中贵重金属的工艺有很多,其中湿法冶金工艺以能耗低、污染小等优点被普遍采用。酸浸作为湿法冶金工艺的重要步骤之一,浸出剂的选择与回收过程中的环境问题以及经济效益密切相关。 在相关的酸浸研究中,无机酸因良好的浸出效果且廉价易得,曾受到广泛关注[4-5]。 但是无机酸在酸浸过程中会产生污染性气体,且酸浸废液不易回收处理。目前有机酸受到越来越多学者的青睐,Li等[6]采用抗坏血酸和过氧化氢分别作为浸出剂和还原剂处理废锂电池,但体系中采用的抗坏血酸易氧化分解,不稳定,过氧化氢也极易分解,应用到实际的工业化生产会导致难度增加,回收成本增高。
酒石酸是存在于植物中的一种天然酸,在正常情况下不易挥发,在自然界中易降解,与其他有机酸相比具有成本低且酸度高等优点。 Nayaka等[7]研究了利用酒石酸和抗坏血酸混合溶液浸出废锂电池中的钴,但未深入考察各参数对锂浸出情况的影响。本文以酒石酸作为浸出剂,考察废锂电池正极活性材料与酒石酸的反应产物,并利用单因素实验,通过考察酒石酸浓度、浸出温度、固液比、反应时间来分析废锂电池正极活性材料中Co2+、Li+最大化浸出的酸浸条件,以期为后续从废锂电池中提取钴锂金属并加以二次利用奠定良好基础。
1 实验方法
1.1 实验原料与仪器
实验原料:N-甲基吡咯烷酮(NMP)、硫酸钴、硫酸锂、酒石酸、盐酸均为分析纯,废旧锂离子电池(福建某电池回收厂提供)。
实验仪器:UV-2540A型紫外分光光度计(岛津有限公司),DF-101s型集热式恒温磁力搅拌器(杭州明远仪器有限公司),PE-optima 7000 DV电感耦合等离子体光谱仪(ICP,珀金埃尔默仪器(上海)有限公司),SHB-D(Ⅲ)循环水式多用真空泵(上海申光仪器仪表有限公司),SXL-1008型马弗炉,球形冷凝管,温度计等。
1.2 实验原料及浸出液的制备
将废锂电池浸泡在 NaCl 溶液中充分放电,取出后通过手工拆解电池,依次去除外壳、隔膜、铜铁连线和负极片。 利用 NMP 能有效地溶解正极片上有机粘结剂聚偏二氟乙烯(PVDF)的特性,以固液比为 5 g·L-1溶解正极片,适当加热以加速溶解,约 0.5 h 后正极活性材料可从铝箔上完全脱落。 分离铝箔,将悬浮液进行抽滤,可得到黑色滤渣。 然后于马弗炉中 700 ℃ 下煅烧 5 h,以去除正极活性材料中的炭黑和有机物。 最后用玛瑙研钵仔细研磨均匀,即得到正极活性黑色粉末[6] 289。 过程如图 1 所示。 所使用的 NMP 溶剂可在过滤之后通过蒸馏的方法提纯来循环利用。

图1 废锂电池拆解流程及浸出装置图Fig.1 Chart of disassembly process and leaching equipment of spent lithium ion battery
将正极活性黑色粉末以一定的固液比(正极活性材料质量与酒石酸溶液体积比值)加入到盛有酒石酸的圆底烧瓶中,通过集热式恒温磁力搅拌器来控制搅拌速度、浸出温度和浸出时间来进行浸出实验。 实验过程中,通过加入冷凝回流装置来防止加热过程中溶剂的挥发和损失。 实验完成后对反应溶液进行真空抽滤即得浸出液。
1.3 浸出液的光谱表征
以超纯水为参比液,分别测定酒石酸、浸出液、硫酸钴、硫酸锂在波长范围为 200~800 nm的紫外可见光谱图。
1.4 浸出液中钴、锂含量的测定
分别随机称取 0.301 3、0.304 8和 0.302 7 g的正极活性黑色粉末于3个烧杯中,以固液比为5 g·L-1加入盐酸,于通风橱下加热沸腾直至粉末不再溶解,此时正极活性材料LiCoO2中 Co3+被还原为溶于水的Co2+,视这种状态为正极活性黑色粉末完全溶解[8-10]。 将反应后的溶液进行抽滤,利用 ICP 分别测定3份浸出液中Co2+和 Li+的质量浓度 (mg·L-1),根据标准曲线方程
Co2+:I=311 891ρ-13 827,
(1)
Li+:I=30 000 000ρ-44 926,
(2)
式(1)~(2)中:I为物理量强度,这里指质量浓度的强度;ρ为质量浓度。由此可得出浸出液中Co2+、Li+的质量浓度。进而得到钴、锂在正极活性黑色粉末中的质量分数。 钴、锂在正极活性黑色粉末中的平均质量分数分别为 68.43% 和 6.23%。 浸出液中Co2+和 Li+的浸出率由(3)式计算可得

(3)
式(3)中,M指Co或Li。
2 实验结果与讨论
2.1 浸出液的光谱表征
以水为参比溶液,用紫外可见分光光度计在 200~800 nm 之间中对酒石酸溶液、硫酸锂标准溶液、硫酸钴标准溶液、酒石酸浸出液分别进行全波长扫描,得图2。

图2 酒石酸、硫酸锂、硫酸钴和浸出液的紫外可见谱图Fig.2 UV-Vis spectra of tartaric acid, lithium sulfate, cobalt sulfate and leachate
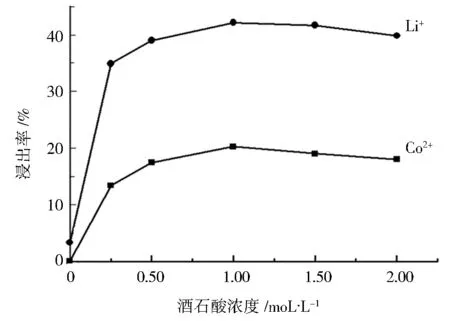
图 3 Co2+ 和 Li+浸出率与酒石酸浓度的关系Fig.3 Relationship between leaching efficiency ofCo2+ and Li+and tartaric acid concentration
图2中谱线 a、b、c 和 d 分别对应1 mol·L-1酒石酸溶液、0.3 mol·L-1硫酸锂标准溶液、0.03 mol·L-1硫酸钴标准溶液、酒石酸浸出液(浸出条件分别为:1 mol·L-1酒石酸溶液,固液比为5 g·L-1,浸出温度为60 ℃,反应时间为 90 min,搅拌速度为 30 r·min-1)的扫描谱图。 从谱线 a 中可以观察到在波长 230 nm 左右有一个明显的吸收峰,说明酒石酸在紫外区 230 nm 左右产生吸收。 谱线 b 在紫外可见区未观察到吸收峰,说明硫酸根和锂离子在这个区间没有吸收。 从谱线 c 中可以观察到在 514 nm 处有最大吸收峰,应对应于硫酸钴中钴离子所产生的吸收。 从谱线 d 中可以观察到在 514 nm 和 230 nm 处有两个特征吸收峰,应分别对应酒石酸根和钴离子的吸收。 说明废旧锂离子电池中 LiCoO2正极活性材料与酒石酸溶液反应,浸出液中有二价钴离子生成,酒石酸的结构没有改变。 由于 LiCoO2正极活性材料中锂元素在溶液中是可溶的,因此可推断浸出液中同时有锂离子生成。
2.2 单因素实验
2.2.1 酒石酸浓度对Co2+、Li+浸出率的影响
图 3 是不同酒石酸浓度对Co2+、Li+浸出率的影响关系曲线,其中固定浸出温度为60 ℃,固液比为 5 g·L-1,搅拌速度为 30 r·min-1,反应时间为 90 min,考察酒石酸浓度分别为 0、0.25、0.50、1.00、1.50、2.00 mol·L-1时对Co2+、Li+浸出效果的影响。
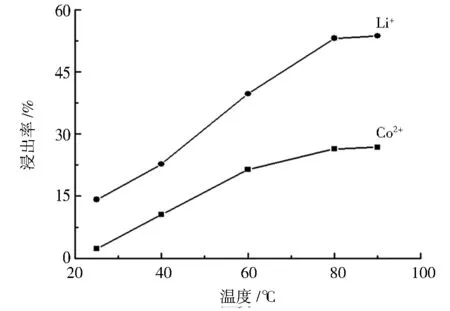
图4 Co2+ 和 Li+浸出率与浸出温度的关系Fig.4 Relationship between leaching efficiency ofCo2+ and Li+and leaching temperature
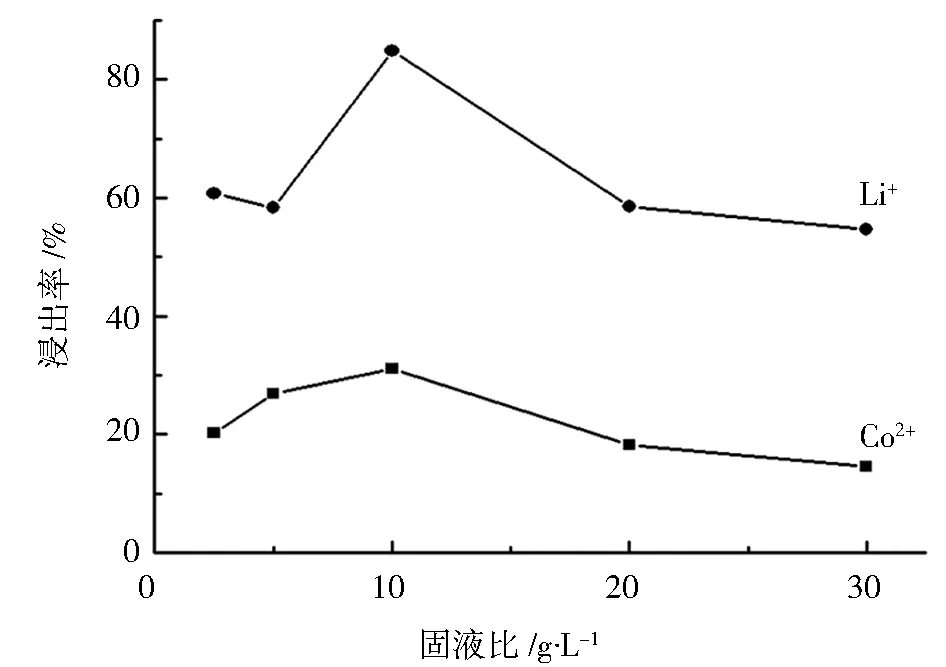
图5 Co2+ 和 Li+浸出率与固液比的关系Fig.5 Relationship between leaching efficiency ofCo2+ and Li+and solid-liquid ratio
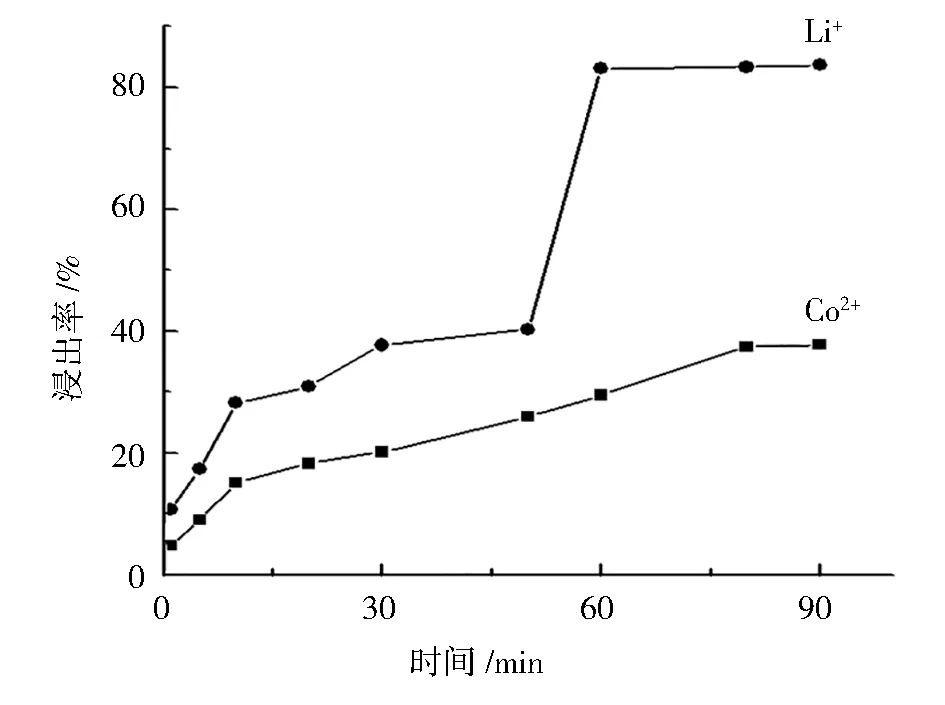
图6 Co2+ 和 Li+浸出率与反应时间的关系Fig.6 Relationship between leaching efficiency ofCo2+ and Li+and leaching time
由图3可见,在酒石酸浓度为1 mol·L-1时,Co2+和 Li+的浸出率最大,分别为 20.31% 和 42.27%,酒石酸浓度在 0.5~1 mol·L-1之间浸出率呈上升趋势,而超过 1 mol·L-1时Co2+和 Li+的浸出率均有不同程度的下降,分析原因可能是,当酒石酸浓度小于 1 mol·L-1时,反应物的化学反应起主导作用,而离子传输起辅助作用,而酒石酸浓度大于 1 mol·L-1时,溶液中离子传输速率下降,化学反应又没有明显增加,从而导致浸出率下降[11]。 所以选择 1 mol·L-1的酒石酸溶液为最佳浸出酸浓度。
2.2.2 浸出温度对Co2+、Li+浸出率的影响
图4是不同浸出温度对Co2+、Li+浸出率的影响关系曲线,其中固定酒石酸浓度为 1 mol·L-1,固液比为 5 g·L-1,搅拌速度为 30 r·min-1,反应时间为 90 min,探究反应温度分别为 25、40、60、80、90 ℃ 时对Co2+、Li+浸出率的影响。
从图 4 中可以看出,Co2+、Li+浸出率随温度的升高而提高,在 60~80 ℃ 之间浸出率进一步增加,在 80 ℃ 之后浸出率趋于平缓,此时,Co2+、Li+最大浸出率分别为 26.4% 和 53.1%。 原因可能是,酒石酸的解离是一个吸热的过程,温度升高导致酒石酸的电离度增加,加大反应的正向进行[12];当温度继续增加,使得酒石酸分解造成酸浓度减少,因而浸出率没有明显增加。 为了符合节能要求,确定 80 ℃ 为最佳浸出温度。
2.2.3 固液比对Co2+、Li+浸出率的影响
固定酒石酸浓度为 1 mol·L-1,浸出温度为 80 ℃,搅拌速度为 30 r·min-1,反应时间为90 min的条件下,探讨固液比依次为 2.5、5、10、20、30 g·L-1对Co2+、Li+浸出率的影响,所得关系曲线如图 5 所示,从图5中可以观察到在固液比为 10 g·L-1的条件下,Co2+和 Li+的浸出率均达到最大,分别为 31.0% 和 84.9%。 当固液比大于 10 g·L-1时,产物的浸出率不仅不再增加,随着固液比的增加反而呈现明显下降趋势,分析原因可能是固液比太大,导致反应物与浸出液的粘度增大,使得固液相中的传质速度下降[13]。 因此,选择 10 g·L-1为最佳反应固液比。
2.2.4 反应时间对Co2+、Li+浸出率的影响
Co2+和 Li+浸出率与反应时间的关系曲线见图6。针对不同反应时间对 Co2+、Li+浸出率做实验,其中固定温度为 80 ℃,搅拌速度为 30 r·min-1,酒石酸浓度为 1 mol·L-1,固液比为 10 g·L-1,分别探究反应时间为 1、5、10、20、30、50、60、80、90 min 时对 Co2+、Li+浸出效果的影响。实验结果显示:在实验的前60 min,随着反应时间增加浸出率迅速提升,60~80 min时,Co2+浸出率还有缓慢提升,而Li+浸出率提升已不明显,当反应进行到 80 min 时,Co2+、Li+的浸出率分别为 37.4% 和 83.4%,继续延长时间,Co2+、Li+浸出率都不再明显提高。因此,选择 80 min 为最佳反应时间。
3 结论
以可生物降解的酒石酸作为浸出剂,浸出废锂电池正极活性黑色粉末中的钴锂金属。 紫外可见分光光度法分析可得,废锂电池中LiCoO2正极活性材料在酒石酸溶液的强酸性作用下生成可溶性的Co2+和Li+。 当酒石酸浓度为1 mol·L-1、浸出温度为80 ℃、固液比为10 g·L-1、反应时间为80 min时,Co2+和 Li+的浸出率达到最大,分别为 37.4%、83.4%。 该结论对后续进一步提高钴锂金属浸出率时还原剂的选择和添加有一定的指导意义,对从废锂电池中绿色高效回收钴锂金属奠定了良好基础。

