LED光源红蓝光配比对生菜光合作用及能量利用效率的影响
王 君,仝宇欣,2,杨其长,2
LED光源红蓝光配比对生菜光合作用及能量利用效率的影响
王 君1,仝宇欣1,2※,杨其长1,2
(1. 中国农业科学院农业环境与可持续发展研究所,北京 100081;2. 农业部设施农业节能与废弃物处理重点实验室,北京 100081)
为了提高植物光能及电能利用效率,降低植物工厂光源的投入产出比,该文从不同红蓝光配比(R/B)对生菜光合作用影响机理入手,分析不同R/B对生菜光能及电能利用效率的影响。以荧光灯处理(FL)作为对照,通过设置不同红蓝光配比(R/B)共7个处理进行试验,测定不同R/B下生菜的RuBisCo羧化速率和氧化速率、光合电子流分配以及叶氮分配。结果表明:1)当R/B≥8时,增大蓝光比例显著降低了总电子传递速率向参与光呼吸的光合电子流的分配,促进了叶氮向羧化系统和生物能学系统中的投入,提高了叶片的光合作用;2)当R/B≤8时,生菜电能利用效率(electric-energy use efficiency, EUE)和光能利用效率(light use efficiency, LUE)随着R/B增加而显著增大,R/B≥8处理间EUE无显著性差异,但R/B=12处理下LUE较R/B=8处理高12.5%。综上所述,在光强为200mol/(m2·s) 的红蓝LED植物工厂中,R/B为8是影响生菜光合作用、光能及电能利用效率的转折点;为保证生菜高效生产,以红蓝光配比不小于8为宜。
光合作用;作物;光源;能量利用效率;红蓝光;光合电子流分配;叶氮分配
0 引 言
人工光植物工厂因其生产环境高度可控、周年连续稳定生产及产品安全可靠等诸多优势正在世界各国迅猛发展。为了提高经济效益,植物工厂栽培多以可食率高、生产周期较短的叶菜类植物或育苗等为主。而生菜作为植物工厂的一种适栽蔬菜,是目前植物工厂生产量最大的叶菜之一,由于其既可生食,又可烹饪,也是在世界各地最受欢迎的一种叶菜。据联合国粮农组织统计数据报道[1],2016年生菜和菊苣的世界生产量为26.8百万t,仅中国就高达14.9百万t。因此,生菜作为人工光植物工厂的生产对象具有较好的市场前景。
人工光植物工厂叶菜生产中应用最多的光源为荧光灯和LED,而LED作为一种电光转换效率高、散热量低、寿命长、环境友好型人工光源[2],被认为是叶菜生产最有前途的光源,正广泛应用于人工光植物生产系统中[3]。红光和蓝光作为叶绿素吸收最多的光,较其他光质能更有效地促进植物叶片的光合作用[4]。因此,很多LED光源以荧光粉激发或芯片的形式集成红蓝光作为植物生长的光源。截至目前,已经有大量关于红蓝光对植物生长[5-6]、生理[7-8]及品质[9-10]等影响的研究报道,绝大多数研究结果表明红蓝混合光比纯红光或蓝光更有利于植物生长发育和品质提升。其中,有关红蓝光对生菜影响的文章也已经很多,但红蓝光对生菜光合作用的影响机理还有待进一步研究。因此,本文从RuBisCo羧化速率和氧化速率、光合电子流分配及叶氮分配等层面定量分析不同红蓝光配比对生菜叶片光合作用的影响,进而揭示不同红蓝光配比对光能及电能利用效率的影响,为LED植物工厂中生菜节能高效生产提供理论支撑。
1 材料与方法
1.1 试验设计
以奶油生菜(L.)作为栽培对象,蛭石:草炭=3∶1(V/V)的混合物作为育苗基质,荧光灯作为育苗光源,其光强为150mol/(m2·s) 。当第2片叶完全展开后,选择长势一致的幼苗进行随意分配,定植到7套完全相同的水培系统中。试验处理中,采用波峰为657 nm的红光(R)和波峰为450 nm的蓝光(B)结合的LED光源,试验处理分别表述为R、R/B=12、R/B=8、R/B=4、R/B=1和B,光谱详见图1,以荧光灯处理(FL, R/B/G=1.2∶1.0∶1.3, G为绿光)作为对照。试验期间,光强和光周期分别为200mol/(m2·s)和16 h/d;明期和暗期空气温度分别为24和20 ℃,相对湿度为60%,CO2浓度为400mol/mol;采用日本山崎营养液配方,pH≈5.8,EC≈1.5 mS/cm。生菜定植30 d后收获,该试验重复进行2次。

注:R和B分别代表红光处理和蓝光处理;R/B代表某一特定比例红光与蓝光的处理;FL代表荧光灯处理。下同。
1.2 试验仪器及测量方法
光源耗电量采用北电仪表(PowerBay-SSM,精度:0.1W,中国)测得。光强和光谱分别通过Li-1500(Li-Cor, Lincoln, NE, USA)和USB 200 spectrometer(Ocean Optics, Dunedin, FL, USA)测得。
植物叶片中氮浓度利用元素分析仪(Isoprime GC5, Italy)采用杜马斯燃烧法进行测定[11]。
CO2响应曲线采用便携式光合仪(Li-6400, Li-Cor, Lincoln, NE, USA)对自上而下完全展开的第2片叶进行测定。CO2响应曲线测定过程中,起始CO2浓度设定为400mol/mol,之后分别为200、150、100、50、400、400、600、800和1200mol/mol。采用10%蓝光和90%红光的LED光源,光强为200mol/(m2·s)。叶室温度为24 ℃,饱和空气压差为1.1 kPa。当光合速率(photosynthetic rate,P)达到稳态时记录数据。每个处理选择一个样品进行测定,测定顺序为R、R/B=12、R/B=8、R/B=4、R/B=1、B和FL,然后再重复此过程2次。利用CO2响应曲线拟合最大羧化速率(maximum RuBisCo carboxylation rate,cmax)和最大电子传递速率(maximum electron transport rate,max)。
1.3 计算方法
RuBisCo氧化速率(RuBisCo oxidation rate,V)、羧化速率(RuBisCo carboxylation rate,V)及氧化速率与羧化速率之比(ratio of RuBisCo oxidation rate and carboxylation rate,)的计算方法见式(1)-(5)[12-13]。
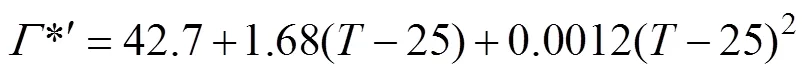




式中为大气压下CO2补偿点,mol/mol;为没有暗呼吸时的CO2补偿点,mol/mol;为外界大气压,100.8 kPa;为羧化部位的CO2浓度,取值为0.6C[13],C为植物工厂内CO2浓度,mol/mol;为空气温度,℃;R为暗呼吸速率mol/(m2s),详见参考文献[14]。
参与光呼吸的光合电子流(Partitioning of electron flow to photorespiration, J)的计算方法见式(6)[15]。
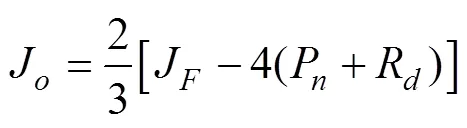
总电子传递速率(J)的计算方法见式(7)[16]。

式中PSII为实际光化学量子效率(此数据见参考文献[14]);PAR为植物群体冠层处光照强度,200mol/(m2·s);PSII为PSII吸收光能所占的比率,取0.5;а为叶片光能吸收率,取0.84[17]。
P为叶氮在羧化系统(主要是在RuBisCo中)的分配系数;P为叶氮在生物能学组分(即光合电子传递和光合磷酸化组分)中的分配系数;P为叶氮在捕光色素蛋白复合体中的分配系数。photo为叶氮在光合机构中的分配系数。计算方法见式(8)-(11)[18-19]。


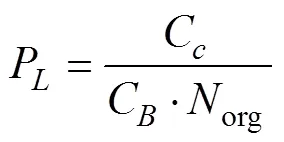

式中org为单位叶面积下有机氮含量,g/m2。cr、mc和C分别代表单位RuBisCo蛋白的CO2固定活性(叶温为25 ℃时为20.78mol/(g·s)[20])、细胞色素f的最大电子传递速率(叶温为25 ℃时为155.65mol/(mol·s)[21])和结合在PSI、PSII和LCHII中的叶绿素(取值5.79 mmol/g[22]);C为叶绿素浓度,mmol/g;6.25为氮转换成蛋白的系数[18],g/g;8.06为氮素与细胞色素f之间的转换系数[21],mol /g。


式中acq为光合机构中叶氮用于光捕获的比例;uti为光合机构中叶氮用于光利用的比例[23]。
电能利用效率(electric-energy use efficiency, EUE, %)是累积地上干物质量的化学能与光源消耗电能的比值[24]。

光能利用效率(light use efficiency, LUE, %)是累积地上干物质量的化学能与植物群体冠层处接收累积光能的比值[24]。

式中PAR为植物群体冠层处接收的累积光能,J/m2。
1.4 数据统计与分析
采用Excel进行数据整理,利用SAS 9.1(SAS Institute Inc. 9.1, Cary, NC, USA)软件对数据进行显著性分析,采用邓肯氏多重比较,显著水平≤0.05。
2 结果与分析
2.1 不同红蓝光配比对RuBisCo羧化速率和氧化速率的影响
对于R/B≥8的处理,V和V随着R/B减小而显著增大(图2a),而R/B≤8的处理,除FL处理显著最低外,其他各处理之间均无显著性差异。与参考文献[14]中P随R/B变化的趋势相反,在R处理下最大(图2b)。对于R/B≥8的处理,随着R/B减小V和V增加,而减小的结果表明,R/B减小对V的增加效果要高于V。对于V和V,FL处理与R/B=12处理之间无显著差异。

注:图中误差线为标准误差,不同大写和小写字母表示处理间在 0.05 水平上差异显著。下同。
2.2 不同红蓝光配比对光合电子流分配的影响
图3为不同红蓝光配比对光合电子流分配的影响。从图3可以看出,对于R/B≥8的处理,J和J/J随着R/B减小而显著减小,在R处理下最大。因此,在纯红光基础上适当增加蓝光可以有效地降低光合电子传递速率向参与光呼吸的光合电子流的分配,提高叶片光合作用。而对于R/B≤8的处理,除FL处理下显著最大外,其他各处理间J和J/J均无显著性差异。J和J/J随R/B变化的趋势一致(图3),均与参考文献[14]中P随R/B变化的趋势相反。对于J和J/J,FL处理与R/B=12处理之间没有显著性差异。

图3 不同红蓝光配比对光合电子流分配的影响
2.3 不同红蓝光配比对叶氮分配的影响
表1为不同红蓝光配比对叶氮分配的影响。除FL处理下单位面积有机氮含量最低外,其他不同R/B处理并没有对其产生显著影响。荧光灯中绿光成分可能是造成FL处理下单位面积有机氮含量降低的原因。但不同R/B对叶氮在光合器官中的分配产生了影响。对于P和P,R/B=12处理显著高于R处理(表1),与R/B≥8时V随R/B减小而增加(图2)和J/J随R/B减小而减小(图3)的结果相呼应。R处理下更多叶氮用于光捕获,而B处理下叶片表现完全相反,更多叶氮用于光利用。尽管FL处理的荧光灯中蓝光的存在引起有机氮在光合器官中的分配系数显著高于R处理,但由于其含有的绿光成分不易被叶片吸收,导致该处理下叶片同样表现出更多叶氮用于光捕获。

表1 不同红蓝光配比对叶氮分配的影响
注:同一行不同小写字母表示处理间在0.05水平上差异显著。
Notes: Different lowercase letters in each row indicate significant differences at the level of 0.05.
2.4 不同红蓝光配比对光能及电能利用效率的影响
EUE和LUE是衡量植物对人工光源所消耗电能和冠层处接收光能利用程度的重要指标[24]。当R/B≤8时,叶面积指数(leaf area index, LAI)随着R/B增加而增加。 EUE和LUE均与LAI呈正相关关系,具有较高的拟合系数,且LUE随LAI增大而增加的速度要远大于EUE,在该拟合结果中不包含FL处理下数据。R/B=12处理下EUE和LUE均达到最大(表2),但R/B=8、R/B=12和R处理间EUE不存在显著性差异。并且R和R/B=12处理之间LUE亦无显著差异,但后者较R/B=8处理下LUE高12.5%。尽管FL处理下生菜具有较高的LAI,但EUE最小,显著低于红蓝单色光或混合光处理;LUE仅显著大于B处理。
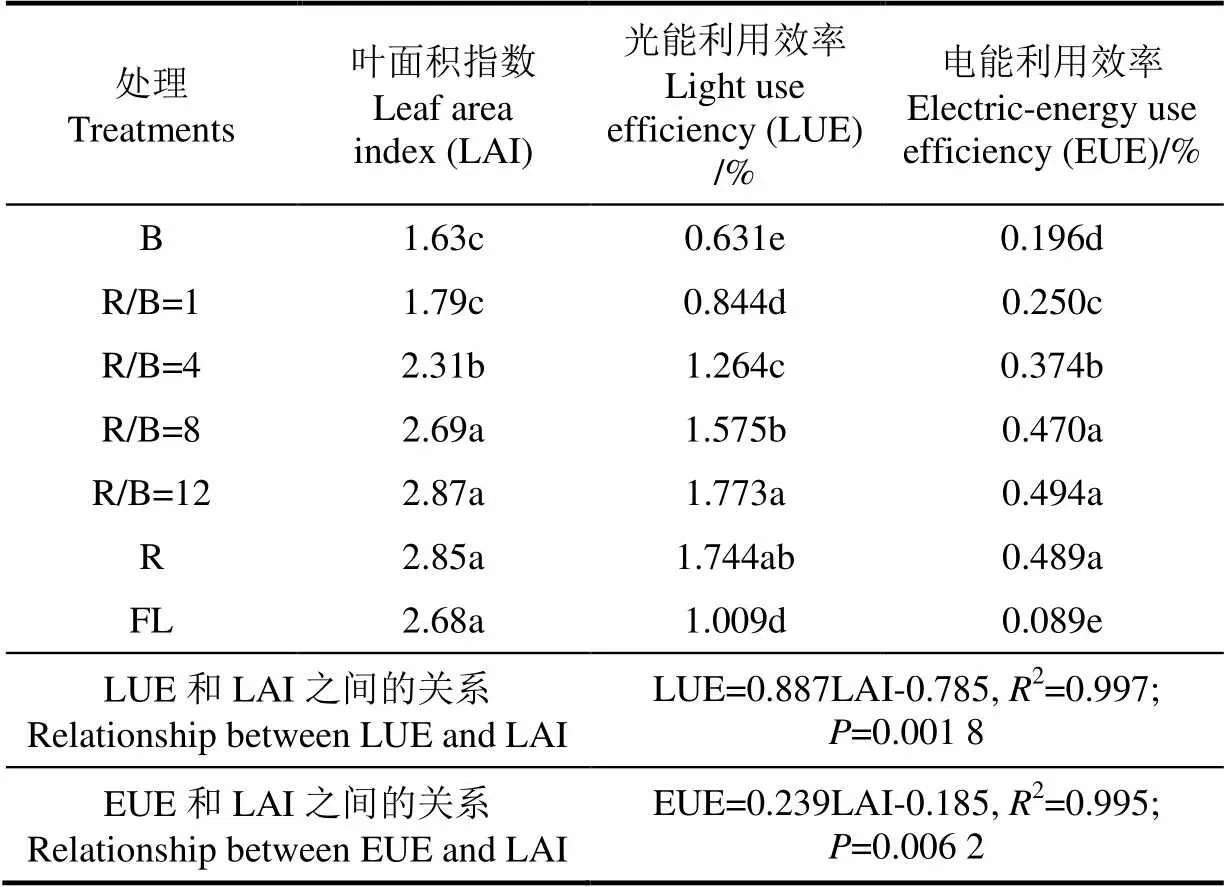
表2 不同红蓝光配比对能量利用效率和叶面积指数的影响
注:能量利用效率与叶面积指数的拟合关系中不包含FL处理下数据。同一列不同小写字母表示处理间在0.05水平上差异显著。
Note: The relationships between energy use efficiency and leaf area index were not related to data under FL treatment; Different lowercase letters in each column indicated significant differences at the level of 0.05.
3 讨 论
本文从RuBisCo羧化速率和氧化速率、光合电子流分配以及叶氮分配等层面揭示不同R/B对生菜叶片光合作用的影响,并进一步阐述不同R/B对生菜光能及电能利用效率的影响。
3.1 R/B≥8对生菜叶片光合作用的影响
RuBisCo羧化能力是影响植物叶片光合作用高低的主要因子之一。对于R/B≥8的处理,减小R/B同时提高了RuBisCo羧化速率和氧化速率,且对羧化速率的增加效果要大于对氧化速率的影响(图2),从而提高了光合作用。
光合电子流主要用于碳同化和光呼吸,但在二者之间的分配较为复杂,会受到环境因素的影响[25]。当R/B≥8时,参与光呼吸的光合电子流随着R/B增加而显著增加,且占总电子传递速率的比例亦随着R/B增加而显著增加(图3),表明光质是调控光合电子流在碳同化和光呼吸分配比例的重要环境因子;并且,在红光背景下,加入少量蓝光即可有效地减少参与光呼吸的光合电子流及占总电子传递速率的比例,从而增加了碳同化的光合电子流,进一步提高了光合作用。
叶氮含量与光合能力有很强的正相关性[17]。本试验结果中各处理间单位面积有机氮含量无显著差异的结果表明,有机氮含量并不是限制红蓝混合光处理下叶片光合作用差异的原因。植物调控叶氮分配到光合器官的能力在一定程度上能够解释其对不同R/B的适应机制。在本试验中,对于P、P和photo,R/B=12处理下叶片均显著高于R处理(表1),即红光背景下加入蓝光会提高叶氮向羧化系统和生物能学系统的投入,从而促进光合作用。P随着R/B减小而增加的结果与张亚杰等[26]发现的在低光强下P随着光强增加而增加的结果类似,因此,随着R/B减小植株可能表现出阳生植物特性。
3.2 R/B≤8对生菜叶片光合作用的影响
对于Chl[14]、Chla/b[14]、、P、P、P和photo,除了FL处理外,R/B≤8的处理之间均不存在显著差异,与R/B≤8的处理之间光合作用无显著差异(R/B=1处理除外)的结果一致。以上试验结果表明,当光强为200mol/(m2·s) 时,在红光基础上加入11%的蓝光即可显著提高叶片光合作用,继续增大蓝光比例对于提高生菜叶片光合作用的效果不明显。
在R和B处理间单位面积有机氮含量无显著差异的情况下,B处理下生菜投入更多叶氮用于光利用,而R处理下生菜投入更多叶氮用于光捕获(表1),可以解释蓝光比红光更有利于提高叶片光合作用。Munner等[27]也发现蓝光处理下生菜叶片较红光处理表现出显著较高的P,类似的结果还发现在黄瓜苗[28]、玉米[29]和水稻[30]上。
对于FL处理,其光源光谱组分为R/B/G=1.2∶1.0∶1.3,尽管与R/B=1处理的R/B值比较接近,但由于荧光灯中包含大量的绿光成分,会减小气孔导度,以及与光合作用密切相关的叶氮含量(表1),限制蓝光对光合作用的促进作用,造成P(FL处理下为7.2mol/(m2·s))与R/B=1处理[14]相比有所降低。FL处理与R/B=12处理下P最为接近[14],可以从两处理下叶片V(图2)、光合电子流分配(图3)以及叶氮分配(表1)无显著性差异进行解释。
3.3 不同红蓝光配比对生菜光能及电能利用效率的影响
在相同光强下,对于红蓝混合光处理,随着R/B增加而增大的LAI抵消了减小的P[14](B处理除外)所造成的不利影响,从而增加了植物冠层截获的光合有效辐射,进而提高了光能及电能利用效率(表2)。
FL处理下V低于R/B≤1处理(图2),J高于R/B≤1处理(图3)的结果表明,FL处理下叶片表现出光合性能不如R/B≤1处理。尽管叶片吸收的绿光对于驱动光合作用没有蓝光有效,但LUE却显著大于B处理,其原因为FL处理下生菜表现出更为松散的生长结构,较B和R/B=1处理LAI分别提高了64.4%和49.9%,故而截获的光合有效辐射也随之增加。由于荧光灯的电光转换效率显著低于LED[3],故FL处理下EUE最低(表2)。
4 结 论
针对人工光植物工厂即使采用节能的红蓝LED作为植物生长光源,仍然存在光源电能消耗较高的问题,本文通过研究不同红蓝光配比对生菜光合作用、光能及电能利用效率的影响,在光强为200mol/(m2·s)下,得出以下结论:
1)R/B=8是影响生菜光合作用、电能及光能利用效率的转折点;当R/B≥8时,不同R/B对电能利用效率没有显著影响,且R/B≥8处理下生菜电能利用效率显著大于R/B<8的处理。故为保证生菜节能高效生产,红蓝光配比以不小于8为宜;
2)当R/B≥8时,减小R/B可以有效提高叶氮向羧化系统和生物能学组分的分配,以及RuBisCo羧化效率,从而提高单个叶片的光合作用。
虽然单个叶片在一定程度上可以反映光质对光合作用的影响,但仍需对植株整体的光合能力进行研究,才能对工厂化生产具有实际的应用价值。
[1] Food and Agriculture Organization of the United Nations. Value of Agricultural Production[EB/OL]. (2018-05-28) [2018-05-30]. http://www.fao.org/faostat/en/#data/QC
[2] Bourget C M. An introduction to light-emitting diodes[J]. HortScience, 2008, 43: 1944-1946.
[3] 刘文科,杨其长. LED植物光质生物学与植物工厂发展[J]. 科技导报,2014,32(10):25-28. Liu Wenke, Yang Qichang. Development status of plant photobiology with LED monochromatic light and plant factory[J]. Science & Technology Review, 2014, 32(10): 25-28. (in Chinese with English abstract)
[4] Pfündel E, Baake E. A quantitative description of fluorescence excitation spectra in intact bean leaves greened under intermittent light[J]. Photosynthesis Research, 1990, 26: 19-28.
[5] 闻婧,杨其长,魏灵玲,等. 不同红蓝LED组合光源对叶用莴苣光合特性和品质的影响及节能评价[J]. 园艺学报,2011,38(4):761-769. Wen Jing, Yang Qichang, Wei Lingling, et al. Influence of combined lighting with different red and blue LED on photosynthetic characteristics and quality of lettuce and evaluation of energy consumption[J]. Acta Horticulturae Sinica, 2011, 38(4): 761-769. (in Chinese with English abstract)
[6] 余意,杨其长,刘文科. LED红蓝光质对三种蔬菜苗期生长和光合色素含量的影响[J]. 照明工程学报,2015,26(4):107-110. Yu Yi, Yang Qichang, Liu Wenke. Effects of LED red and blue light ratio on growth photosynthetic pigment contents of pea, cucumber and tomato seedlings[J]. China Illuminating Engineering Journal, 2015, 26(4): 107-110. (in Chinese with English abstract)
[7] Kim S J, Hahn E J, Heo J W, et al. Effects of LEDs on net photosynthetic rate, growth and leaf stomata of chrysanthemum plantlets in vitro[J]. Scientia Horticulturae, 2004, 101(1-2): 143-151.
[8] Lee S H, Tewari R K, Hahn E J, et al. Photon flux density and light quality induce changes in growth, stomatal development, photosynthesis and transpiration of(L.) Dunal. plantlets[J]. Plant Cell, Tissue and Organ Culture, 2007, 90(2): 141-151.
[9] 刘文科,杨其长,邱志平,等. LED光质对豌豆苗生长, 光合色素和营养品质的影响[J]. 中国农业气象,2012,33(4):500-504. Liu Wenke, Yang Qichang, Qiu Zhiping, et al. Effects of LED light quality on growth, photosynthetic pigments and nutritional quality of pea seedling[J]. Chinese Journal of Agrometeorology, 2012, 33(4): 500-504. (in Chinese with English abstract)
[10] Bian Z H, Yang Q C, Liu W K. Effects of light quality on the accumulation of phytochemicals in vegetables produced in controlled environments: a review[J]. Journal of the Science of Food and Agriculture, 2015, 95(5): 869-877.
[11] 范志影,周陈维. 杜马斯燃烧定氮法在农产品品质检测中的应用[J]. 现代科学仪器,2006,16(1):45-46. Fan Zhongying, Zhou Chenwei. Application of Dumas combustion method for nitrogen analysis on agricultural products[J]. Modern Scientific Instruments, 2006, 16(1): 45-46. (in Chinese with English abstract)
[12] Sharkey T D. Estimating the rate of photorespiration in leaves[J]. Physiologia Plantarum, 1988, 73(1): 147-152.
[13] 孙谷畴, 林植芳, 林桂珠. 不同光强下生长的几种亚热带森林树木的 Rubisco 羧化速率和碳酸酐酶的活性[J]. 植物科学学报, 2001, 19(4): 304-310.
Sun Guchou, Lin Zhifang, Lin Guizhu. The carboxylation rate of Rubisco and activity of carbonic anhydrase in Plants from a subtropical forest grown at different light intensity[J]. Journal of Wuhan Botanical Research, 2001, 19(4): 304-310. (in Chinese with English abstract)
[14] Wang J, Lu W, Tong Y X, et al. Leaf morphology, photosynthetic performance, chlorophyll fluorescence, stomatal development of lettuce (L.) exposed to different ratios of red light to blue light[J]. Frontiers in Plant Science, 2016, 7: 250.
[15] Epron D, Godard D, Cornic G, et al. Limitation of net CO2assimilation rate by internal resistances to CO2transfer in the leaves of two tree species (L. andMill.)[J]. Plant, Cell & Environment, 1995, 18(1): 43-51.
[16] Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 1989, 990(1): 87-92.
[17] Evans J R. Photosynthesis and nitrogen relationships in leaves of C3plants[J]. Oecologia, 1989, 78(1): 9-19.
[18] Niinemets Ü, Tenhunen J D. A model separating leaf structural and physiological effects on carbon gain along light gradients for the shade-tolerant species Acer saccharum[J]. Plant, Cell & Environment, 1997, 20(7): 845-866.
[19] Niinemets Ü, Kull O, Tenhunen J D. An analysis of light effects on foliar morphology, physiology, and light interception in temperate deciduous woody species of contrasting shade tolerance[J]. Tree Physiology, 1998, 18(10): 681-696.
[20] Jordan D B, Ogren W L. The CO2/O2specificity of ribulose 1, 5-bisphosphate carboxylase/oxygenase[J]. Planta, 1984, 161 (4): 308-313.
[21] Nolan W G, Smillie R M. Multi-temperature effects on Hill reaction activity of barley chloroplasts[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1976, 440(3): 461-475.
[22] Hikosaka K, Terashima I. A model of the acclimation of photosynthesis in the leaves of C3plants to sun and shade with respect to nitrogen use[J]. Plant, Cell & Environment, 1995, 18(6): 605-618.
[23] Trouwborst G. On the Photosynthetic Response of Crops to Intracanopy Lighting with Light Emitting Diodes[D]. Wageningen: Wageningen University, 2011.
[24] Kozai T. Resource use efficiency of closed plant production system with artificial light: Concept, estimation and application to plant factory[J]. Proceedings of the Japan Academy, Series B, 2013, 89(10): 447-461.
[25] Logan B A, Demmig-Adams B, Adams III W W, et al. Antioxidants and xanthophyll cycle-dependent energy dissipation inL. andL. acclimated to four growth PPFDs in the field[J]. Journal of Experimental Botany, 1998, 49(328): 1869-1879.
[26] 张亚杰,冯玉龙. 不同光强下生长的两种榕树叶片光合能力与比叶重、氮含量及分配的关系[J].植物生理与分子生物学学报,2004,30(3):269-276. Zhang Yajie, Feng Yulong. The relationships between photosynthetic capacity and lamina mass per unit area, nitrogen concentration and partitioning in seedling of two ficu species grown under different irradiance[J]. Journal of Plant Physiology and Molecular Biology, 2004, 30(3): 269-276. (in Chinese with English abstract)
[27] Muneer S, Kim E J, Park J S, et al. Influence of green, red and blue light emitting diodes on multiprotein complex proteins and photosynthetic activity under different light intensities in lettuce leaves (L.) [J]. International Journal of Molecular Sciences, 2014, 15(3): 4657-4670.
[28] Hogewoning S W, Trouwborst G, Maljaars H, et al. Blue light dose-responses of leaf photosynthesis, morphology, and chemical composition ofgrown under different combinations of red and blue light[J]. Journal of Experimental Botany, 2010, 61: 3107-3117.
[29] Yano A, Fujiwara K. Plant lighting system with five wavelength-band light-emitting diodes providing photon flux density and mixing ratio control[J]. Plant Methods, 2012, 8: 46.
[30] Matsuda R, Ohashi-Kaneko K, Fujiwara K, et al. Photosynthetic characteristics of rice leaves grown under red light with or without supplemental blue light[J]. Plant Cell Physiology, 2004, 45: 1870-1874.
Effect of LED light with different ratios of red to blue light on photosynthesis and energy use efficiency for lettuce
Wang Jun1, Tong Yuxin1,2※, Yang Qichang1,2
(1.,,100081,; 2.,,100081,)
Compared with traditional plant production systems, the advantage of plant factory with LED (light emitting diode) lighting for plant production is annually planned plant production with high quality/quantity and less energy consumption. However, commercial promotion of plant factory with artificial lighting is still limited since LED is used as the sole light source for plant growth and the operation cost is quite high. To reduce the operation cost of the plant factory with artificial lighting, improving electric-energy use efficiency (EUE) and/or light use efficiency (LUE) by optimizing the ratio of red to blue light (R/B) was considered as a feasible way since the red and blue light are mainly absorbed by photosynthetic pigments and more effective for plant production than other wavelengths. In this study, the effects of different R/B on EUE and LUE were revealed by investigating the effects of different R/B on photosynthesis from the aspects of Rubisco carboxylation rate, partitioning of electron flow and leaf nitrogen in photosynthetic apparatus. In this experiment, lettuce plants (L.) were exposed to 200mol/(m2·s) irradiance for a 16 h/d photoperiod under the following 7 treatments: monochromatic red light (R, peak wavelength: 657 nm), monochromatic blue light (B, peak wavelength: 450 nm) and mixture of R and B with different R/B of 12, 8, 4, and 1, fluorescent lamps (FL, R/B/G=1.2:1.0:1.3, G was green light). Lettuce plants under FL treatment were set as the control. The results showed that: 1) Decreasing R/B until 8 significantly decreased the partitioning of electron flow to photorespiration and increased the partitioning of leaf nitrogen in carboxylation and bioenergetics system, resulting in increasing photosynthesisamong the treatments with R/B of higher than 8. 2) No significant differences were found in Rubisco carboxylation rate, the partitioning of electron flow and leaf nitrogen in photosynthetic apparatus among the treatments with R/B of lower than 8, except FL treatment. 3) EUE and LUE both increased with R/B increasing until up to 12 with the maximum values of 0.494% and 1.773%, respectively; there were no significant differences for EUE among the treatments with R/B of higher than 8; however, LUE under the treatment with R/B of 12 was 12.5% higher than that under the treatment with R/B of 8. Although photosynthesis decreased with the increasing of R/B until 8, leaf area index (LAI) increased with the increasing of R/B until 8. Increase in LAI offset the negative effect of increasing R/B on the leaf photosynthesis, resulting in capturing much more photosynthetic active radiation. 4) Leaf photosynthetic performance under FL treatment was the nearest to that under the treatment with the R/B of 12, which could be explained from the aspects of no significant differences between 2 treatments in Rubisco carboxylation rate, the partitioning of electron flow and leaf nitrogen in photosynthetic apparatus; however, although lettuce plants under FL treatment had high LAI, EUE was the lowest among all the treatments because of the lowest electro-optical conversion efficiency of fluorescent lamp. Based on the above results, R/B of 8 is the turning point for photosynthesis and EUE; it is concluded that R/B of lower than 8 is suitable for energy-saving and high-efficient production when lettuce plants are exposed to the combination of red light and blue light with light intensity of 200mol/(m2·s) in plant factory with LED lighting.
photosynthesis; crops; light source; energy use efficiency; red and blue light; partitioning of electron flow; partitioning of leaf nitrogen
王 君,仝宇欣,杨其长. LED光源红蓝光配比对生菜光合作用及能量利用效率的影响[J]. 农业工程学报,2018,34(14):234-240.doi:10.11975/j.issn.1002-6819.2018.14.030 http://www.tcsae.org
Wang Jun, Tong Yuxin, Yang Qichang. Effect of LED light with different ratios of red to blue light on photosynthesis and energy use efficiency for lettuce[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(14): 234-240. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.14.030 http://www.tcsae.org
2018-02-05
2018-05-30
用于设施农业生产的LED关键技术研发与应用示范(2017YFB0403900)和科技部科技伙伴计划资助(KY201702008)联合资助
王 君,博士,主要从事设施农业环境工程方面的研究。Email:wangjun112209@163.com
仝宇欣,博士,副研究员,主要从事设施园艺环境工程方面的研究。Email:tongyuxin@caas.cn
10.11975/j.issn.1002-6819.2018.14.030
S625.5
A
1002-6819(2018)-14-0234-07

