降解浓香型白酒中氨基甲酸乙酯菌株的筛选及产酶特性研究
丁霞, 李巧玉,刘凡,曾伟主,陈坚, 堵国成, 方芳*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122) 3(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122) 4(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
氨基甲酸乙酯(ethyl carbamate,EC),是在发酵食品中检出的一种致癌物质[1]。2007年,世界卫生组织国际癌症研究机构(IARC)将EC正式归类为2A类致癌物质[2]。酒精饮料中含有EC对食用消费者健康的危害最大。同从发酵食品摄入EC相比,如果人类饮用一定量的酒精饮料,人类患癌的概率会大大增加[3],因此,发酵食品及酒精饮料中含有的EC对人体构成的危害不容小觑,应采取有效措施进行控制和减少[4]。
白酒是中国传统的饮料酒,主要以大米、小麦、高粱、玉米和糯米为原料,以酒曲为发酵剂,经过发酵、蒸馏、贮存、勾兑等过程制成[5]。在酒精饮料中,尿素作为EC的前体物质之一,会直接影响EC的含量。尿素一部分由原料本身带入,一部分由酵母分解精氨酸代谢生成[6]。因此,去除尿素可以达到减少EC的目的。由于白酒特殊的生产工艺以及复杂的体系,使得能够降解白酒中EC和尿素的水解酶与一般的脲酶相比,必须能够耐受酸性环境和具备一定的乙醇耐受性,才可以去除白酒中的尿素,从而减少EC的含量[7-8]。现如今,去除酒精饮料中EC主要从控制生产工艺、改造生产菌尿素代谢途径、添加酸性脲酶减少尿素、添加EC降解酶等几个方面。而应用生物酶法在降低饮料酒中尿素的同时,还能保证食品的安全性,是一种具有潜在应用价值的策略。脲酶(Urease),可催化水解尿素,生成二氧化碳、水和氨[6]。从20世纪80年代末就有学者对酸性脲酶展开研究[9-10]。1976年,酸性脲酶首次在小鼠的胃肠道中发现。目前,已经有多种产酸性脲酶的菌株被分离出来,对它们酶学性质做了一些研究[11-12],同时对去除发酵酒中尿素进行研究,尿素去除效果显著。根据现有报道,脲酶已成功应用于黄酒,葡萄酒和清酒中[13],但脲酶价格昂贵,国内酸性脲酶还未形成生产规模,而能够投入到白酒中降解EC且对白酒风味影响较小的酶的相关报道较少。
综上所述,研究能够降解白酒中尿素及EC的菌株,对于保证白酒的安全性具有一定的意义。本研究从浓香型白酒酒醅中分离得到1株能同时降解EC和尿素的菌株,并进行模拟窖内发酵,考察该菌株在白酒发酵体系中减少EC和尿素的能力,并对所产降解EC和尿素的水解酶进行分离纯化以及酶学性质研究,为该菌株在降低酒精饮料等发酵食品中EC的应用提供一定的理论基础。
1 材料和方法
1.1 材料
1.1.1 酒醅
洋河浓香型白酒入窖酒醅,采自江苏洋河酒厂股份有限公司。
1.1.2 培养基
MRS分离培养基:蛋白胨10 g/L,牛肉粉5 g/L,酵母粉4 g/L,葡萄糖20 g/L,吐温80 1 mL,K2HPO42 g/L,乙酸钠5 g/L,柠檬酸三胺2 g/L,MnSO40.05 g/L,MgSO40.2 g/L,纳他霉素100 mg/L ,115 ℃灭菌15 min。
LB分离培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,纳他霉素100 mg/L ,121 ℃灭菌15 min。
筛选培养基:用于筛选产脲酶或者氨基甲酸乙酯水解酶的菌株。配方为于LB培养基中添加3 g/L的尿素或者3 g/L氨基甲酸乙酯,并加入6 mg/L的溴甲酚紫。
1.2 主要试剂和仪器设备
尿素:上海生工;氨基甲酸乙酯,D5-氨基甲酸乙酯,9-羟基占顿醇:Sigma公司;无水乙酸钠,正己烷:国药集团;氮吹仪:上海比朗仪器有限公司;Sonics超声破碎仪:南京新辰生物科技有限公司;Qpix420高通量筛选系统:美国Molecular Devices公司;PCR仪:美国Bio-Rad公司;酶标仪:美国Thermo Fisher 公司;气相色谱质谱联用仪(GC/MS-QP2010):日本岛津公司。
1.3 方法
1.3.1 降解EC及尿素菌株的筛选
初筛:称取3 g酒醅于试管中,加入3 mL无菌生理盐水,于漩涡振荡器上充分振荡混匀,并稀释成合适倍数后取100 μL,涂布于分离培养基上,于30 ℃厌氧条件下培养数天。待平板上长出菌落后,运用Qpix420高通量筛选系统(美国Molecular Devices公司)挑取单菌落接种至装有筛选培养基的96深孔板中,30 ℃厌氧培养数小时。由于脲酶或EC水解酶能与相应底物反应产生氨,使溴甲酚紫由黄色变紫色,因此根据这一现象选取培养基颜色由黄色变成紫色的菌株作为初筛目的菌株。
复筛:将能使初筛阳性菌株接种至MRS培养基中培养至对数后期,取菌液于冷冻离心机中4 ℃条件下6 000 r/min离心15 min,收集菌体,并用20 mmol/L磷酸盐缓冲液(pH 7.0)洗涤菌体2次,离心收集菌体垂悬于20 mmol/L磷酸盐缓冲液(pH 7.0),超声破碎并离心取上清液获得粗酶。
1.3.2 脲酶和EC降解酶酶活测定
采用BERTHELOT REACTION比色法[8]。在比色管中加入200 μL酶液(以灭活的酶液为对照),再加入800 μL 40 g/L尿素或40 g/L EC溶液,37 ℃反应 20 min 后加入1.0 mL终止剂,振荡混匀后加入1.0 mL显色剂I和1.0 mL显色剂II,混匀后37 ℃保温20 min。反应液用超纯水定容至10 mL,在625 nm处检测吸光值。
终止剂:10 g三氯乙酸,超纯水定容至100 mL。
显色剂Ⅰ:15 g苯酚,0.625 g亚硝基铁氰化钠,超纯水定容至250 mL。
显色剂Ⅱ:13.125 g氢氧化钠,7.5 mL次氯酸钠,超纯水定容至250 mL。
酶活定义:在常压、35 ℃、pH 5.5的条件下,每分钟分解尿素或EC产生1 μmol铵离子的酶量为1个酶活单位U,如式(1)。
酶活/(U·mL-1)= ΔOD625×n×k/20
式中:20为反应时间,min;ΔOD625为样品与空白对照吸光值之差;k为标准曲线斜率的倒数;n为酶液稀释倍数。
1.3.3 菌株鉴定
基因组提取:将筛选的菌株接入MRS培养基中静置培养过夜,离心弃上清,收集菌体。使用细菌DNA提取试剂盒(美国Omega Bio-Tek公司)提取细菌基因组。
16S rDNA序列扩增(50 μL):2×TaqDNA 聚合酶25 μL,ddH2O 22 μL,上下游引物各1 μL(16S rDNA序列的引物为27F:5′- GAGTTTGATCMTGGCTCAG-3′和1492R:5′-TACGGYTACCTTGTTACG-3′),模板1 μL。PCR 扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR产物送至生工生物工程(上海)股份有限公司进行双向测序。将16S rDNA序列在National Center for Biotechnology Information (NCBI) GenBank数据库中进行BLAST比对,确定菌株的属种。
1.3.4 浓香型白酒窖内发酵
添加菌株用于降解白酒中EC及其前体尿素,是通过将菌株培养至对数后期,9 000 r/min离心20 min,并用生理盐水洗涤2次后重悬菌体,取20 mL不同菌浓的菌液添加到150 g入窖酒醅(加入入窖酒醅里的最终菌浓为107、108、109CFU/g),充分搅拌混匀,分装至三角瓶中,用发酵栓封口。以添加等体积的生理盐水的酒醅为对照,每个实验组3个平行,30 ℃厌氧条件下培养,分别于0、5、10、20、30、45、65、70 d取样。
1.3.5 尿素、EC的测定
尿素的测定:称取不同天数的窖内发酵酒醅10 g,加入10 mL超纯水,并于超声振荡器中超声均质15 min,将混合液于8 000 r/min离心10 min,取400 μL样品,加入600 μL 9-羟基占吨醇溶液和100 μL 0.1 moL/L盐酸溶液,混匀后避光反应30 min,再用0.22 μm有机系滤膜过滤后用于测定[7]。
色谱条件:色谱柱为Gemini-NX 5u C18(250 mm×4.6 mm);流速为1 mL/min;柱温为35 ℃;流动相A为0.02 moL/L乙酸钠溶液,流动相B为乙腈,流动相C为去离子水。
氨基甲酸乙酯的测定:采用内标法[14-15]。称取不同天数的窖内发酵酒醅10 g,加入10 mL超纯水,并于超声振荡器中超声均质15 min,将混合液于8 000 r/min离心10 min ,取2 mL样品,加100 μL 2 mg/L D5-氨基甲酸乙酯溶液,混匀后,加样到EC专用萃取柱上,将样品缓慢倒入萃取柱中,并静置15 min。随后用15 mL二氯甲烷溶液以约1 mL/min流速进行洗脱,室温下氮吹至0.5 mL,用甲醇定容至2.0 mL,混匀后过0.22 μm有机滤膜,过滤液供GC-MS检测[16]。
色谱条件:色谱柱为石英毛细管柱(J&W DB-WAX,30 m×0.25 mm,0.25 μm);进样量:1 μL;高纯氦气流速为1 mL/min。升温程序:起始温度50 ℃,维持1 min ,以8 ℃/min升温至180 ℃,再以25 ℃/min使温度升高为240 ℃,保持6 min。离子源温度为230 ℃,接口温度为220 ℃,激活电压为0.5 kV。
1.3.6 酒醅中挥发性风味物质检测
称取10 g酒醅于50 mL离心管,用20 mL蒸馏水浸出,约30 min,10 000 r/min离心10 min,吸取8 mL上清液,加入3 g NaCl于顶空瓶中,再加10 μL薄荷醇内标(100 mg/L),50 ℃下水浴萃取45 min后用GC-MS检测[17]。
色谱条件:FFAP色谱柱(30 m×0.25 mm,0.25 μm);进样量:1 μL;不分流进样;升温程序:起始温度50 ℃,维持2 min,以5 ℃/min升温至190 ℃,再以15 ℃/min升温至210 ℃,电离方式为电子电离[18]。
挥发性风味物质含量的计算方法为:
式中:S1:待测挥发性风味物质的峰面积;S2:内标物的峰面积;N:内标物浓度(100 μg/L)。
1.3.7 酶的纯化
粗酶液的制备:解淀粉芽孢杆菌JP21在MRS培养基中37 ℃静置培养24 h。培养液于4 ℃、8 000 r/min离心20 min,并收集菌体。在20 mmol/L的磷酸盐缓冲溶液(pH 7.5)中洗涤后重悬菌体,置于冰水浴中超声破碎,4 ℃下10 000 r/min 离心30 min,收集上清。
硫酸铵沉淀:将粗酶液放置在冰上,一边搅拌一边缓慢加入硫酸铵粉末至一定饱和度,4 ℃静止4 h,13 000 r/min 离心 20 min 收集 45%~80%饱和度的沉淀,重新溶于20 mmol/L的磷酸盐缓冲溶液(pH 7.5)中,并用相同的缓冲溶液透析过夜。
离子交换层析:将上述酶液5 mL上样于已用20 mmol/L的磷酸盐缓冲溶液 (pH 7.5)平衡的HiTrap Q FF阴离子交换柱上,起始缓冲液A为20 mmol/L pH 7.5的磷酸盐缓冲溶液,洗脱缓冲液B为含1 mol/L NaCl 的 20 mmol/L pH 7.5 的磷酸盐缓冲溶液,采用梯度体积分数 20% B,40% B,60%B,80% B,100% B 液洗脱,流速为1 mL/min,收集 2 mL/管,测定各管酶活,合并活性管并透析除盐。
凝胶层析:将上述酶液上样于已用平衡缓冲液(50 mmol/L磷酸缓冲液,pH 7.5)平衡好的Superdex200层析柱上,用平衡缓冲液进行洗脱,流速0.5 mL/min,每管收集1.8 mL,测定各管酶活,收集合并有酶活各管用于后续研究。
1.3.8 蛋白质浓度测定
采用蛋白浓度测定试剂盒(碧云天公司 Bradford)测定蛋白质含量。取5 μL不同质量浓度标准蛋白(0、0.125、0.25、0.5、0.75、1、1.5 mg/mL)于96孔板中,再取5 μL样品到96孔板中,各孔加入250 μL G250染色液,用酶标仪测定A595时的吸光度,最后根据标准曲线计算样品中的蛋白浓度。
1.3.9 解淀粉芽孢杆菌 JP21所产酶脲酶和EC水解酶酶学性质研究
酶反应的最适pH值:在不同pH缓冲溶液中(0.05 mol/L柠檬酸缓冲液,pH 3.5~6.5;0.05 mol/L磷酸缓冲液,pH 6.5~7.5;0.05 mol/L Tris-HCl缓冲液,pH 7.5~8.5)使酶液与含有40 g/L的不同底物(尿素或EC)反应30 min,以最高酶活为100%计算各pH值条件下的相对酶活,得到最适pH值。
酶反应的最适温度:将酶与含有40 g/L的不同底物(尿素或EC)分别在不同的温度条件下(25、30、35、40、45、50、55、60、65、70、75 ℃)反应30 min,以最高酶活为100%,计算各温度下的相对酶活,得到最适反应温度。
酶的乙醇耐受性:将酶与含有40 g/L的不同底物(尿素或EC)在不同体积分数乙醇缓冲液中(0~40%)反应30 min,测定相应条件下的酶活,以最高酶活为100%,计算各乙醇条件下相对酶活,考察乙醇对酶活性的影响。
酶的底物特异性:将酶分别与含有40 g/L的不同底物(0.05 mol/L的pH 5.5柠檬酸缓冲液,EC、氨基甲酸甲酯、氨基甲酸丁酯、乙酰胺、苯甲酰胺、尿素为底物)反应,测定酶活。
2 结果与分析
2.1 降解尿素和EC的菌株分离筛选和鉴定
本研究采用高通量筛选技术,根据材料与方法里所述的颜色变化,从8万多个分离自浓香型白酒酒醅的菌株中,筛选得到9株能够使培养基颜色变化的菌株作为初筛目的菌株,对这9株初筛目的菌株进行脲酶酶活和EC水解酶酶活检测,得到1株能够同时降解尿素和EC的菌株。对该菌株菌落形态特征进行观察(见图1),菌株鉴定方法参照《芝麻香型白酒高温大曲嗜热功能菌的筛选与鉴定》文章中所述[19],发现该菌株的菌落为乳白色,边缘整齐,质地粘稠,不透明,表面粗糙,菌体为杆状。对该菌株16S rRNA基因序列与GenBank数据库中进行BLAST比对结果表明,该菌株16S rRNA基因序列与解淀粉芽孢杆菌的相似性为99%。因此,命名该菌株为BacillusamyloliquefaciensJP21。

图1 菌株JP21在LB固体培养基上菌落形态(A)及显微镜检图(B) Fig.1 The colony morphology on LB agar (A) and microscopic examination (B) of strain JP21
将B.amyloliquefaciensJP21的16S rRNA序列和ureA基因序列在NCBI数据库中进行比对,并将16S rRNA序列和ureA基因序列经BLAST比对后建立系统发育进化树,由图2分析可知它与解淀粉芽孢杆菌种在一个系统发育支上,因此可确定菌株为解淀粉芽孢杆菌种。
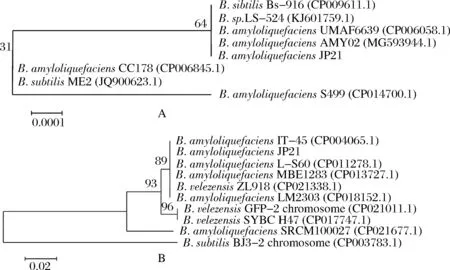
图2 B. amyloliquefaciens JP21 16S rRNA基因(A)和ureA基因(B)系统发育分析Fig.2 Construction of phylogenetic trees of B.amyloliquefaciens JP21 based on 16S rRNA (A) and ureA (B) genes
通过对B.amyloliquefaciensJP21产酶培养条件的简单考察,发现该菌株在37 ℃静置培养条件下的发酵液呈弱酸性并检测到脲酶酶活,而在37 ℃摇床培养条件下的发酵液偏弱碱性且未检测到脲酶酶活,因此该菌株培养条件是37 ℃静置培养。
2.2 解淀粉芽孢杆菌JP21降解酒醅中EC和尿素
前期研究表明,白酒窖内发酵过程EC前体都有增加,在蒸酒过程会与乙醇反应生成EC[5]。因此,在蒸酒前减少EC前体含量,可有效减少白酒中EC含量。为考察解淀粉芽孢杆菌JP21在模拟窖内发酵过程中降解EC及其前体的能力,将B.amyloliquefaciensJP21按照不同浓度与入窖酒醅混合,进行模拟白酒窖内发酵。由图3可以看出,对照组窖内发酵过程酒醅中尿素含量由39.3 mg/kg增加到53.0 mg/kg,增幅约25%;添加B.amyloliquefaciensJP21可不同程度减少酒醅中尿素含量,其中B.amyloliquefaciensJP21添加量为109CFU/g酒醅时,酒醅中尿素只增加17%,发酵终点时酒醅中尿素含量比对照减少12%。
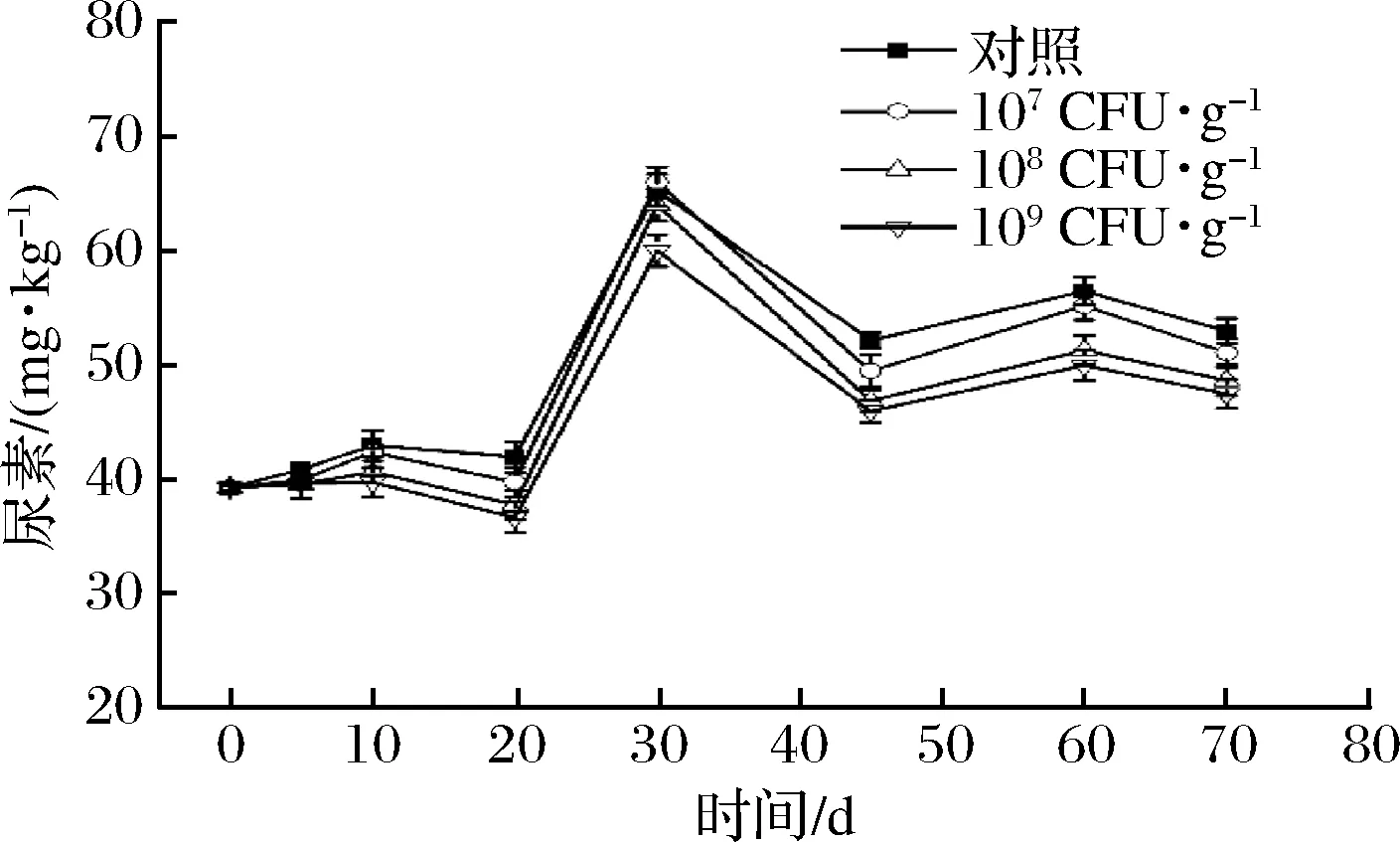
图3 窖内发酵过程酒醅中尿素含量变化Fig.3 Concentrations of urea in fermented gains during Chinese liquor fermentation
白酒窖内发酵过程中,酒醅中EC含量也有所增加,特别是在发酵0~20 d,EC含量由32 μg/kg增加到52.3 μg/kg,增幅为39%。这可能由于此阶段是产酒的过程,酒醅中的乙醇与前体尿素和瓜氨酸反应,生成了EC[20]。发酵结束时,对照组酒醅中EC含量达到52.3 μg/kg,增幅为39%(图4)。在窖内发酵过程添加B.amyloliquefaciensJP21,可显著减少酒醅EC的含量。当B.amyloliquefaciensJP21添加量分别为109、108和107CFU/g时,发酵终点时酒醅中EC含量比对照分别减少17%、13%和11%。由于在酒醅中添加108CFU/g和109CFU/gB.amyloliquefaciensJP21对EC和尿素减少效果接近,今后应用时可选取108CFU/g的添加量。
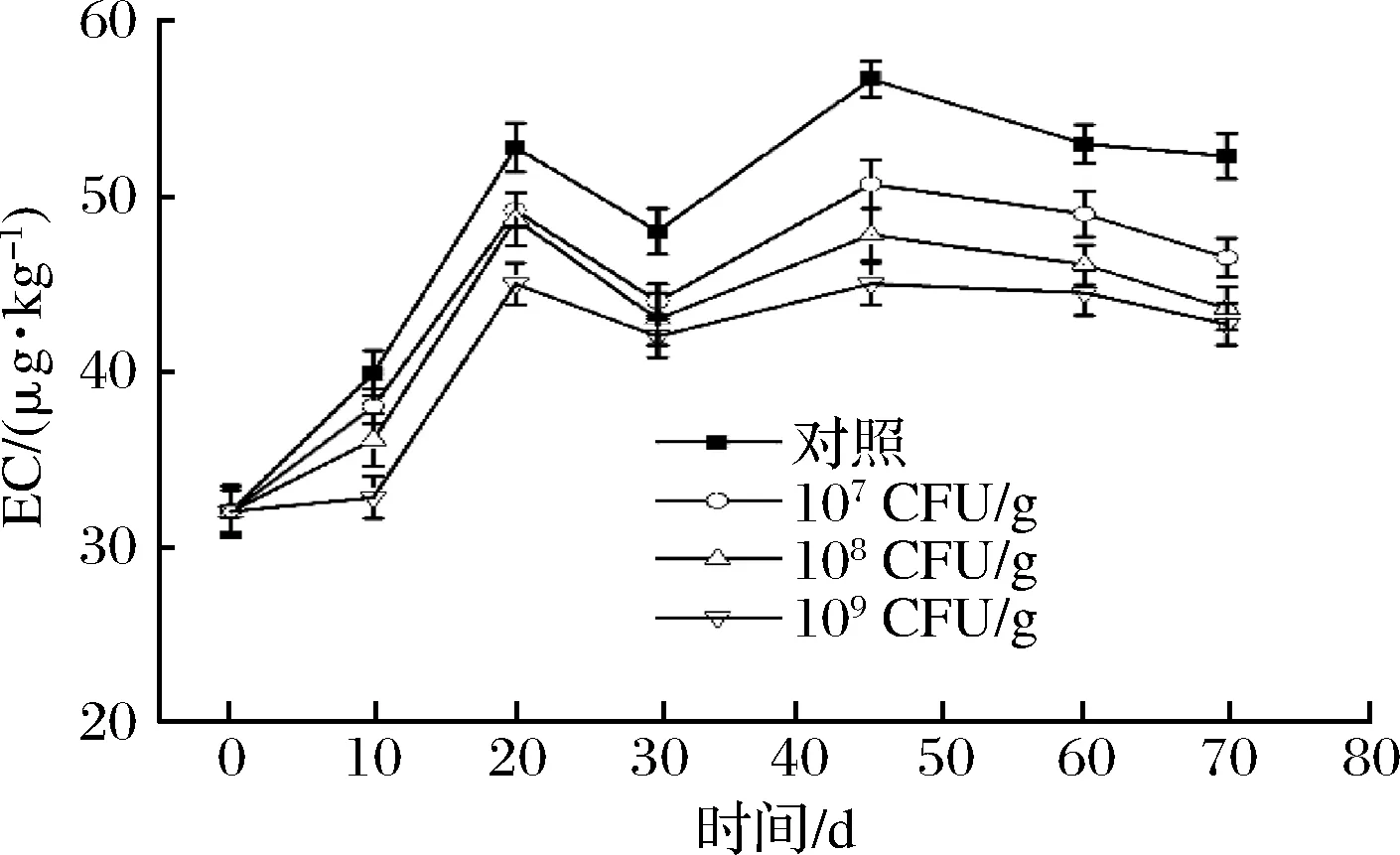
图4 窖内发酵过程酒醅中EC含量变化Fig.4 Concentrations of EC in fermented grains during Chinese liquor fermentation
2.3 添加菌株B. amyloliquefaciens JP21对白酒风味的影响
风味是影响白酒品质的重要因素,虽然本研究采用的菌株是来自酒醅的内源微生物,但是在窖内发酵过程强化此菌,也可能会影响白酒的风味[21]。因此,考察了添加108CFU/gB.amyloliquefaciensJP21进行窖内发酵,对发酵结束酒醅中挥发性物质的种类和含量的影响。由图5可知,添加B.amyloliquefaciensJP21发酵结束时,酒醅中醇类减少了一种,酯类增加了一种,其他挥发性物质的种类和含量基本无显著变化。由此可以初步认为,在窖内发酵过程中强化B.amyloliquefaciensJP21对白酒中挥发性物质的种类和含量无显著影响。
2.4 B. amyloliquefaciens JP21降解EC和尿素酶的初步纯化
B.amyloliquefaciensJP21具有同时降解EC和尿素的能力,为了识别降解酶的特性,拓展菌株和酶的应用,对B.amyloliquefaciensJP21降解EC和尿素的酶进行了初步纯化和性质研究。将超声破碎后获得粗酶经过硫酸铵沉淀、离子交换层析和凝胶层析进行了初步纯化(表1)。通过多步纯化,酶的比酶活力提高到34 U/mg,纯度提高了16倍。对初步纯化的降解EC和尿素的酶进行SDS-PAGE分析,发现图中有3个条带预测为脲酶的3个亚基UreC,UreA,UreB,对应的分子质量分别为61、15和14.5 kDa(图6)。为进一步确认此降解酶的特性,在NCBI数据库中寻找可能的解淀粉芽孢杆菌编码降解尿素和EC的基因。结果发现,解淀粉芽孢杆菌IT-45脲酶基因的编码产物3个亚基大小分别为61.2, 13.5和11.5 kDa(Accession No. CP004065),与图6中初步纯化获得的降解EC和尿素酶的3个主带接近。
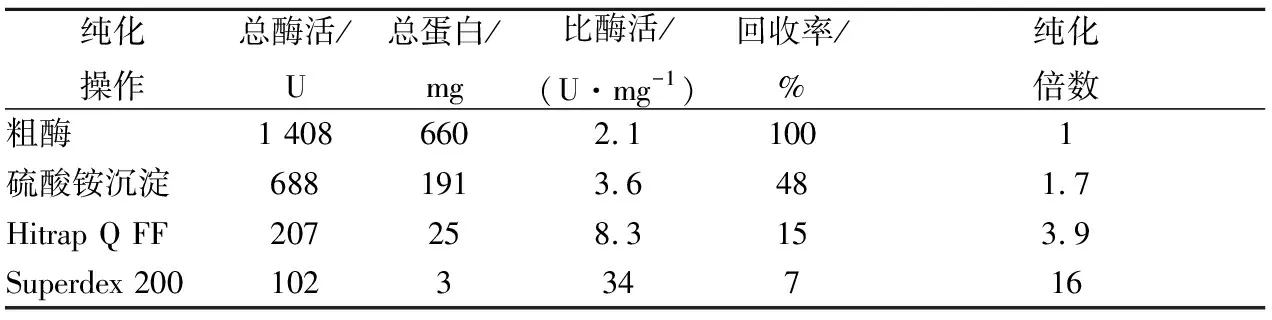
表1 B. amyloliquefaciens JP21所产降解EC和尿素酶的初步纯化Table 1 Purification of enzyme for degradation of EC andurea produced by B. amyloliquefaciens JP21
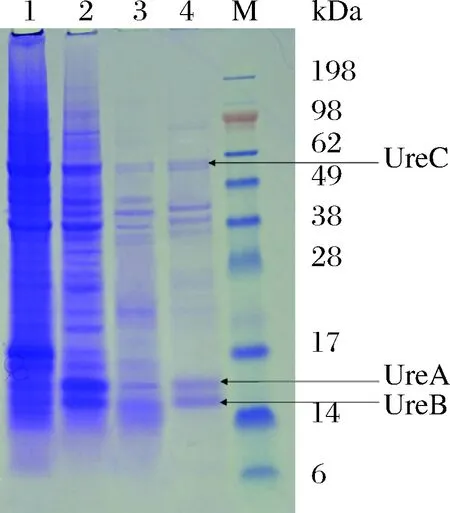
1-粗酶;2-硫酸铵沉淀组分;3-Hitrap Q FF分离样品;4-Superdex 200分离样品;M-Marker图6 B. amyloliquefaciens JP21所产降解EC和尿素酶的初步纯化Fig.6 Purification of EC and urea degrading enzyme produced by B. amyloliquefaciens JP21
2.5 B. amyloliquefaciens JP21所产降解EC和尿素酶的性质研究
酒精饮料和发酵食品体系多为酸性体系,因此酸性EC和尿素降解酶更适用于食品发酵体系。由图7可以看出,B.amyloliquefaciensJP21所产降解EC和尿素酶的最适反应pH值相同,均为pH 5.5。酶在pH值4.5~6.5反应条件下,相对酶活为最高的80%以上,因此,该菌株所产酶降解EC和尿素酶在酸性条件下活性较高。
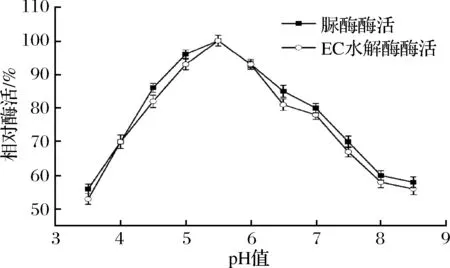
图7 pH值对B. amyloliquefaciens JP21所产降解EC和尿素酶活性的影响Fig.7 Effects of pH on EC and urea degrading enzyme produced by B. amyloliquefaciens JP21
温度会影响酶蛋白分子的结构以及酶与底物的亲和力。由图8可知,B.amyloliquefaciensJP21所产降解EC和尿素酶的最适反应温度为35 ℃,该酶在25~50 ℃的温度范围内,有相对较高的酶活(酶活在70%以上)。白酒的窖内发酵温度一般在30 ℃左右[22],因此,B.amyloliquefaciensJP21所产的脲酶和EC降解酶能够在白酒窖内发酵过程中对减少尿素及EC发挥一定的作用。
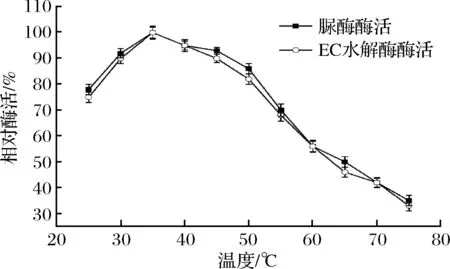
图8 温度对B. amyloliquefaciens JP21所产降解EC和尿素酶活性的影响Fig.8 Effects of temperature on EC and urea degrading enzyme produced by B. amyloliquefaciens JP21
通过考察酶在不同乙醇含量条件下的耐受性,可知B.amyloliquefaciensJP21所产脲酶和EC水解酶应用到酒中去除EC能否发挥一定的作用。酶的乙醇耐受性如图9所示,随着乙醇体积分数的增加,酶活性逐渐降低,当乙醇体积分数为15%的时候,残余酶活为60%。这说明B.amyloliquefaciensJP21所产脲酶和EC水解酶可耐受低浓度乙醇,具有在白酒窖内发酵过程中减少EC的潜在应用价值。
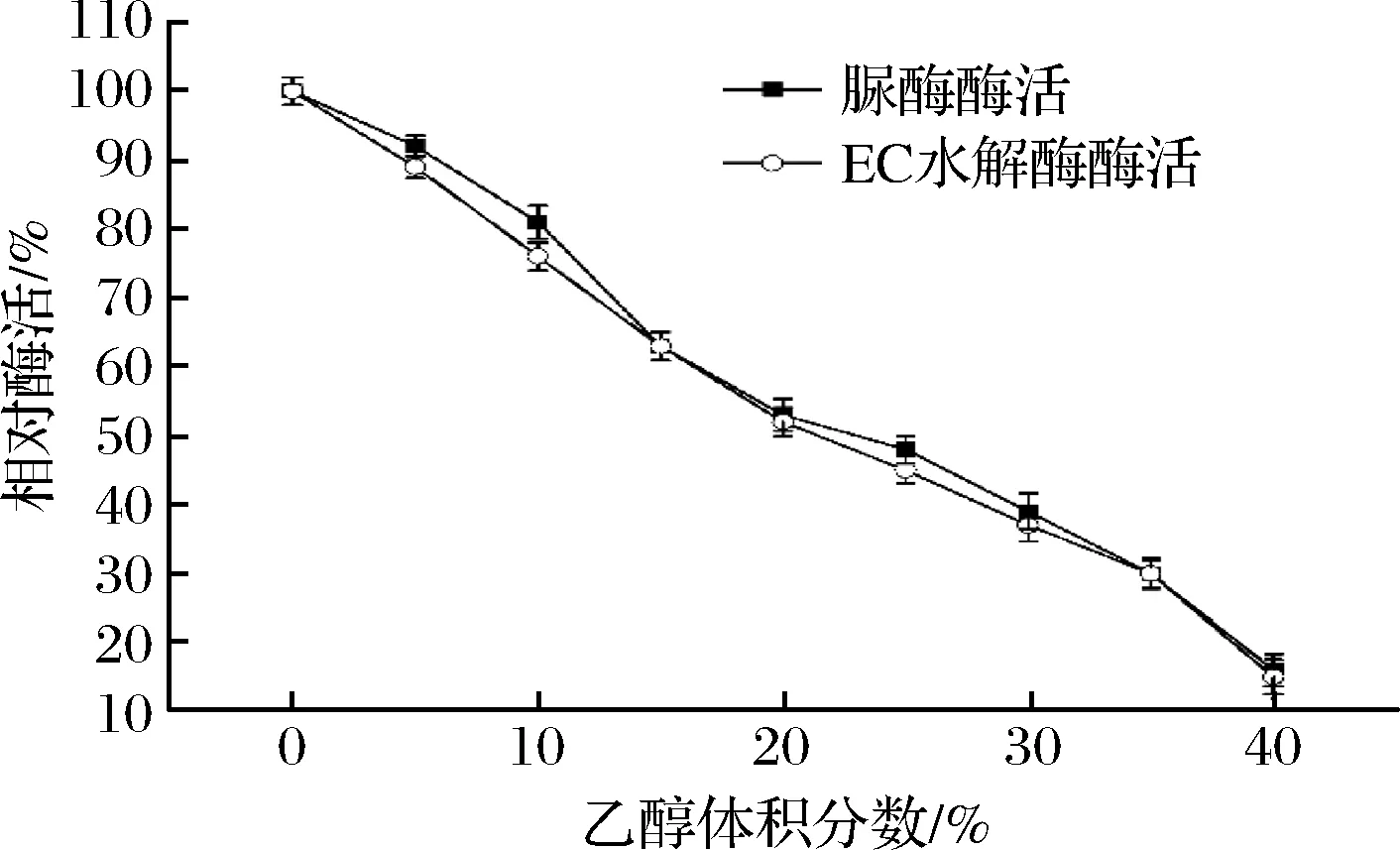
图9 乙醇对B. amyloliquefaciens JP21所产降解EC和尿素酶活性的影响Fig.9 Effect of ethanol on EC and urea degrading enzyme produced by B. amyloliquefaciens JP21
2.6 酶的底物特异性
由于B.amyloliquefaciensJP21所产降解EC和尿素酶可同时降解EC和尿素,但是通过纯化发现是一种酶可以同时降解EC和尿素。为进一步确认B.amyloliquefaciensJP21所产降解酶的特性,考察了该酶对不同底物的作用效果。由图10可以看出,该酶的最适反应底物为尿素,也可以催化EC降解。结合初步纯化的酶具有与脲酶相似的3个亚基的特性,认为B.amyloliquefaciensJP21所产降解EC和尿素酶的酶为脲酶,具有分解尿素和EC的特性。

图10 B. amyloliquefaciens JP21所产降解EC和尿素酶的底物特异性Fig.10 The substrate specificity of EC and urea degrading enzyme produced by B. amyloliquefaciens JP21
3 讨论
本研究从浓香型白酒酒醅中分离得到1株能够同时降解EC和尿素的菌株B.amyloliquefaciensJP21。将该菌用于白酒窖内发酵,有效减少了酒醅中尿素和EC的含量,并且对白酒的风味物质无显著影响。与来源于变幻青霉菌的EC水解酶相比[23],在去除EC方面更具优势,因此该菌株具有在白酒窖内发酵过程中减少EC的潜在应用价值。
通过对B.amyloliquefaciensJP21所产降解EC和尿素酶的酶学性质研究发现,此酶为脲酶,具有催化EC和尿素分解活性,这与来源于Providenciasp.[24]所产脲酶特性相似。该酶的最适pH值为5.5,这与胶红酵母所产EC降解酶,赖氨酸芽孢杆菌所产EC降解酶,肺炎克雷伯氏菌所产EC降解酶的最适pH 7.0不同[25-27],相对而言,B.amyloliquefaciensJP21在减少酒精饮料中的EC更具优势。在考察温度和乙醇对B.amyloliquefaciensJP21所产脲酶活性影响的研究中发现,该酶最适反应温度为35 ℃,这与Lactobacillusreut所产脲酶最适反应温度65 ℃不同[28],且B.amyloliquefaciensJP21所产脲酶能够耐低浓度乙醇(体积分数15%),这一性质与变幻青霉菌所产EC降解酶性质类似[29],由于白酒窖内发酵过程中温度的波动范围在16~32 ℃[22],B.amyloliquefaciensJP21更适合白酒窖内发酵过程中减少EC。
综上所述,B.amyloliquefaciensJP21可以在白酒混菌发酵体系中有效控制EC,在保证白酒安全性方面具有重要的应用前景,并且在其他含有乙醇的发酵食品中(酱油和黄酒)也具有潜在减少EC含量的应用价值,同时通过基因工程等手段对该酶基因在宿主菌中进行异源表达有一定的研究意义。

