细胞壁降解酶与黄精种子胚乳弱化的关系
, , , , , , ,
(1.西北农林科技大学生命科学学院, 陕西 杨凌 712100;2.西北农林科技大学农学院, 陕西 杨凌 712100; 3.步长制药有限公司, 西安 710075)
种子是重要的农业生产资料, 其萌发质量的好坏将直接关系到农业生产的成败。黄精(PolygonatumsibiricumRed.)种子休眠期长,发芽率极低,严重制约着黄精药材的大面积生产。研究发现引起黄精种子休眠的原因是多方面的,其中种子特异结构是其主要原因之一。黄精种子属于胚乳包裹种胚的种子类型,种胚被厚而致密的胚乳包被,胚乳细胞间隙小,细胞壁厚,机械强度大[1],其种子萌发过程中仅靠胚轴伸长生长产生的机械力量还不足以突破其机械强度较高的胚乳组织。因此,胚乳弱化是黄精种子能否萌发的最后开关。胚乳弱化则包括细胞壁的酶促和非酶促松弛机制。本试验主要通过研究β-甘露聚糖酶(β-Man)、β-半乳糖苷酶(β-Gal)、果胶甲酯酶(PME)、多聚半乳糖醛酸酶(PG)、纤维素酶(Cx)、阿拉伯糖苷酶(Ara)、木糖苷酶(Xyl)和β-甘露糖苷酶(β-Mas)等细胞壁降解酶在黄精种子萌发过程中的活性变化,探讨其与黄精种子萌发过程中胚乳弱化的关系,为黄精种子破眠技术提供理论依据,为黄精有性繁殖提供技术指导。
1 材 料
实验材料于2015年11月取自陕西省汉中市略阳县五龙洞镇步长集团黄精规范化生产基地,为当年生黄精种子,室外沙藏3个月。
2 方 法
2.1 种子处理
将沙藏后的黄精种子取出,清水冲洗干净,挑选表面光滑、完整,大小适中的黄精种子用于实验。实验分为处理组与对照组,处理组种子用100 mg/L GA3水溶液20 ℃条件下浸种12 h,蒸馏水冲洗3次,再用10 mL 3%的H2O2消毒15 min,最后蒸馏水冲洗3次。对照组用蒸馏水浸种,其余处理相同。
处理后的种子分为2份,一份用于发芽试验,取50粒种子均匀播种在铺有双层无菌滤纸的90 mm培养皿中,重复3次;另一份用于测定不同萌发时期细胞壁裂解酶类的活性变化,种子均匀播种在铺有双层无菌滤纸的25 cm×34 cm育苗盘中,重复3次,每个重复用种子150 g(3 750粒左右)。处理组与对照组均置于MGC-300 A型智能光照培养箱中25 ℃避光培养。
2.2 发芽试验
黄精种子发芽期限设定为40 d,每天观察种子发芽情况,以突破种皮的下胚轴长度超过种子自身长度视为发芽[3],统计种子发芽率、发芽指数、发芽势。
发芽势(%)=n/N×100%
(1)
发芽率(%)=∑(Gt/N)×100%
(2)
发芽指数=∑(Gt/Dt)
(3)
式中,Gt表示在第t日时的发芽数,n表示自发芽之日起前25 d发芽种子数, N表示供试种子总数,Dt表示相应的发芽天数。
2.3 酶活性测定
2.3.1 β-Man活性的测定
参照3,5-二硝基水杨酸法(DNS)[4]进行测定。
2.3.2 PME活性的测定
采用Hangerman等[5]的方法进行测定。
2.3.3 PG和Cx活性的测定
参照曹建康等[6]的方法进行测定。
2.3.4 β-Gal、Xyl、Ara和β-Mas活性的测定
β-Gal、Xyl和Ara活性测定参照Hruba[7]和Itail等[8]的方法,β-Mas活性测定参照Bewley等[9]的方法,并略有改动,β-Gal的提取缓冲液为0.1 mol/L pH=4.6柠檬酸-柠檬酸钠缓冲液,内含1 mol/L NaCl、13 mmol/L EDTA二钠、1.5% PVP和5 mmol/L β-巯基乙醇,其它3个酶的提取缓冲液为MES缓冲液,反应底物分别为对硝基苯基-β-D-半乳糖苷、对硝基苯基-α-L-阿拉伯呋喃糖苷、对硝基苯基-β-D-吡喃木糖苷和对硝基苯基-β-D-甘露糖苷,37 ℃恒温1 h,酶活力单位为nmol/(g·min),重复3次。
2.4 数据处理
运用SPSS 22版统计软件对数据进行统计分析,用Microsoft Excel软件进行绘图。
3 结果与分析
3.1 GA3处理对黄精种子萌发的影响
GA3处理对黄精种子萌发的影响见表1。由表1可以看出,经GA3处理后的黄精种子发芽率、发芽势、发芽指数均高于ck组,且发芽率和发芽指数差异显著(p<0.05)。表明一定浓度GA3溶液对黄精种子的萌发具有一定的促进作用。
表1 GA3对黄精种子萌发的影响

发芽率(%)发芽势(%)发芽指数处理组72.00±4.00a38.00±5.29a1.53±0.08ack组63.33±3.05b31.33±3.06a1.25±0.03b
注:a、b表示显著性差异。
3.2 黄精种子萌发过程中细胞壁裂解酶活性的变化
3.2.1 β-Man活性的变化
黄精种子萌发过程中,β-Man的活性总体表现为上升趋势,但在处理组和对照组中有所不同(图1),处理组β-Man活性变化呈先上升后保持平稳的变化趋势,第26天时,活性达到最大;ck组的β-Man活性变化呈先保持平稳再上升后稍微下降的变化趋势,也是在第26天时,达到最大活性。在整个萌发过程中,处理组比ck组酶活性平均水平表现出极显著性差异(p<0.01),表明GA3在促进黄精种子萌发的同时也促进了β-Man活性的增加,说明β-Man在黄精种子萌发过程中对胚乳弱化具有重要的促进作用,从而缓解胚乳细胞对胚的束缚,而提高萌发率。

图1 黄精种子萌发过程中β-甘露聚糖酶活性的变化
3.2.2 PME的活性变化
黄精种子萌发过程中,在1~26 d,处理组PME活性变化呈现驼峰样变化,2个高峰分别出现在第6天和第16天,其中第16天酶活性达到最大。在26~36 d,酶活性变化基本保持平稳趋势;ck组的酶活性变化呈现波浪式变化,第1次酶活性高峰同样出现在第6天,之后快速下降至第21天,活性降为最低,从21 d起又快速上升,至第31天达到酶活性的第2个高峰,较之处理组推迟了15 d,之后缓慢下降。在整个萌发过程中,GA3处理组比ck组酶活性平均水平高,且表现出显著性差异(p<0.05)。表明GA3在促进黄精种子萌发的同时也可增加PME的活性,但在初期对PME的活性有抑制作用,说明在黄精种子萌发过程中,PME对胚乳弱化有一定积极作用。

图2 黄精种子萌发过程中果胶甲酯酶活性的变化
3.2.3 PG活性的变化
在黄精种子萌发过程中,处理组与对照组中PG活性表现不尽相同,在前5 d基本一致,表现为快速上升;之后,处理组继续上升,至第11天达到第1次高峰后开始下降,到第16天转为缓慢上升,直到第31天达到最大值;而对照组从第6天开始逐步下降,至16 d到达最低点,之后表现为波浪式上升,在第31天达到最大值。在整个萌发过程中,处理组较对照组表现出较高的酶活,且差异性极显著(p<0.01)。结合种子萌发情况,说明PG在黄精种子萌发过程中对胚乳弱化起着重要作用。
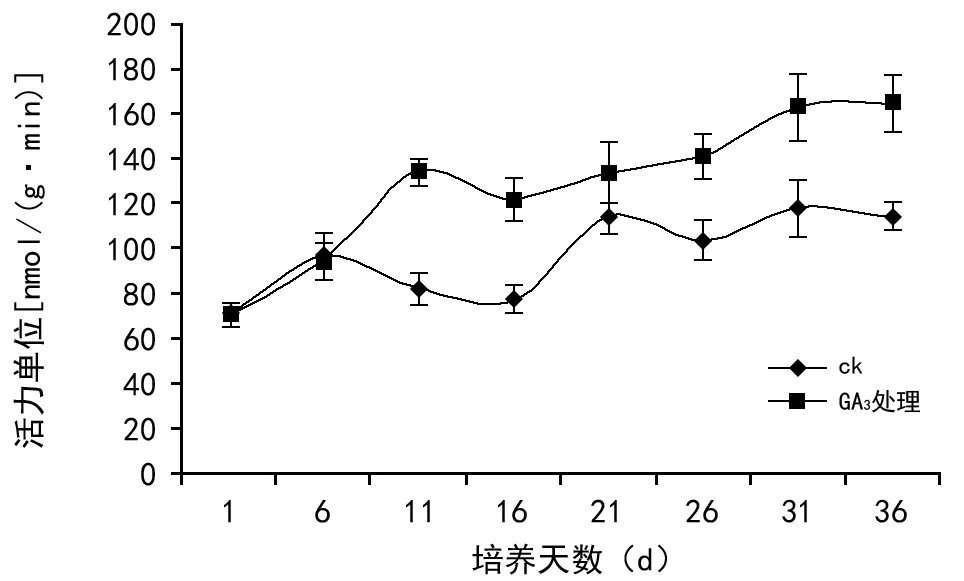
图3 黄精种子萌发过程中多聚半乳糖醛酸酶活性的变化
3.2.4 Cx活性的变化
在黄精种子萌发过程中,Cx活性的变化如图4所示。由图4可看出,处理组和对照组之间差异不大,变化趋势也基本一致。在萌发处理的1~21 d之间Cx活性变化不大,处理组虽有波动,但和对照组均表现出缓慢下降的趋势;从21 d起,Cx活性快速上升,其中处理组上升速度较快,在第31天达到最大值,之后略有下降,对照组上升速度略缓,在第36天达到最大值和处理组达到同一水平。在整个萌发过程中,处理组比对照组酶活性平均水平未表现出显著性差异(p=0.288)。表明在种子萌发过程中,Cx对胚乳弱化影响较小。

图4 黄精种子萌发过程中纤维素酶活性的变化
3.2.5 β-Gal活性的变化
在黄精种子萌发过程中,处理组和对照组β-Gal活性变化趋势基本相同,呈先增加再降低最后保持平稳的变化趋势,第26天时达到最大值(图5)。在整个萌发过程中,处理组比ck组酶活性平均水平表现出极显著性差异(p<0.01)。表明β-Gal同样对黄精种子胚乳弱化发挥着重要作用。

图5 黄精种子萌发过程中β-半乳糖苷酶活性的变化
3.2.6 Ara活性的变化
在黄精种子萌发过程中,Ara活性在处理组和对照组中总体表现为相反。其中,处理组呈波浪式上升的变化趋势,第36天时酶活性达到最大值;对照组呈驼峰状变化趋势(如图6)。在整个萌发过程中,2组酶活性值均偏低,酶活性平均水平未表现出显著性差异(p=0.875),说明Ara对黄精种子胚乳弱化无显著性作用。

图6 黄精种子萌发过程中阿拉伯糖苷酶活性的变化
3.2.7 Xyl活性的变化
在黄精种子萌发过程中,处理组与对照组Xyl活性表现基本一致,其中对照组第11天达到最大活性值,而处理组在第21天达到最大活性值,活性最大值出现时间向后推迟10 d左右(图7)。在整个萌发过程中,处理组比对照组酶活性平均水平未表现出显著性差异(p=0.637)。表明Xyl对黄精种子胚乳弱化无显著性作用。

图7 黄精种子萌发过程中木糖苷酶活性的变化
3.2.8 β-Mas活性的变化
黄精种子在萌发过程中,处理组与对照组β-Mas活性变化趋势大致相同,处理组β-Mas活性在1~6 d之间快速升高,之后转缓,在第21天时酶活性达到最大值。之后缓慢降低;对照组1~6 d增速较慢,第6~11天快速升高,第11天达到最大值,之后保持平稳(图8)。在整个萌发过程中,处理组比对照组酶活性平均水平表现出显著性差异(p<0.05)。说明β-Mas对黄精种子胚乳弱化起着一定的促进作用。

图8 黄精种子萌发过程中β-甘露糖苷酶活性的变化
4 结论与讨论
黄精种子萌发过程中伴随着胚乳弱化现象,关于胚乳弱化的机制,Ikuma和Thimann认为调控莴苣种子萌发的最后一道关卡是产生一种酶[10],能够使胚根突破胚乳。大多数研究者认为,胚乳弱化不可能由一种细胞壁降解酶来完成,而是多种细胞壁降解酶协同作用的结果。细胞壁主要由果胶、纤维素和半纤维素等组成,降解这些多糖的酶类会对胚乳弱化过程产生作用。
细胞壁降解酶中研究最多的是β-甘露聚糖酶,Groot等的研究表明,β-甘露聚糖酶与番茄种子胚乳弱化存在相关性,同时研究发现GA3在促进番茄种子萌发的同时,也提高了β-甘露糖苷酶活性[11-12]。果胶甲酯酶的作用是将甲酯化的多聚半乳糖醛酸上的甲基脱去,Ren和Kermode发现,果胶甲酯酶对黄柏种子胚乳弱化发挥作用[13],Salanenka等发现,果胶甲酯酶在黄瓜种子胚乳弱化中起作用[14]。Sitrit等的研究显示,多聚半乳糖醛酸酶与番茄种子胚乳弱化相关[15]。Ikum等首次提出纤维素酶与胚乳弱化存在相关性[10],Leviatov等研究表明,纤维素酶不是控制番茄种子胚乳弱化的关键酶[16]。
本试验结果表明,黄精种子萌发中胚乳弱化与多种细胞壁裂解酶有关,但各自所发挥的作用并不相同,经GA3处理后,β-甘露聚糖酶、β-半乳糖苷酶和多聚半乳糖醛酸酶活性平均水平极显著提高,果胶甲酯酶和β-甘露糖苷酶活性平均水平显著提高,而纤维素酶、木糖苷酶和阿拉伯糖苷酶活性平均水平未表现出显著性差异,但不同于活性较低的木糖苷酶和阿拉伯糖苷酶,GA3处理组与ck组纤维素酶活性较高。GA3处理后的黄精种子萌发率和萌发指数均高于对照处理,且表现出显著性差异。以上结果说明,β-甘露聚糖酶、β-半乳糖苷酶和多聚半乳糖醛酸酶在黄精种子胚乳弱化过程中起着重要的促进作用,果胶甲酯酶和β-甘露糖苷酶对种子的胚乳弱化也发挥一定的促进作用,纤维素酶在胚乳弱化后期起着一定的积极作用,阿拉伯糖苷酶和木糖苷酶无明显的促进作用,但不排除对其它酶产生协同作用,这有待于进一步试验证明。
本试验研究了多种细胞壁裂解酶类对黄精种子胚乳弱化的作用,但仅是在生理方面进行了初步研究,至于GA3对这些酶类的具体调控机制,还需要进一步深入研究。黄精种子胚乳弱化机制的研究不仅可以为种子破眠技术提供理论依据和技术指导,而且对合理充分利用黄精种子资源,生产优质药材,保护野生黄精资源等都具有重要的理论和实践意义。

