模拟地下咸水中B30铜镍合金的耐蚀性
,,,
(1. 中国海洋大学 海洋环境与生态教育部重点实验室,青岛 266100; 2. 青岛双瑞海洋环境工程股份有限公司, 青岛 266101;3. 建设综合勘察研究设计院有限公司,北京 100007)
由于铜合金在海洋环境中具有较好的耐腐蚀和抗海洋生物附着等特性,因此,在海洋工程中得到广泛应用。国内外学者对铜合金在海洋环境中的腐蚀规律展开广泛研究[1-8],普遍认为海水中不同阴离子成分对铜镍合金的腐蚀起到互相协同作用[9]。李进等[10]认为SO42-可以加速循环水中铜镍合金的点蚀。DROGOWSKA等[11]研究发现Cl-可以使碳酸氢盐溶液中铜的自腐蚀电位向负方向移动。王长罡等[12]研究指出在低含量的HCO3-环境中,Cu的点蚀敏感性随HCO3-含量的升高而升高。滨海地区由于海侵形成高矿化度的地下咸水,其阴离子成分与海水中的相似,但含量与海水中的不同,对地源热泵系统热交换器采用的铜镍合金材料具有较严重的腐蚀性。目前,在高矿化度地下咸水中铜镍合金的腐蚀试验开展得较少,而铜镍合金在海水中的腐蚀规律无法完全适用于地下咸水中,因此在海侵地区推广应用地源热泵需要研究地下咸水对铜镍合金耐蚀性的影响。本工作通过复配不同浓度梯度的Cl-、SO42-、HCO3-溶液来模拟地下咸水对B30铜镍合金腐蚀作用的机理,采用动电位极化扫描和电化学阻抗谱法对B30铜镍合金的腐蚀情况进行分析,为地源热泵系统在地下咸水环境中的应用提供数据支持。
1 试验
1.1 试验材料
试验材料选用B30铜镍合金,其化学成分如表1所示。B30铜镍合金试片经220、400、800、1 200号水磨砂纸逐级打磨后,采用无水乙醇除油、 蒸馏水清洗、吹干。将B30铜镍合金加工成电极试样(工作面积为1 cm2),非工作面用环氧树脂封涂。

表1 B30铜镍合金的化学成分(质量分数)Tab. 1 Chemical composition of B30 copper-nickel alloy (mass) %
现场采集天津塘沽区中新生态城地区地下咸水和近海海水,经测试地下咸水中Cl-、SO42-和HCO3-的质量浓度分别为10.3,0.55,1.08 g/L,近海海水中相应离子的质量浓度分别为19.7,2.74,0.15 g/L。结合地下咸水和海水中的阴离子含量,用NaCl、Na2SO4和NaHCO3试剂复配试验溶液以模拟地下咸水中的阴离子成分。试验溶液中Cl-质量浓度为0.02~30 g/L,SO42-质量浓度为0~10 g/L,HCO3-质量浓度为0~2 g/L。溶液温度保持在(25±3) ℃。
1.2 试验方法
电化学测试采用德国ZAHNER公司的IM6E电化学工作站进行。参比电极为Ag/AgCl电极(SSE),辅助电极为铂片电极,工作电极为B30铜镍合金。动电位极化扫描速率为1 mV/s,扫描范围为-0.3~1.0 V(相对于参比电极)。采用Origin软件对极化曲线tafel区进行线性拟合,通过拟合方程求得自腐蚀电流密度(Jcorr)。电化学阻抗谱测量频率范围为0.01~100 kHz,交流激励信号幅值为10 mV,采用Zview2.0软件模拟等效电路。
2 结果与讨论
2.1 Cl-含量对B30铜镍合金腐蚀规律的影响
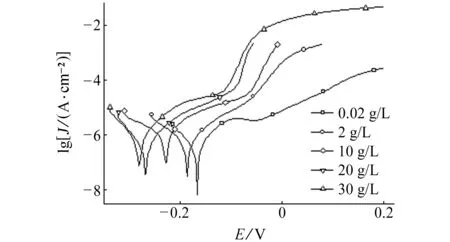
B30铜镍合金在Cl-含量不同的NaCl溶液中的动电位极化曲线,如图1(a)所示,拟合得到的自腐蚀电流密度见表2。结果表明:B30铜镍合金的动电位极化曲线存在较为明显的钝化区,表明B30铜镍合金表面氧化膜具有防Cl-腐蚀的作用;B30铜镍合金自腐蚀电流密度随着Cl-含量的增大而增大,表明B30铜镍合金腐蚀速率随其含量增大而逐渐加快。
B30铜镍合金表面氧化膜是高缺陷的P型半导体,镍等合金元素可以通过占据Cu2O的阳离子空穴或替代铜离子参杂到有缺陷的Cu2O点阵中以提高表面膜的耐蚀性[13]。氯离子半径小、穿透能力强,因而易穿过表面氧化膜而吸附在金属表面活性 点上[14]。金属表面活性点上铜原子不断失电子进入溶液中成为铜离子,并与吸附于活性点的氯离子络合,导致金属表面开始出现微小的点蚀坑,破坏氧化膜的完整性,进而产生大阴极小阳极现象,致使微小点蚀坑不断扩大并向纵深发展,因此Cl-含量的增大会加剧B30铜镍合金点蚀的发展。
(a) 极化曲线
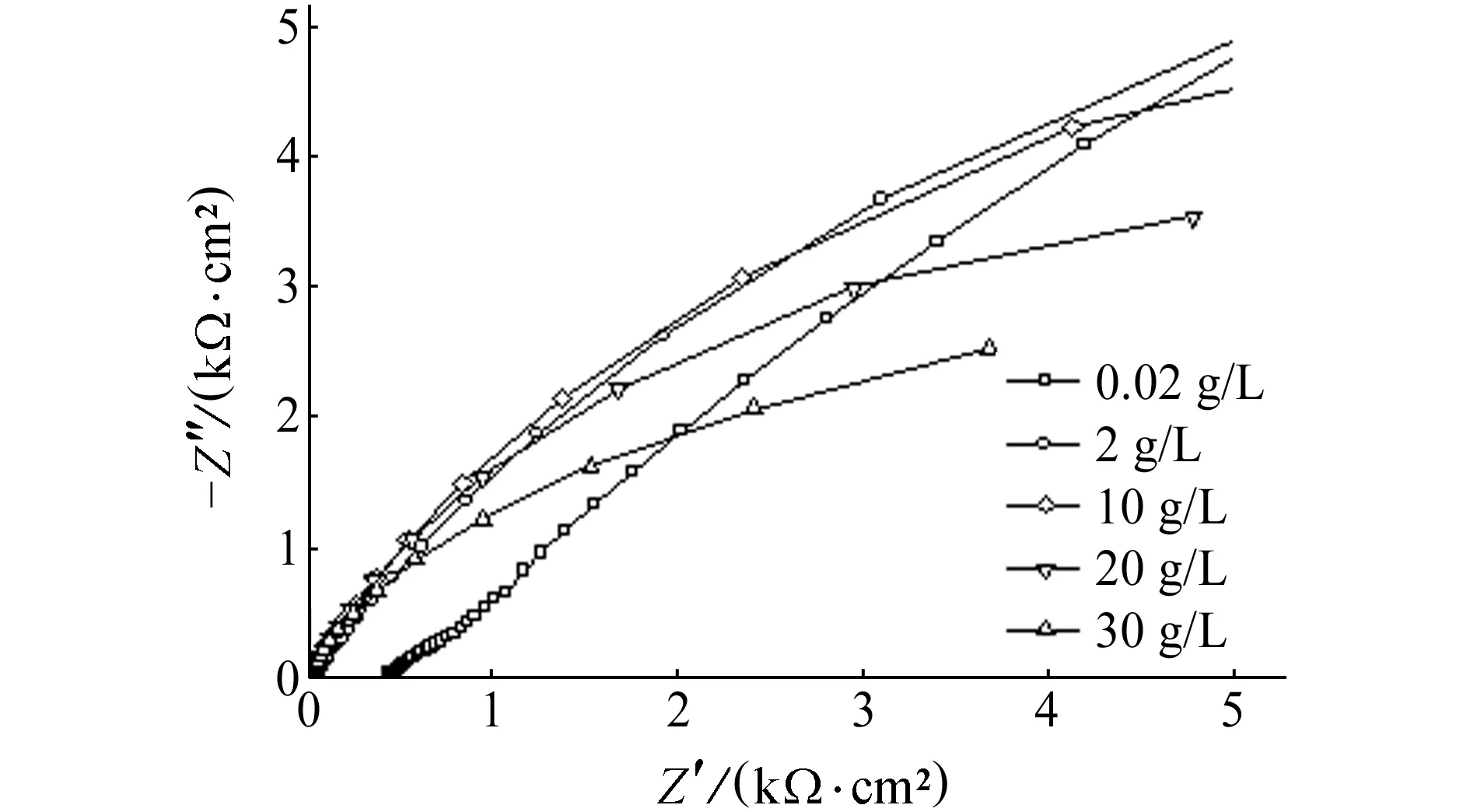
(b) 电化学阻抗谱图1 在Cl-含量不同的NaCl溶液中B30铜镍合金的 极化曲线和电化学阻抗谱Fig. 1 Polarization curves (a) and EIS (b) of B30 copper-nickel alloy in NaCl solution with different Cl- concentrations

拟合参数Cl-质量浓度/(g·L-1)0.022102030Jcorr/(10-7 A·cm-2)3.210.138.842.247.9Ra/(kΩ·cm2)18.9717.6415.3311.7810.38Rt/(kΩ·cm2)2.481.921.411.321.17
B30铜镍合金在Cl-含量不同的NaCl溶液中的电化学阻抗谱见图1(b)。由图1(b)可以看到:B30铜镍合金的阻抗半径随着Cl-含量的增大而降低。采用图2所示等效电路对B30铜镍合金的电化学阻抗谱进行解析。图中Rs为溶液电阻,Rt为 电荷传递电阻,Ra为膜层电阻,C1为膜层与基体之间的界面电容,C2为膜层与溶液形成的双电层电容。由于溶液电阻Rs数值很小,故对B30铜镍合金的腐蚀影响较小,可以忽略。对等效电路进行拟合得到相应的参数,见表2。结果表明:膜层电阻Ra和电荷传递电阻Rt二者均随着Cl-含量的增大而降低。FENG等[15]研究发现,当介质中pH在6~9时,合金表面的Cu2O具有保护性,氧化膜中铜离子的扩散是整个腐蚀过程的控制步骤。这说明B30铜镍合金腐蚀过程中参与电化学反应的铜离子由金属表面向溶液中扩散转移的阻力降低,B30铜镍合金表面氧化膜的耐蚀性降低。
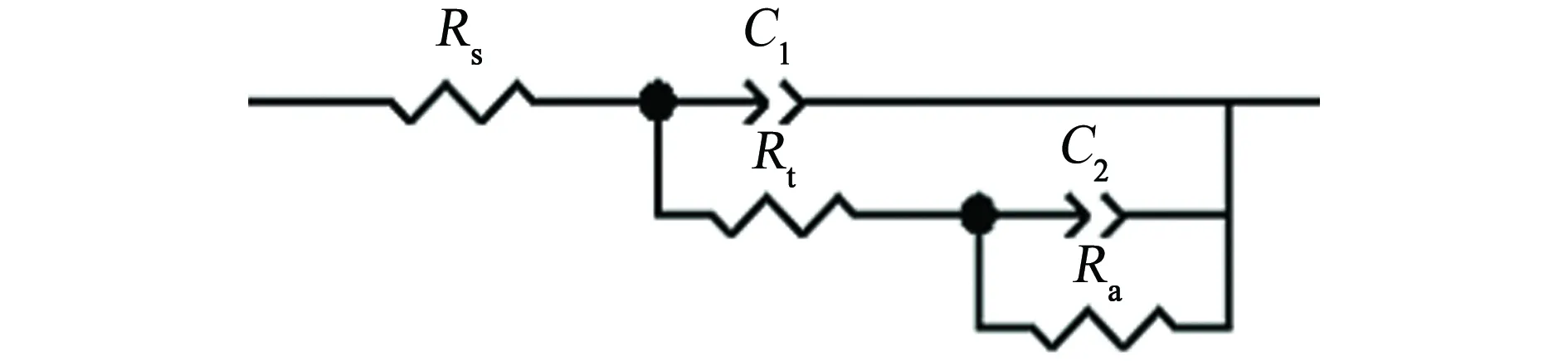
图2 B30铜镍合金在Cl-含量不同的NaCl溶液中 电化学阻抗谱的等效电路Fig. 2 Equivalent circuit for EIS of B30 copper-nickel alloy in NaCl solution with different Cl- concentrations
2.2 SO42-与Cl-协同作用对B30铜镍合金腐蚀规律的影响
B30铜镍合金在SO42-质量浓度分别为0,0.5,1.0,2.0,5.0,10.0 g/L的NaCl溶液(Cl-质量浓度为10 g/L)中的极化曲线如图3(a)所示,极化曲线拟合结果见表3。结果表明:当NaCl溶液中加入SO42-后B30铜镍合金的腐蚀速率均大于Cl-单独存在时的腐蚀速率,这表明SO42-的存在促进了B30铜镍合金表面氧化膜的破坏,与Cl-具有协同作用。当SO42-质量浓度为0~5.0 g/L时,随其含量的增大,B30铜镍合金的腐蚀速率逐渐增大;当SO42-质量浓度为5.0~10.0 g/L时,随其含量的增大,B30铜镍合金的腐蚀速率逐渐降低。
当溶液中含有少量的SO42-(0~5.0 g/L)时,SO42-与Cl-在局部金属表面争抢活性结合点,导致Cl-在局部金属表面大量聚集,局部高含量的Cl-加剧了点蚀坑内的自催化酸化效应,加速金属腐蚀。当SO42-的含量增大时(5.0~10.0 g/L),SO42-覆盖整个金属表面活性结合点,由于SO42-空间位阻较大,致使Cl-不易在金属表面点蚀坑内富集,不利于蚀孔向纵深发展,点蚀倾向降低。王长罡等[16]对纯铜进行了研究,发现当Cl-含量较高时,随着SO42-含量的升高,纯铜表面点蚀坑内的自催化效 应引起的局部酸化和阴离子聚集程度先升高后降低,与本试验得出规律一致。
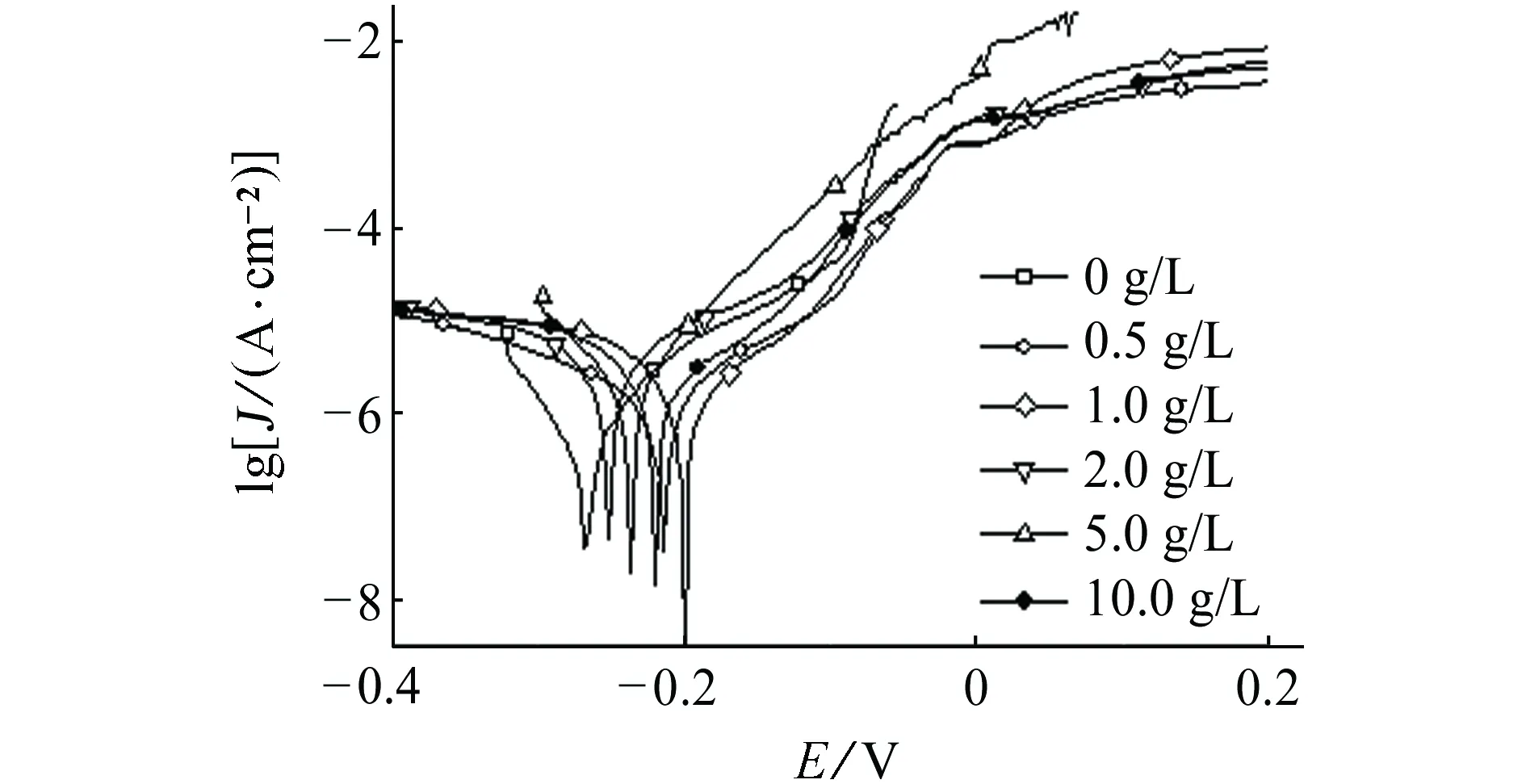
(a) 极化曲线
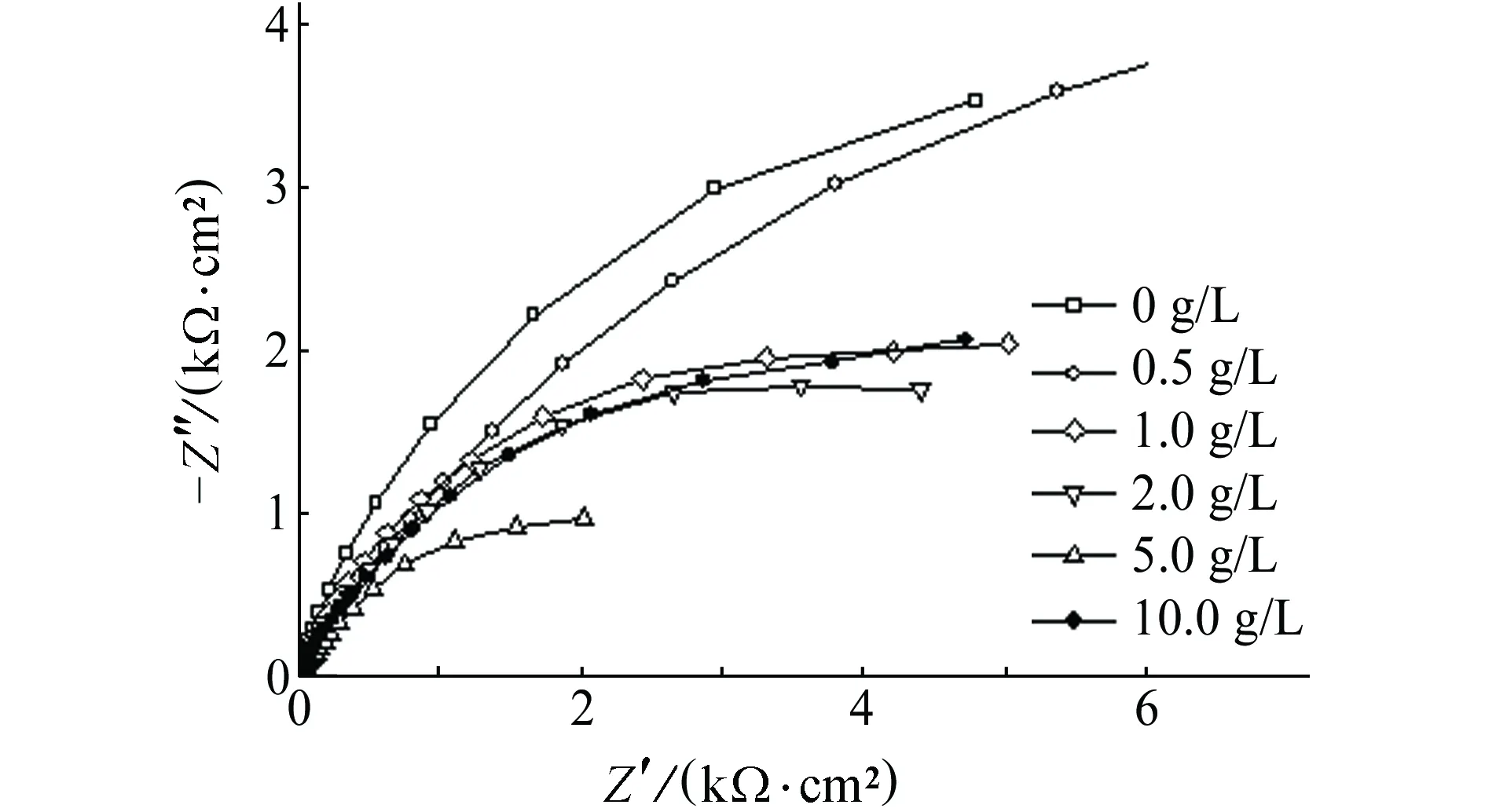
(b) 电化学阻抗谱图3 NaCl (10 g/L Cl-)溶液中SO42-含量对B30铜镍 合金极化曲线和电化学阻抗谱的影响Fig. 3 Effects of SO42- concentration on polarization curves (a) and EIS (b) of B30 copper-nickel alloy in NaCl (10 g/L Cl-) solution

拟合参数SO42-质量浓度/(g·L-1)00.51.02.05.010.0Jcorr/(10-7 A·cm-2)38.840.245.746.868.044.7Ra/(kΩ·cm2)15.3313.8711.9311.329.7312.40Rt/(kΩ·cm2)1.411.681.771.341.331.27
在不同SO42-含量的NaCl溶液中,B30铜镍合金的电化学阻抗谱如图3(b)所示。结果表明:B30铜镍合金的阻抗半径随着SO42-含量的增大先减小后增大,且当SO42-质量浓度大于等于1.0 g/L时,B30铜镍合金的容抗弧在低频范围逐渐趋平于直线。这表明B30铜镍合金表面局部发生点蚀。采用图2所示等效电路对电化学阻抗谱进行拟合,结果见表3。由表3可见:随着NaCl溶液中SO42-含量的增大,电荷传递电阻Rt和膜层电阻Ra先降低后升高。这表明当SO42-质量浓度为0~5.0 g/L时,随着SO42-含量的增大,金属表面膜的耐蚀性逐渐减弱,而当SO42-质量浓度为5.0~10.0 g/L时,随着SO42-含量的增大,金属表面膜的耐蚀性逐渐增强。
2.3 HCO3-与Cl-协同作用对B30铜镍合金腐蚀规律的影响
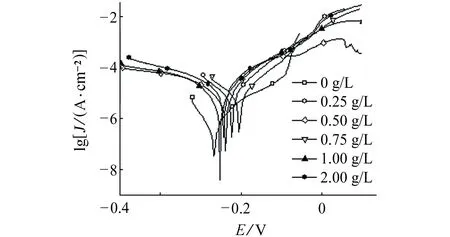
B30铜镍合金在HCO3-质量浓度分别为0,0.25,0.50,0.75,1.00,2.00 g/L的NaCl溶液(Cl-质量浓度为10 g/L)中的极化曲线如图4(a)所示。由图4(a)可见:当向NaCl溶液中加入HCO3-后,B30铜镍合金的极化曲线钝化区趋于消失,金属表面发生活性溶解腐蚀。对图4(a)的极化曲线进行拟合,拟合参数见表4。由表4可见:随着溶液中HCO3-含量的增大,B30铜镍合金的自腐蚀电流密度迅速升高,金属腐蚀速率逐渐增大。
(a) 极化曲线

(b) 电化学阻抗谱图4 NaCl(10 g/L Cl-)溶液中HCO3-含量对B30铜镍 合金极化曲线和电化学阻抗谱的影响Fig. 4 Effects of HCO3- concentration on polarization curves (a) and EIS (b) of B30 copper-nickel alloy in NaCl (10 g/L Cl-) solution
金属表面阳极溶解产生的Cu+易被溶液中的溶解氧氧化,生成Cu2+,当溶液中存在Cl-时,与其形成CuCl2,反应式为

(1)
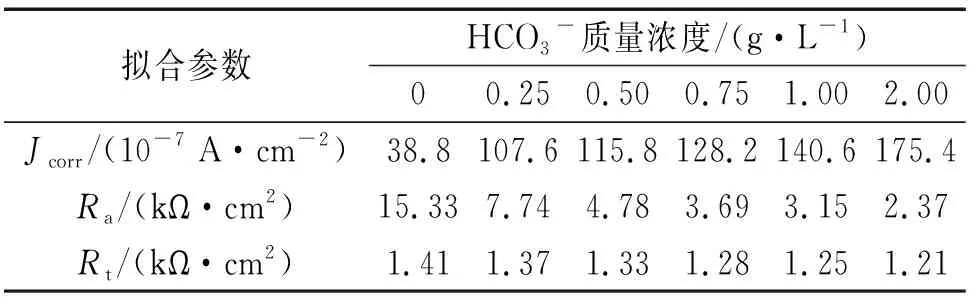
表4 图4中B30铜镍合金的电化学拟合参数Tab. 4 Fitted electrochemical parameters of B30 copper-nickel alloy in Fig. 4
溶液中HCO3-与CuCl2会发会生可逆的电化学反应

(2)
随着HCO3-含量的增大,可逆反应不断向右进行生成CuCO3。CuCO3会沉积在金属表面形成闭塞电池[17]。沉积物下由于缺氧成为电池阳极,而沉积物周边成为电池阴极。铜镍合金在酸性介质中会脱镍,而在中性、碱性介质中会脱铜[18]。HCO3-的加入使溶液偏碱性,在碱性条件下镍由于具有很强的钝化能力而性质较为稳定,合金表面会发生脱铜,致使金属阳极中的Cu不断发生活性溶解。向NaCl溶液中加入HCO3-后,阳极曲线钝化区消失,B30铜镍合金呈全面腐蚀状态,其腐蚀速率随HCO3-含量的增大而增大。
在不同HCO3-含量的NaCl溶液中,B30铜镍合金的电化学阻抗谱如图4(b)所示。由图4(b)可见:容抗弧趋向逐渐闭合的弧线,腐蚀受电荷传递过程控制,金属表面氧化膜遭到破坏丧失保护能力;且随着溶液中HCO3-含量的增大,B30铜镍合金的阻抗半径逐渐降低。通过等效电路拟合得到腐蚀过程的参数,见表4。由表4可知:当HCO3-质量浓度在0~2.00 g/L范围内,随着HCO3-含量的增大,由于上述竞争反应加速了金属/溶液界面的电荷转移,电荷传递电阻Rt和膜层电阻Ra逐渐降低,这表明金属表面氧化膜遭到破坏,B30铜镍合金表面膜的耐蚀性迅速降低。
2.4 地下咸水和海水中B30铜镍合金的腐蚀规律
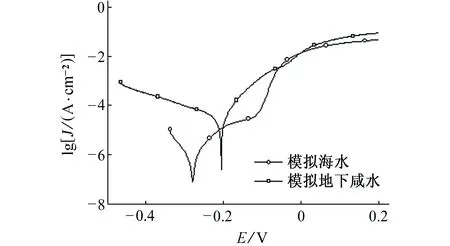
B30铜镍合金在模拟地下咸水(10.3 g/L Cl-,0.55 g/L SO42-,1.08 g/L HCO3-)与模拟当地海水(19.7 g/L Cl-,2.74 g/L SO42-,0.15 g/L HCO3-)中的极化曲线如图5(a)所示,极化曲线拟合结果见表5。通过对比可知:在模拟海水中B30铜镍合金的极化曲线存在较明显的钝化区,而在模拟地下咸水中则无明显钝化区;模拟地下咸水中B30铜镍合金的自腐蚀电流密度远大于其在模拟海水中的自腐蚀电流密度。这表明在模拟海水中B30铜镍合金表面氧化膜相对完整,对金属具有良好的腐蚀防护作用;而在模拟地下咸水中B30铜镍合金表面氧化膜遭到破坏,所以金属腐蚀速率远大于在海水中的腐蚀速率。
B30铜镍合金在模拟地下咸水和模拟当地海水中的电化学阻抗谱见图5(b)。通过对比可知:B30铜镍合金在模拟海水中的容抗弧在低频区域逐渐趋于45°角,表明此时金属表面存在较厚且致密的氧化膜,离子迁移过程受到极大抑制,腐蚀反应受扩散控制,因此B30铜镍合金在模拟海水中的耐蚀性较强;B30铜镍合金在模拟地下咸水中容抗弧在低频区域逐渐趋平于直线,这表明金属表面的氧化膜遭到点蚀破坏。一般认为点蚀初期,点蚀坑内外会同时进行反应速率相等的金属阳极溶解和氧的阴极还原反应[19]。随着反应进行,点蚀坑内氧逐渐耗尽,点蚀坑内金属继续溶解产生过多正电荷,点蚀坑外阴离子(如Cl-)迁移至点蚀坑内以保持电中性;同时随着金属氯化物水解使溶液pH降低,点蚀坑内 发生局部酸化作用,导致点蚀坑内金属阳极进一步溶解,使点蚀不断发展,B30铜镍合金的耐蚀性减弱。采用等效电路模拟B30铜镍合金在模拟海水和模拟地下咸水的电化学拟合参数,结果见表5。由表5可见:在模拟地下咸水中B30铜镍合金的电荷传递电阻和膜层电阻远小于其在模拟海水中的相应参数,这表明地下咸水对B30铜镍合金表面氧化膜的破坏作用比海水中更为严重。
(a) 极化曲线
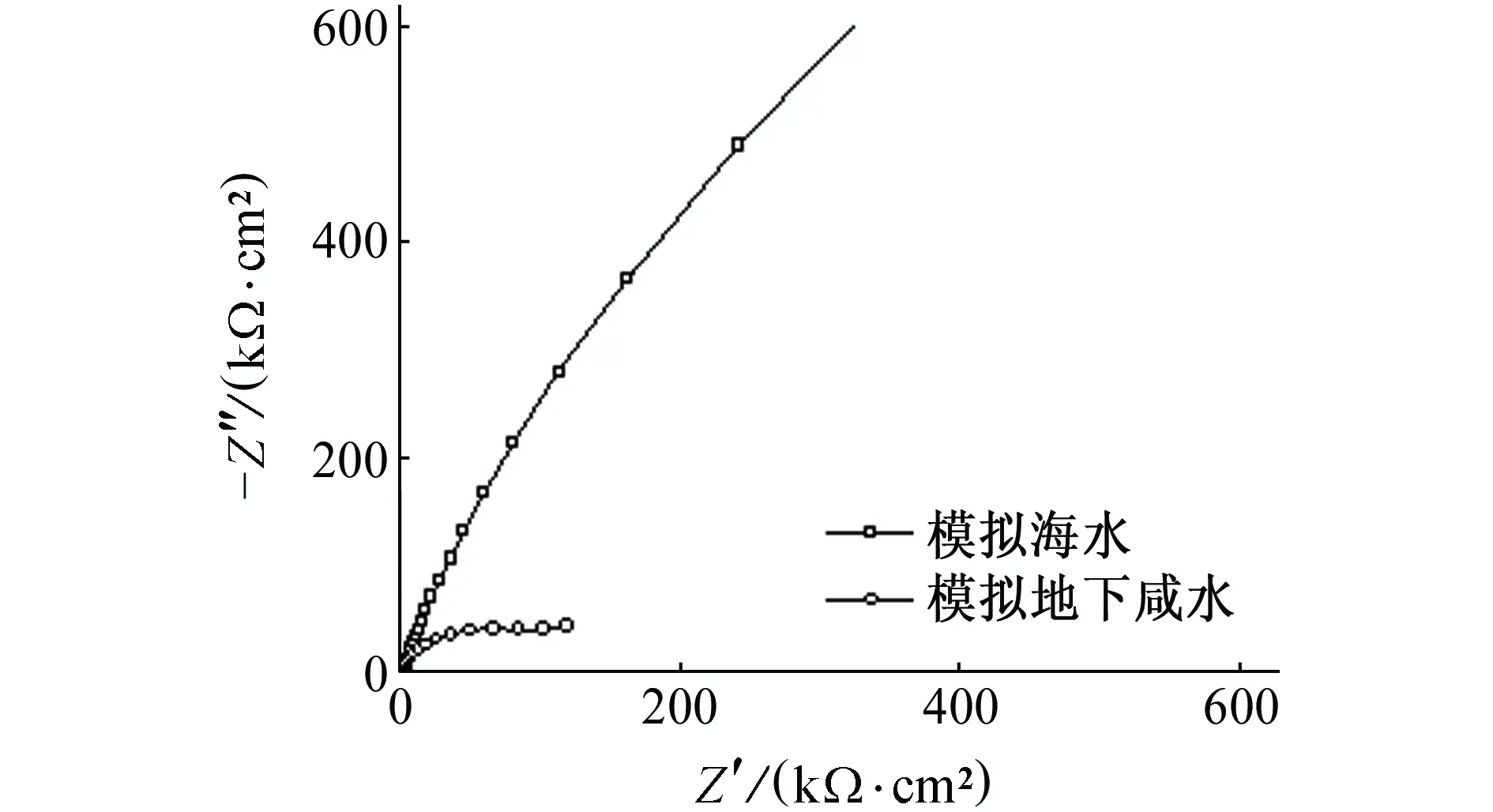
(b) 电化学阻抗谱图5 B30铜镍合金在不同水体中的极化曲线和 电化学阻抗谱Fig. 5 Polarization curves (a) and EIS (b) of B30 copper-nickel alloy in different water
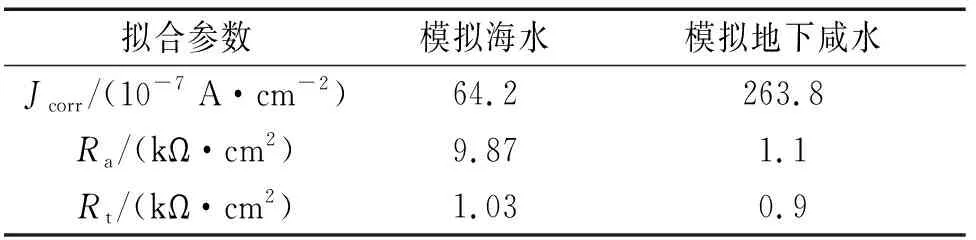
表5 B30铜镍合金在不同水环境中的 电化学拟合参数Tab. 5 Fitted electrochemical parameters of B30 copper-nickel alloy in different water
3 结论
(1) Cl-的存在导致B30铜镍合金表面氧化膜发生点蚀破坏;随着Cl-含量的增大,B30铜镍合金的腐蚀速率逐渐增大。
(2) 模拟地下咸水中SO42-(0~10.0 g/L)的加入加速了Cl-对B30铜镍合金表面氧化膜的点蚀破坏;且随着SO42-含量的增大,B30铜镍合金腐蚀速率呈现先增高后降低的趋势。
(3) 模拟地下咸水中HCO3-(0~2.00 g/L)的加入导致B30铜镍合金发生活性溶解腐蚀;且随着HCO3-含量的增大,B30铜镍合金的腐蚀速率逐渐增大。
(4) 由于地下咸水和海水成分中Cl-、SO42-和HCO3-的浓度差异,地下咸水对B30铜镍合金的腐蚀比海水对其造成的腐蚀更严重。

