靶向PDCD5-Caspase-3融合基因过表达对HepG2肝癌细胞增殖与凋亡的影响
胥丹,姜淮芜,蒲羽
(1.西南医科大学,四川 泸州 646000;2.四川绵阳404医院腹部外科,四川 绵阳 621000)
肝细胞癌(hepatocellular carcinoma,HCC)是目前临床常见恶性肿瘤之一,世界上癌症相关死亡的第二大肿瘤类型,世界每年肝癌新发病例52.3万例[1]。目前治疗手段有限,主要以放疗、化疗和分子靶向药物治疗为主,5年存活率<5%,预后不佳[2-3]。HCC发生与发展与肿瘤细胞凋亡关系密切,而诱导细胞凋亡的策略成为近年来晚期HCC治疗重点。PDCD5和Caspase-3蛋白是目前发现的细胞凋亡关键酶,调控细胞凋亡信号传导的中心环节,能促进细胞凋亡发生[4-5]。本研究通过慢病毒转染靶向PDCD5-Caspase-3融合基因过表达作用于人肝癌细胞HepG2,观察PDCD5和Caspase-3蛋白对HepG2肝癌细胞增殖和凋亡作用的影响,初步探讨其作为肝癌治疗潜在靶点的可行性。
1 材料与方法
1.1 实验动物与试剂
人HepG-2肝癌细胞(购自上海复祥生物科技有限公司),胰蛋白酶、DMEM无血清培养基和胎牛血清(购自美国Gibco公司),青霉素和链霉素(购自上海生物工程有限公司),CCK-8检测试剂盒、APCAnnexin V细胞凋亡试剂盒和蛋白提取试剂盒(购自南京凯基生物科技发展有限公司),鼠抗人单克隆PDCD5抗体、鼠抗人单克隆Caspase-3抗体(购自美国Acom公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗鼠IgG(购自美国Sigma公司),兔抗鼠β-actin单克隆抗体(购自美国Santa Cruz公司)。蛋白电泳仪为美国Bio-Rad公司产品。PDCD5-Caspase-3融合基因合成及转染用慢病毒均由上海吉凯基因公司提供。
1.2 PDCD5-Caspase-3融合基因构建及慢病毒包装
利用PubMed基因数据库查询PDCD5和Caspase-3基因CDS序列,设计相应融合基因序列,PCR扩增PDCD5-Caspase-3融合基因片段,将目的融合基因克隆到慢病毒GV358中,引物序列:正向5'-CCATCAGAGAGAAAACCGAAC-3',反向 5'-CCTCT TATAGTCCACTTATGTC-3',PCR反应条件为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,共循环40次,72℃延伸5 min,最后取适量菌液进行测序,测序结果与目的基因序列进行比对分析,测序结果与与目标序列完全一致。抽提Ubi-PDCD5-Caspase-3-SV40-EGFP质粒,采用二代自失活型慢病毒包装系统完成包装过程,将携带PDCD5-Caspase-3融合基因的GV358载体质粒、包装质粒pHelper 1.0和pHelper 2.0共转染239T细胞,转染48 h后,高速离心收集含慢病毒颗粒的239T细胞上清液,置于-80℃冰箱冷冻保存备用。
1.3 HepG-2肝癌细胞转染
HepG-2肝癌细胞株活性强,增殖旺盛,2~3 d即可传代1次,待培养细胞贴壁生长至培养瓶的80%~90%时,0.25%胰蛋白酶消化,离心收集,含10%DMEM培养基重悬,按照3×105个/ml种植24孔板中,每孔400 μl。按照吉凯公司推荐的HepG-2肝癌细胞最佳转染复数为100,设置3组:①实验组(5 μg/ml Polybrene+50 μl Ubi-PDCD5-Caspase-3-SV40-EGFP病毒上清液);②对照组(5 μg/ml Polybrene+50 μl阴性对照病毒上清液);③空白组(不加病毒上清液);37℃培养箱中孵育12 h后换液,继续培养。由于质粒中含有EGFP基因,本研究利用荧光显微镜和流式细胞仪检测实验组转染效率。
1.4 Western blot检测PDCD5和Caspase-3蛋白表达
转染细胞48 h后,离心收集5×105个各组细胞,PBS清洗3次,蛋白裂解液提取细胞蛋白,BCA法测定样品中总蛋白浓度,蛋白变性,SDS聚丙烯酰胺凝胶电泳分离蛋白,PVDF转膜80V 2 h,5%脱脂奶粉封闭lh,剪膜,加入1∶300稀释鼠抗人单克隆PDCD5抗体(一抗)和1∶500鼠抗人单克隆Caspase-3抗体(一抗),4℃孵育过夜,加入1∶400 HRP标记二抗室温孵育30 min,1∶1 000稀释β-Actin作为内参,在ECL显色系统中显色定影,AlphaEase FC软件分析显色的杂交条带。
1.5 CCK-8检测细胞增殖
HepG-2肝癌细胞转染后,以1×105个/ml种植96孔板,每孔100 μl,每组9孔,在转染24、48和72 h,各组均分别选取3孔检测细胞增殖情况,每孔加入CCK-8试剂10 μl,37℃,5%二氧化碳细胞培养箱中培养2 h,酶联免疫监测仪检测各孔吸光度(A)值,波长450 nm,参比波长为630 nm。每孔复测3次,取结果平均值行统计分析。
1.6 流式细胞仪检测细胞凋亡
按照APC-Annexin V细胞凋亡试剂盒说明书操作,细胞转染72 h后,PBS清洗2遍,胰酶消化,离心收集细胞,每管收集2×105个细胞,加入500 μl的Binding Buffer悬浮细胞,分别加入5 μl Annexin VAPC和5 μl Propidium Iodide混匀,室温避光反应30 min,流式细胞仪检测各组细胞凋亡率。
1.7 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较,方差齐性用LSD-t检验,方差不齐用Dunnett's T3法,P<0.05为差异有统计学意义
2 结果
2.1 细胞转染效率
转染12 h后,PBS清洗细胞2遍,流式细胞仪上样检测细胞转染率达到98.7%(见图1A),荧光显微镜下观察到满视野绿色荧光分布(见图1B),表明Ubi-PDCD5-Caspase-3-SV40-EGFP慢病毒能高效转染HepG-2肝癌细胞,能用于后续实验。
2.2 PDCD5和Caspase-3蛋白表达情况
转染72 h后,实验组、对照组和空白组PDCD5蛋白相对表达量分别为(0.427±0.094)、(0.171±0.059)和(0.202±0.077),各组PDCD5蛋白相对表达量比较,差异有统计学意义(F=6.100,P=0.036),实验组PDCD5蛋白水平较对照组或空白组均增加,对照组与空白组无差异。实验组、对照组和空白组Caspase-3蛋白相对表达量分别为(0.625±0.132)、(0.151±0.089)和(0.139±0.067),各组Caspase-3蛋白相对表达量比较,差异有统计学意义(F=8.969,P=0.017),实验组Caspase-3蛋白水平较对照组或空白组均增加,对照组与空白组无差异(P>0.05)。见图2。
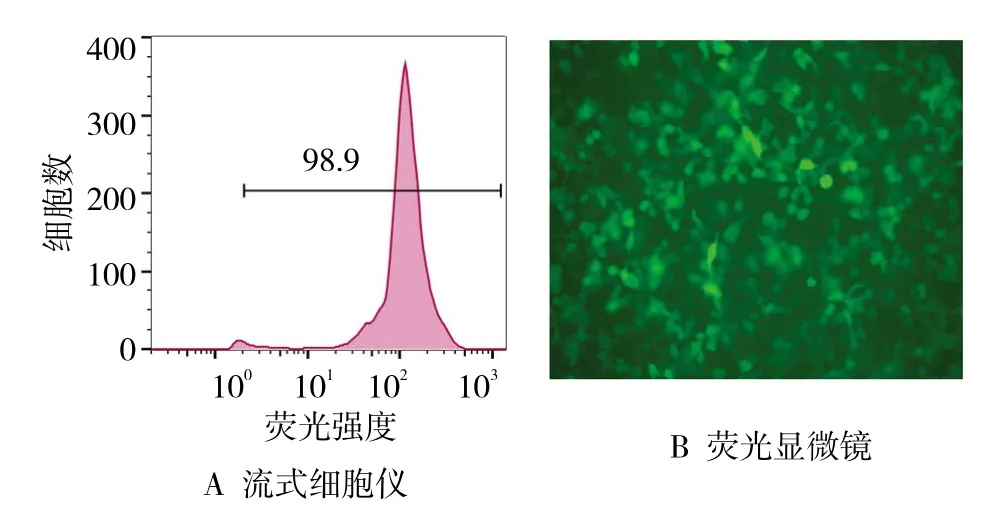
图1 细胞转染效率

图2 各组PDCD5和Caspase-3蛋白表达
2.3 细胞增殖变化
细胞转染72 h后,实验组细胞增殖能力较对照组和空白组降低,实验组、对照组和空白组OD值分别 为(1.19±0.23)、(2.18±0.51) 和(2.33±0.48),各组OD值比较,差异有统计学意义(F=5.509,P=0.044),实验组OD值较对照组或空白组减少,差异有统计学意义(P<0.05),对照组与空白组差异无统计学意义(P>0.05)。
2.4 细胞凋亡情况
转染72 h后,空白组细胞凋亡率为(2.33±1.02)%,对照组的细胞凋亡率为(2.94±0.81)%,实验组细胞凋亡率为(37.7±5.65)%,各组细胞凋亡率比较,差异有统计学意义(F=49.728,P=0.0184),实验组细胞凋亡率较对照组或空白组减少,差异有统计学意义(P<0.05),对照组与空白组差异无统计学意义(P>0.05)。见图 3。


图3 细胞凋亡率比较
3 讨论
近10年,全世界范围内HCC发病率上升。若HCC早期诊断(肿瘤直径<2 cm),予以手术切除,则生存率可达到70%[6]。然而,临床HCC患者就诊时已属癌症晚期,治疗效果较差,无法单靠手术切除治愈。与其他肿瘤类型发病机制类似,HCC发生发展与癌基因活化,抑癌基因失活,细胞增殖/细胞凋亡失平衡有关[7]。细胞凋亡是由基因控制的细胞自主的有序的死亡,由一系列促凋亡基因和抑凋亡基因调控,而肿瘤细胞抑凋亡基因活性增强,促凋亡基因活性降低,细胞趋向于永生化[8]。
在促凋亡蛋白家族中,PDCD5蛋白是我国率先报道的一种重要的促细胞凋亡相关因子[9]。已有报道表明,PDCD5在肿瘤组织中表达减少,通过与P53信号通路作用促进肿瘤细胞凋亡进程,有可能作为相关肿瘤诊断与治疗靶点[10-11]。研究表明,与正常组织比较,肝癌细胞中PDCD5 mRNA和蛋白质水平均较低,PDCD5表达与乙肝病毒感染、肿瘤数、淋巴结转移和肝癌患者存活时间密切相关,并可作为HCC患者总生存期和无病生存率的预测因子[12-13]。另外,PDCD5基因低表达常诱导其他多种促凋亡因子表达,维持肝癌细胞的化疗药物敏感性,增加抗肿瘤治疗效果[14]。另外,细胞凋亡信号通路传导依赖于下游效应蛋白-Caspase蛋白激活,活化Caspase在细胞中能够切割400多种功能蛋白底物,如Lamins、信号分子如蛋白激酶、骨架蛋白、DNA修复酶等,该重要蛋白质的降解和核酸酶的激活最终导致细胞凋亡。Caspase-3蛋白是细胞凋亡过程中最主要的终末剪切酶,也是细胞杀伤机制的重要组成部分。活性Caspase-3可作用于一些其他Caspase成员,并降解相应的胞浆胞核底物,诱导细胞凋亡,如果Caspase-3活性受到抑制,则出现细胞凋亡异常,从而引起肿瘤产生[15]。研究表明,肝癌细胞HepG2中Caspase-3蛋白活性及蛋白阳性表达率均显著低于正常肝细胞[16]。HUA等[17]证实,HCC分级越高,癌细胞分化越差,Caspase-3蛋白阳性表达率越低,提示Caspase-3蛋白表达水平与HCC恶性程度呈负相关。
在本实验中,基于Caspase-3和PDCD5蛋白在肝癌治疗与预后中重要作用,笔者利用基因重组技术设计一种能同时靶向过表达上述两种蛋白的融合基因。慢病毒载体可以将外源基因有效地整合到宿主染色体上,从而实现目的基因长期且稳定的表达,目前己成为表达外源基因常用载体形式之一。另外,常用的转染剂,如脂质体和质粒,细胞转染效率较低,且化学转染试剂通常存在较明显的细胞毒性[18]。相比较而言,慢病毒转染效率与细胞类型相关,一般可达50%~80%[19]。笔者利用人类免疫缺陷型病毒为基础发展起来的慢病毒GV358载体,转染HepG2肝癌细胞,流式细胞仪检测Ubi-PDCD5-Caspase-3-SV40-EGFP慢病毒转染效率高达98.9%,推测这种高转染效率与细胞类型密切相关,肿瘤细胞活性强,其转染率随之升高。成功转染后,蛋白水平证实转染后实验组PDCD5和Caspase-3蛋白表达明显增强。其次,笔者进一步观察抑制PDCD5和Caspase-3蛋白过表达对于人HepG2肝癌细胞增殖和凋亡率的影响,结果证实,与未转染和阴性序列转染组比较,实验组细胞增殖速度放缓,表明生长状态受到影响。同时,转染72 h后,实验组HepG2肝癌细胞早期凋亡率增加,且晚期细胞凋亡率和细胞坏死数量均增加。
综上所述,通过慢病毒转染靶向PDCD5-Caspase-3融合基因过表达作用于人肝癌细胞系HepG2,可增强PDCD5和Caspase-3蛋白表达,降低HepG2肝癌细胞增殖速度,促进HepG2肝癌细胞凋亡,因此有望作为肝癌治疗新型潜在靶点。

