遮光处理对微藻繁殖及其水质指标的影响
汤坤贤,宋 晖,姜德刚,孙元敏,蔡鹭春,陈 珊,涂武林
(1.自然资源部第三海洋研究所,福建 厦门 361005; 2.福建省海洋生态保护与修复重点实验室,福建 厦门361005; 3.自然资源部海洋生态保护与修复重点实验室,福建 厦门 361005; 4.自然资源部海峡西岸海岛海岸带生态系统野外科学观测与研究站,福建 漳州 363216; 5.山东大学,山东 济南 250100; 6.自然资源部海岛研究中心,福建 平潭 350400)
0 引言
近年来,大量富含氮(N)、磷(P)的废水排放使得水体中N,P 含量超标,导致了水体的富营养化频繁发生[1]。水体富营养化常导致微藻爆发性繁殖或聚集,严重时出现水华、赤潮等灾害[2-3]。 微藻不仅具有生长速率快、 光合作用效率高、 生物质产量高等特点,还具有高效净化废水中富含N,P 等污染物的功能[4-5],可起到净化水质的作用。
光照和营养是影响微藻生长繁殖的2 个重要生态因子[6-7]。光照直接影响藻细胞内的光合电子传递、代谢途径调控、 特异性酶的酶促反应和细胞的通透性等[8]。 有研究表明,较小的光照强度就可满足微藻的快速生长[2,9-10],但研究大多是在实验室较为理想的条件下开展,鲜见野外现场原位实验的报道。同时水中营养盐浓度过高也可造成微藻大量繁殖。对此,常在生态塘水面设置一定水面面积的生物浮床,用来净化水质及通过遮光影响浮游植物的繁殖。
为研究光照对微藻生长的影响,了解微藻生长过程中对水质的净化效果,同时为控制水体富营养化,在福建省南部一个海岛污水处理示范现场开展了现场遮光实验。 该生态塘中处理设施采用“厌氧—人工湿地—生态塘”的处理工艺,处理污水量为34 t/d,在调试运行过程中出现过微藻大量繁殖的情况。
1 材料与方法
1.1 试验材料与处理
取11 L 生态塘出口的水,经10 μm 的丝绢过滤后加50 L 人工湿地出水和50 L 井水混合均匀,再均分至48 个塑料桶 (用内径为16 cm 的排水管制作,高为12 cm)中,每桶水样体积约2.3 L。将直径为16 cm 的不透光圆形泡沫片切割成不同大小的面积(覆盖面积分别为0,20%,40%,60%,80%,100%)覆盖在塑料桶水面,共6 个实验组,每组有8 个同样面积的塑料桶,泡沫片的敞口向东,将桶置于生态塘边缘水中,桶的上缘高度略高于生态塘水面,保持桶中的水温与生态塘表面水温基本一致。
试验从9月22日下午17:00 开始至9月26日下午17:00 结束,共进行5 d。 试验期间白天每隔1 h监测1 次光强。 每天下午17:00 左右,对每个处理水样的温度、pH 值、DO、DO 饱和度、 盐度等指标进行现场速测。 并从每个实验组分别取2 桶水样回实验室,进行氨氮(NH3-N)、亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N)、无机磷(DIP)和叶绿素a(Chl-a)、细菌、病毒、粪大肠菌群等指标的室内分析测定。
对混合后的初始水样同样开展现场速测,并取2 份初始水样置于实验室内常温避光培养,至第5天试验结束时进行室内分析测定。
1.2 测定方法
(1)采用德国WTW 公司生产的速测仪对温度、pH 值、DO、DO 饱和度和盐度指标进行测定。
(2)从每桶水中分别取200 mL 水样置于500 mL玻璃瓶中,每个处理各取2 份。水样经0.45 μm 滤膜过滤后,采用分光光度计对水中NH3-N,NO2--N,NO3--N,DIP 进行室内分析测定;采用荧光光度计对Chl-a 进行测定。
(3)采用无菌采样袋现场采集水样后置于冰盒中,用滤膜法培养粪大肠菌群后对其测定。
(4)水样经10 μm 的丝绢过滤后,各取滤液2 mL 于2 支冻存管中,每支管中加20 μL 戊二醛,并用记号笔标明编号与日期,存于冰盒冷冻保存,采用流式细胞仪分析测定水样中的细菌和病毒。
2 结果分析
2.1 水体颜色
实验过程中水温为26 ~29 ℃,盐度为0.5 ~0.6。 不同遮光率的实验组水体颜色呈显著变化,试验第2 天各实验组的水体颜色开始变绿,水体颜色随遮光率增加逐渐变淡,而相同遮光率实验组的水色随时间变化逐渐加深,至第5 天实验结束时颜色最深,各实验组的水色也随遮光率增加逐渐变淡。
2.2 主要水质指标
(1)DO 浓度
试验开始后,DO 浓度随着水中微藻的繁殖迅速上升,第2 天不同遮光率的实验组水中DO 浓度变化见图1。
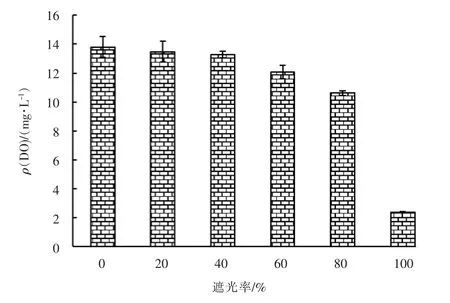
图1 第2 天不同遮光率的实验组水中DO 浓度变化
由图1 可知,试验第2 天DO 质量浓度最大值(14.30 mg/L)为遮光率为0 的实验组,DO 饱和度为186.0%;随遮光率的增大DO 浓度下降,透光的实验组水中DO 质量浓度均大于10.5 mg/L,DO 饱和度均大于135.0%; 遮光率为100%实验组水中DO 平均质量浓度为2.39 mg/L,DO 饱和度为31.0%,说明完全遮光的实验组水中DO 浓度明显低于其它透光实验组。 第3 天遮光率为0 ~60%的实验组水中DO质量浓度均大于15 mg/L,超过仪器的测量范围;遮光率为80%的实验组水中DO 质量浓度为12.35 mg/L,DO 饱和度为155.6%。试验第4 天和第5 天遮光率为0 ~80%的实验组水中DO 质量浓度均大于15 mg/L,遮光率为100%的实验组第4 天水中DO质量浓度为4.48 mg/L,DO 饱和度为57.3%;试验第5 天其水中DO 质量浓度为8.08 mg/L,DO 饱和度为104.5%。结果显示,在仪器测量范围内,不同遮光率的实验组水中DO 浓度随遮光率的增加而减小;相同遮光率的实验组水中DO 浓度随时间推移逐渐增大。
因DO 是由微藻光合作用产生,故DO 浓度与微藻密度呈良好的正相关关系,通过DO 浓度可反映微藻的繁殖状况,但由于DO 浓度过高超过仪器的测量范围,故无法全面反映试验过程的变化情况。
(2)pH 值
试验表明,pH 值与DO 浓度呈良好的正相关关系,pH 值的变化情况同样可以反映实验过程中不同遮光率的实验组中微藻的繁殖状况。 试验期间不同遮光率的实验组中pH 值变化见图2。
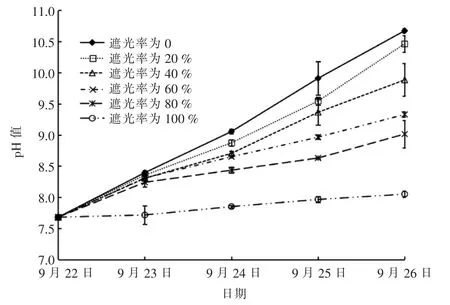
图2 试验期间不同遮光率的实验组中pH 值变化
由图2 可知,试验中各实验组中pH 值均呈逐日增大趋势; 遮光率为100%的实验组中pH 值最小,且与其它实验组中pH 值相差较大,其它实验组每天的pH 值随遮光率的增大而减小。 可见,试验时间越长,pH 值越大;遮光率越大,pH 值越小。
(3)NH3-N,NO3--N,NO2--N,DIN 浓度
试验期间不同遮光率的实验组水中NH3-N 浓度变化见图3。
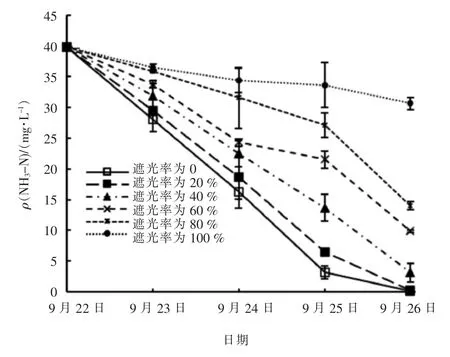
图3 试验期间不同遮光率实验组中NH3-N 浓度变化
由图2 和图3 可知,NH3-N 浓度变化趋势与pH值相反,各实验组水中NH3-N 浓度随时间推移逐渐下降,同时,遮光率越大的实验组水中NH3-N 浓度也越大。 试验第5 天,未遮光和遮光率为20%的实验组水中NH3-N 质量浓度均低于0.4 mg/L;遮光率为100%的实验组水中NH3-N 质量浓度略有下降,由试验开始时的39.80 mg/L 降至结束时的37.30 mg/L,但高于其它实验组。由于采用的遮光泡沫板仍有一定的透光效果,现场遮光率为100%的实验组水中有一定的光强,故其水中NH3-N 质量浓度有所下降,试验结束时为30.62 mg/L。
试验中各实验组水中DIN 浓度变化趋势与NH3-N 浓度变化一致,具体见图4。
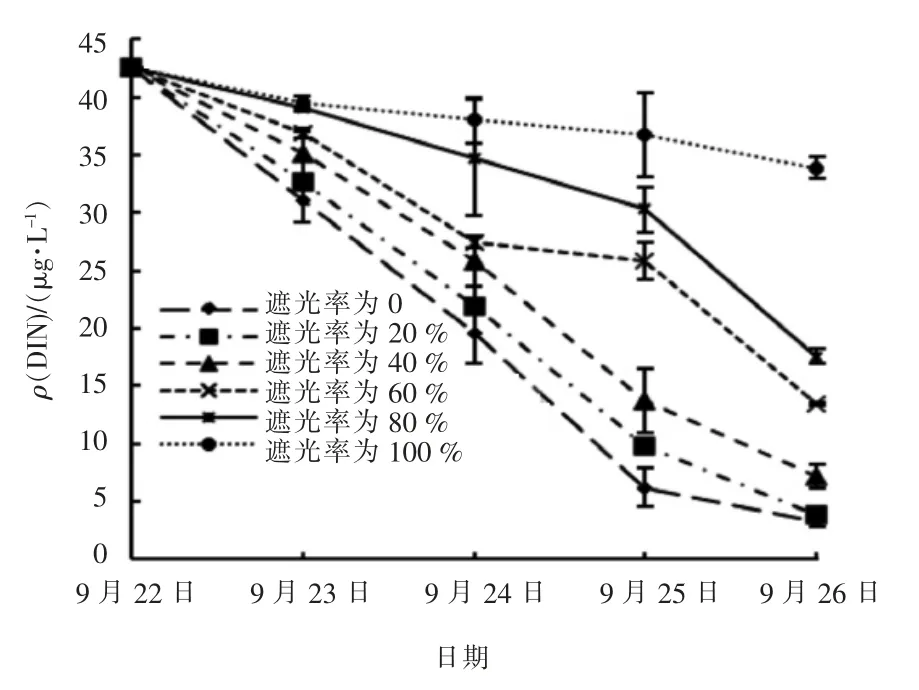
图4 试验期间不同遮光率的实验组DIN 浓度变化
由图4 可知,试验结束时不同遮光率的实验组水中DIN 浓度仍然较高,遮光率分别为0 和20%的实验组中DIN 质量浓度均大于3 mg/L。
污水中DIN 绝大部分由NH3-N 组成,根据监测结果,人工湿地出水中的NH3-N 浓度占DIN 浓度的99%以上,试验第2 天和第5 天遮光率分别为0 和100%的实验组中DIN 组成见图5。

图5 不同实验组中DIN 组成
由图5 可知,试验第2 天遮光率分别为0 和100%的NH3-N 浓度均占DIN 浓度的90%以上,说明遮光100%处理对水体中NO2--N 浓度影响不显著; 但在遮光率为0 时,NO2--N 浓度随着处理时间的延长而升高。2 组实验组水体中NO2--N 在DIN 中的占比均比NH3-N 和NO3--N 低。 随着微藻的迅速繁殖,NH3-N 被大量消耗浓度迅速下降,但NO3--N浓度变化较小,在试验第5 天时,遮光率为0 的实验组水中NO3--N 在DIN 中占比较大,而遮光率为100%的实验组水中NH3-N 在DIN 中仍占90%。
试验第2 天(9月23日)和第5 天(9月26日)不同遮光率的实验组中NO3--N 浓度变化见图6。
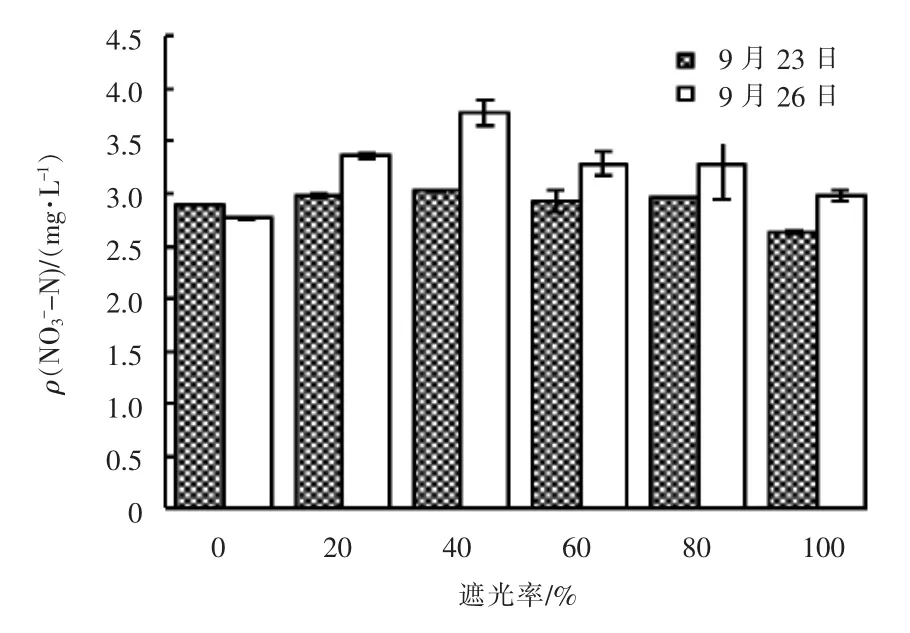
图6 不同遮光率的实验组中NO3--N 浓度变化
由图6 可知,试验第2 天和第5 天除遮光率为0 外的实验组水中NO3--N 浓度均略有升高。推断原因是由于水中DO 浓度升高,部分NH3-N 发生硝化反应向NO3--N 转化; 试验第5 天遮光率为0 的实验组水中NO3--N 浓度略低于第2 天,推断原因为该实验组水中NH3-N 被消耗殆尽后,微藻转而吸收NO3--N,才导致第5 天该实验组水中NO3--N 浓度比第2 天略低。
(4)DIP 浓度
试验期间不同遮光率的实验组中DIP 浓度变化见图7。
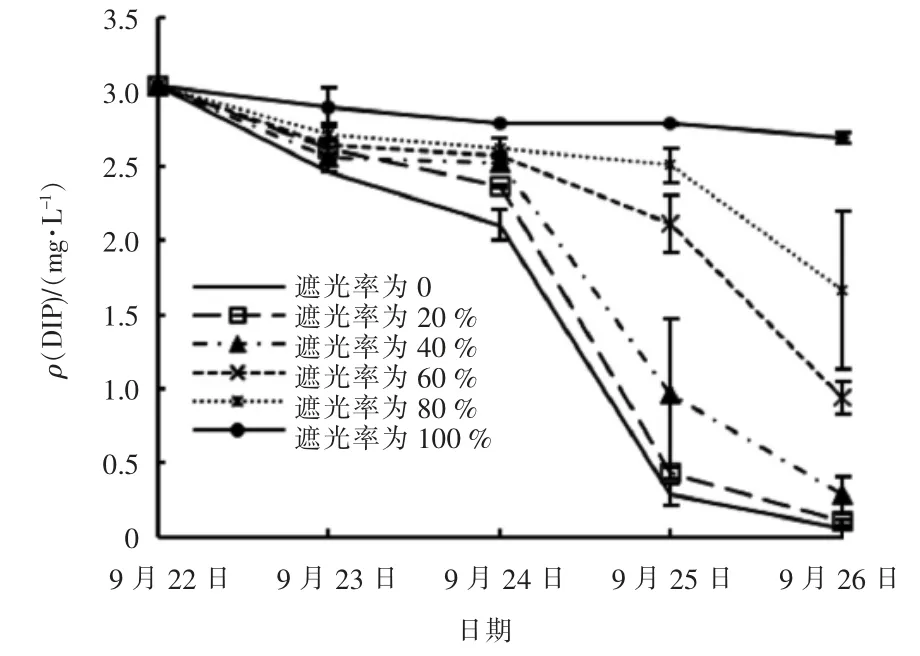
图7 不同遮光率的实验组中DIP 浓度变化
由图7 可知,试验期间不同遮光率的实验组中DIP 浓度与DIN 的变化趋势基本一致; 各实验组中DIP 浓度随时间推移呈逐渐下降趋势,且遮光率越大的实验组中DIP 浓度越高。
2.3 微生物指标
(1)Chl-a 浓度
试验期间不同遮光率的实验组中Chl-a 浓度变化见图8。

图8 不同遮光率的实验组中Chl-a 浓度变化
由图8 可知,各实验组中Chl-a 浓度随时间推移均呈上升趋势; 遮光率越大的实验组中Chl-a 浓度越小,遮光率为0 的实验组中Chl-a 浓度上升最快,说明光照对微藻繁殖起关键作用;遮光率越大Chl-a浓度越小说明遮光对微藻繁殖有一定的抑制作用;但各实验组在4 d 实验时间内微藻迅速大量繁殖并在1 d 内就达到水华指标,即使完全遮光仅有微弱光线透过泡沫遮光板的实验组水中第5 天的Chl-a质量浓度仍达到200 μg/L 以上,说明遮光处理对抑制微藻繁殖的作用有限,少量光照即可满足微藻的大量繁殖需求并形成水华。
(2)细菌丰度
试验前(9月22日)和第5 天实验结束时(9月26日)细菌丰度的对比见图9。
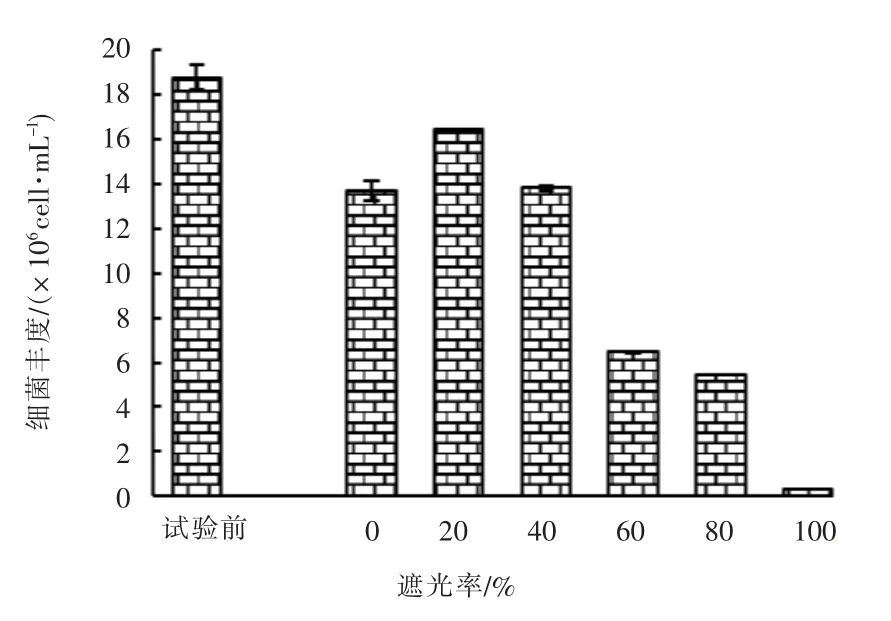
图9 试验前、后不同遮光率的实验组中细菌丰度对比
由图9 可知,试验前各实验组中细菌丰度均较大,试验结束时透光的实验组中细菌丰度较大,遮光率为0 ~40%的实验组中细菌丰度大于遮光率为60%~80%的实验组,遮光率为100%的实验组中细菌丰度显著低于其它实验组。 推断原因为试验前的细菌主要来源为试验用水的人工湿地出水中,由于人工湿地出水中DO 浓度极低,其中的细菌主要为厌氧菌或兼性细菌。试验开始后,随着水中DO 浓度的升高,厌氧菌不适应生长的环境而大量死亡,所以导致遮光率为100%的实验组中细菌丰度显著下降; 其它实验组中细菌丰度升高与微藻的大量繁殖有关,微藻吸收了水中的NH3-N,DIP 等无机营养盐,在生长过程中释放出有机物也促进了好氧细菌大量繁殖。 同时微藻死亡后也成为细菌繁殖的载体和营养来源。因遮光率为100%的实验组中Chl-a 浓度一直明显低于其它实验组,故其细菌丰度也明显低于其它实验组。
(3)病毒丰度
试验前(9月22日)和第5 天试验结束时(9月26日)病毒丰度对比见图10。 由图10 可知,试验前各实验组中病毒丰度较大,试验结束时遮光率较小的实验组中病毒丰度总体大于遮光率较大的实验组。 推断原因为试验前实验组中病毒丰度大的水样可能来自试验用水中的人工湿地出水; 遮光率较小的实验组中病毒丰度大可能与其实验组中微藻密度和细菌丰度较大有关; 遮光率较小的实验组中微藻密度和细菌丰度也较小。
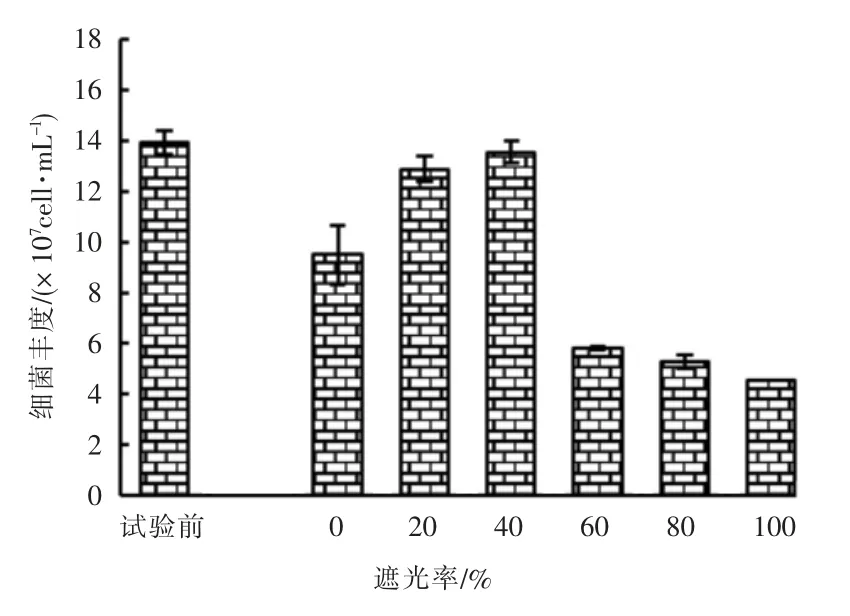
图10 试验前、后不同遮光率实验组中病毒丰度对比
(4)粪大肠菌群丰度
试验前、 后各实验组中粪大肠菌群丰度的对比见图11。
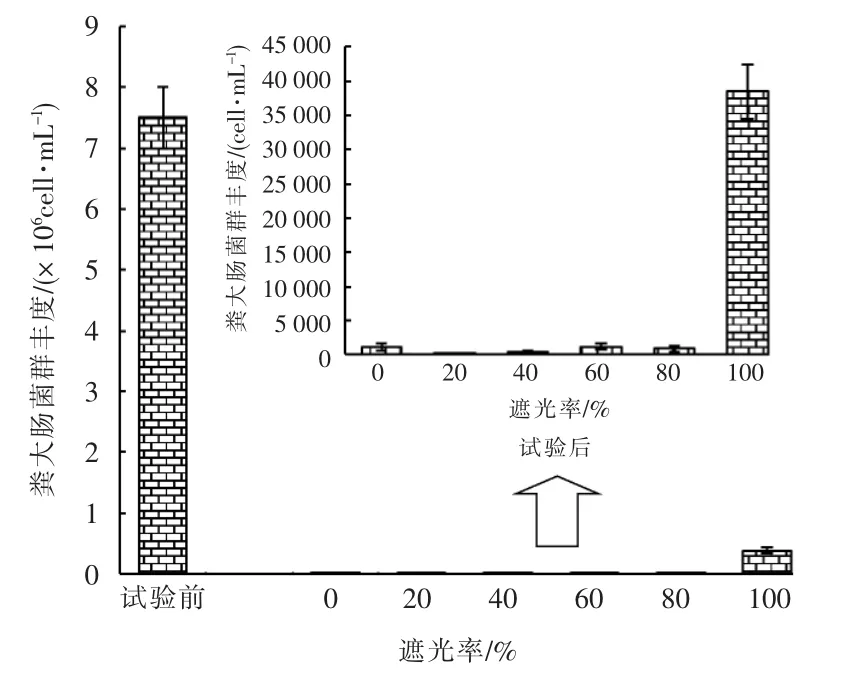
图11 试验前、后不同遮光率的实验组中粪大肠菌群丰度对比
由图11 可知,试验前各实验组中粪大肠菌群丰度远大于试验结束时的丰度。 不同遮光率的实验组中完全遮光的实验组中粪大肠菌群丰度显著高于其它实验组,其它组中粪大肠菌群丰度与遮光率的关系并不显著,与图10 的病毒丰度相关性一般,相关系数r 为-0.517,推断原因为病毒中包含其它细菌病毒和藻病毒,而粪大肠菌群中病毒仅占少量无法充分得到体现。 但粪大肠菌群丰度与图9 中的细菌丰度呈较好的负相关关系,相关系数r 为-0.723,推断原因为发生水华后其它细菌的大量繁殖对粪大肠菌群的存活起了抑制作用。
3 讨论
3.1 遮光对微藻繁殖的影响
光是藻类进行光合作用的必要条件,缺乏光照藻类的光合作用将无法进行。 光照度可影响藻类Chl-a 的合成以及藻类酶的活性,从而影响微藻的光合作用[11]。 当光照度高于藻类光合作用的光饱和点,其变化对藻类光合作用强度影响不大,光照度过高反而使微藻细胞的光系统I (PSI) 和光系统II(PSII)受到破坏,引起光抑制现象,导致藻类的光合速率不再增加,甚至减弱、停止[12],水体中DO 浓度值降低。当光照度小于藻类的光饱和点时,随着光照度的减小藻类的光合作用强度减弱[11],水体中DO浓度值也逐渐降低。
研究发现,水中微藻主要由绿藻组成,其次为硅藻。绿藻的光饱和点较高可适应高的光照度,一般微藻最大繁殖速率的光照度小于光饱和点,在较低的光照度下仍可保持较快的繁殖速率。 如铜绿微囊藻的光饱和点对应的光照度约为25 000 lx,光照度为45 000 lx 时仍无明显的光抑制现象[12],适宜生长的光照度为6 000 lx,光照度小于1 000 lx 时对铜绿微囊藻生长才有明显抑制[8]。在自然条件下上午和下午的光照度较低,遮光对抑制微藻繁殖有一定效果。但藻类光合作用的光补偿点对应的光照度很低,一般低于2 000 lx,白天无论是晴天还是雨天,藻类均可进行有效的光合作用,在光照度较低情况下,遮光率为80%的实验组中Chl-a 浓度依然很高,因此,单纯依靠遮光抑制微藻繁殖较难。 在工程应用中还可采用改善水体流动性等措施抑制微藻生长[13]。
3.2 微藻对富含N,P 污染物去除的影响
藻类的吸收、 硝化作用等因素影响着水中不同价态的无机氮浓度[13]。 微藻吸收利用氮的能力由高到低依次为NH3-N >(NH2)2CO-N >NO3--N >NO2--N,微藻在优先吸收完铵盐的情况下才可吸收别的含氮物质[14]。 污水中主要污染物是NH3-N,在试验开始时,通过微藻的快速吸收,遮光率为0 的实验组中NH3-N 质量浓度为40 mg/L ,仅仅4 d 后NH3-N 质量浓度就降至0.3 mg/L 以下。试验结果表明,微藻吸收可有效降低污水中NH3-N 浓度。藻类直接吸收是生态塘中去除NH3-N 的一种主要途径[1]。
遮光对藻类繁殖和对NH3-N 的吸收与转化影响很大。遮光率为0 的实验组光照充足,微藻大量繁殖并吸收NH3-N,在吸收利用完水体中剩余铵盐后则开始吸收NO3--N 等其它含氮物质[15],试验第5 天遮光率为0 的实验组中NH3-N 浓度急剧下降,NO3--N在DIN 中占比最大,NO3--N 浓度也较其它实验组低。 而遮光率为100%的实验组中微藻密度较低,NH3-N 浓度仍然较高,在DIN 中占比达90%,推断原因是由于硝化作用的影响,各实验组中NO3--N,NO3--N 浓度总体呈增加趋势,由图6 可知,试验结束时的NO3--N 浓度略比第2 天的浓度高,说明有部分NH3-N 通过硝化作用转化为NO3--N。 而试验结束时遮光率为0 的实验组中NO3--N 浓度最低,推断原因是由于微藻在NH3-N 缺乏的情况下转而吸收NO3--N。
DIP 浓度的变化趋势与DIN 基本一致,各实验组中DIP 浓度随试验时间推移呈逐日下降趋势,遮光率越大的实验组中DIP 浓度越高。 这是因为微藻的生长需要大量养分,微藻吸收废水中多余P 的能力很强[16-17]。 微藻对废水中P 的吸收和回收取决于多种因素,包括磷酸盐浓度、光照和温度[18]。 当外部磷酸盐浓度较高时,微藻细胞中P 的比例也较高。光照对细胞中P 吸收和生物P 浓度也有显著影响,微藻吸收P 主要通过光合作用获得需要的能量。此外,光照强度也影响聚磷酸盐的积累,光照强度越大,微藻在初始阶段积累的酸溶性聚磷酸盐也就越多[16]。故各实验组中DIP 浓度随时间呈逐日下降趋势,遮光率越大的实验组中DIP 浓度越高。
3.3 微藻对去除粪大肠菌群的影响
研究发现,利用微藻的光合作用在去除污水中N,P,重金属和营养物质的同时,也将对水体中的病原体、细菌等有害生物造成影响使其死亡[4,11,19]。粪大肠菌群属于兼性厌氧细菌,主要生活在厌氧或低氧环境中。 由于完全遮光情况下微藻通过光合作用产生的氧气有限,有利于粪大肠菌群的生存,所以完全遮光的实验组中粪大肠菌群丰度显著高于其它实验组。 但随着遮光率的下降,微藻光合作用效率提高,使得水中DO 含量升高,导致粪大肠菌群的活性下降,部分因无法适宜环境而逐渐死亡。 由图9 与图11 可知,在试验结束时细菌丰度和粪大肠菌群丰度呈明显的负相关关系,推测其它细菌的大量繁殖,特别是大量好氧细菌的繁殖对粪大肠菌群的存活造成抑制作用,加快粪大肠菌群的死亡。 此外,孔凡蛟等[11]提出微藻在进行光合作用时可使pH 值升高,从而对细菌产生危害导致粪大肠菌群的死亡。由图10 可知,其它病毒如噬菌体的入侵也可导致粪大肠菌群等其它细菌的裂解死亡,推断原因是因为噬菌体利用细菌体内的核酸和蛋白质合成自身的核酸和蛋白质外膜,从而导致细菌裂解死亡[11]。
4 结论
(1)在光照、营养盐和水体稳定性等适宜条件下,微藻可迅速大量繁殖形成水华。由于水中营养盐浓度越大,形成水华后的Chl-a 浓度也越大,故污水生态化处理应控制排入生态塘的污水中营养盐浓度,以避免发生严重的水华现象。
(2)遮光对微藻繁殖有一定抑制效果,但较少的光照也可满足微藻快速繁殖并形成水华,工程上单独依靠遮光控制微藻大量繁殖难度很大,需和其它措施组合应用共同抑制水华的暴发。
(3)虽然微藻快速生长对水中的NH3-N,DIP 和粪大肠菌群等有良好的去除效果,但控制生态塘中微藻适宜的含量对净化水质有良好的辅助作用。

