微流控芯片上循环肿瘤细胞高效率分选研究
申少斐, 齐永红, 张 璇, 寇丽莎, 王德富, 牛颜冰*
(1.山西农业大学生命科学学院,山西太谷 030801;2.山西省果业工作站,山西太原 030001)
恶性肿瘤是严重威胁人类健康和生命的重大疾病之一。90%以上的肿瘤患者由于早期阶段不能及时发现肿瘤转移而错失最佳治疗时机,最终导致死亡[1 - 2]。肿瘤转移是指具有转移潜能的恶性肿瘤细胞从原发部位,经淋巴管、血管或体腔等途径,到达其它部位继续生长的过程[3 - 4]。传统观念将恶性肿瘤侵袭和转移视为晚期事件,但近些年的研究认为其为早期事件[3]。因此,肿瘤侵袭和转移的早期检测对肿瘤治疗和预后尤为重要,也是当前肿瘤患者的迫切期望。然而传统的活体组织检测不能在早期阶段及时准确的预判肿瘤转移[5 - 6],因此,需要研究更为精准的检测技术来获得肿瘤转移的讯息。
近来,已证实外周血液中循环肿瘤细胞(Circulating Tumor Cell,CTC)在肿瘤转移过程中起关键作用,其数量的动态变化与肿瘤患者的临床分期、肿瘤分化程度及预后密切相关[7 - 8]。将外周血中CTC表达水平作为肿瘤的“液体活检”指标,不仅有助于预判肿瘤细胞是否发生转移,便于及时治疗,减少死亡发生;而且对恶性肿瘤的病情检测、治疗和预后等具有重要意义。然而常规的影像学、病理学和血清学等技术很难检测到CTC,其主要瓶颈在于外周血中CTC含量极低,每10亿个血液细胞中可能仅含有1~100个CTC[4 - 8]。所以,对其进行提前分选是必不可少的步骤。
近些年,微流控芯片技术已在生命分析研究中广泛应用,其精确操控细胞的特点为CTC分选提供了新的有力工具[9 - 10]。目前分选技术主要分为两大类:主动式分选技术和被动式分选技术[10]。主动式分选技术是指对分选对象提供额外的力场来实现细胞分选,具体分为电场分选[14]、磁场分选[15]、声波分选[8,16]和光分选[17]等。主动式分选技术灵敏度高,稳定性好,但同时伴随着设备昂贵、操作难度大、芯片制作复杂、样品处理通量低和容易对生物样品产生伤害等缺点。不同于依赖外场作用力的主动式分选技术,被动式分选技术则完全依靠管道设计的特殊结构和流体动力学效应来实现细胞的分选。具体可分为挤压流分选[18]、空间位阻分选[19]、亲和性分选[20]和惯性微流分选[21]等。这些技术不需要额外的力场,使得芯片操作方法和芯片制造较为简单。其中,惯性微流分选还展现出无需抗体标记(避免出现假阳性或假阴性结果)、处理通量高、集成性好、灵敏度高等优点[22]。这些优点使得惯性微流控技术为血液中CTC的高效分选研究提供了一种新的有力工具。
本研究将高通量的惯性微流方法与高回收率的微结构方法结合,发展了一种新型CTC分选微流控芯片。该装置首先通过惯性微流分离区域移除大量的血液细胞,继而通过等腰梯形微柱阵列栏杆进行二次分离,最终实现CTC的高通量、高回收率和高活性的分离。对比于传统的过滤方法,本研究所设置的空间位阻结构还能够有效地避免堵塞或拥堵问题,由于传统过滤方法的流动方向是垂直于过滤结构的,容易导致一些较大的样品不能穿过微结构而堵塞其流动路线[23]。而本芯片空间位阻区域中样品的流动方向几乎是与过滤栏杆平行的,极大地避免结构堵塞问题,为长时间稳定过滤样品和建立新型的细胞过滤方法提供了新的技术手段。
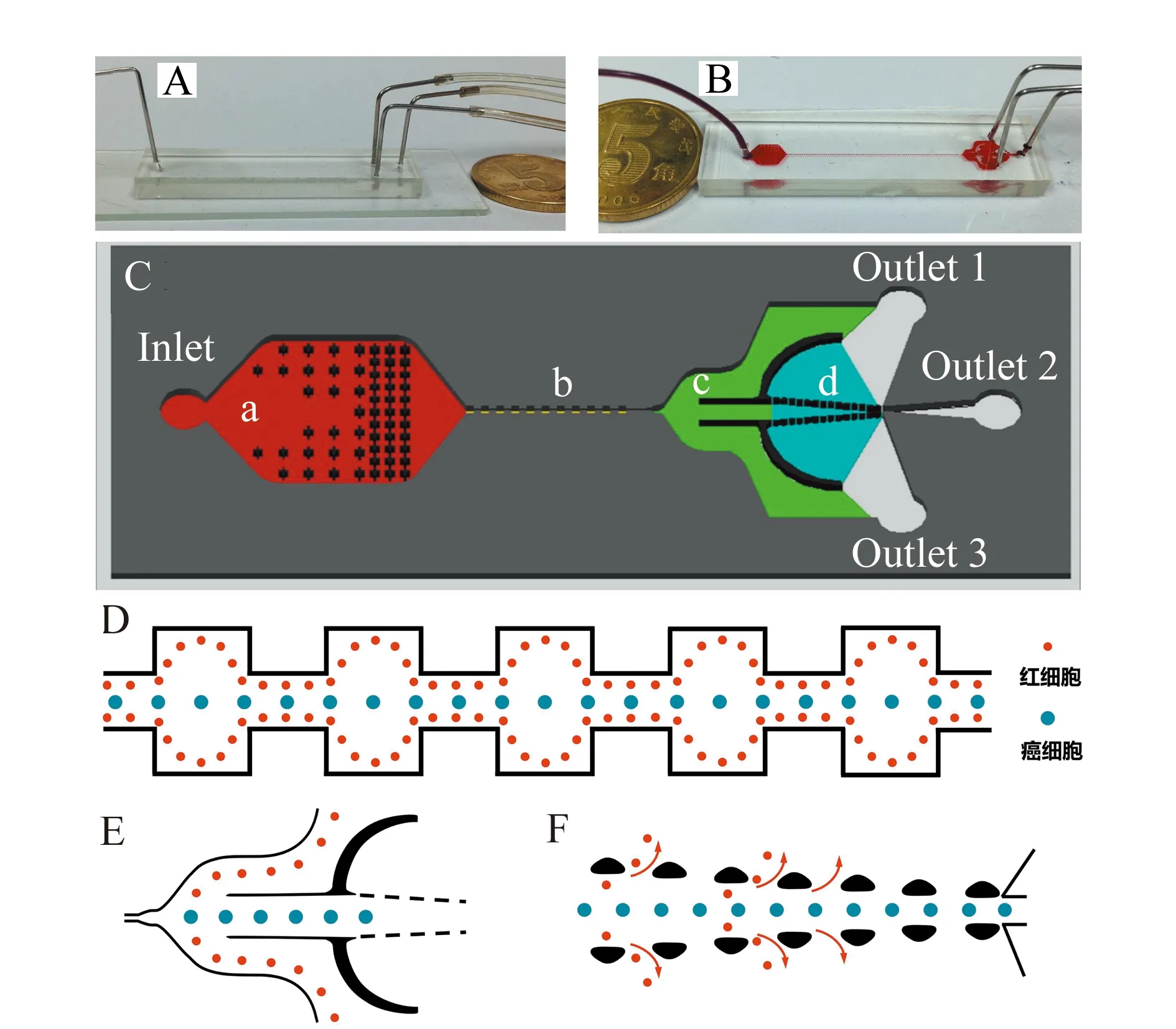
图1 微流控芯片结构和功能机理图。(A)微流控芯片实物图;(B)灌注红色染料后微流控芯片实物图;(C)基于空间位阻和惯性微流对血液中循环肿瘤细胞进行分离的微流控芯片示意图(芯片包括四种功能区域:过滤区域(a)、惯性聚集区域(b)、惯性分离区域(c)和空间位阻区域(d));(D)惯性聚集区域功能详细示意图;(E)惯性分离区域功能详细示意图;(F)空间位阻区域功能详细示意图Fig.1 Structural and functional mechanism of the microfluidic device.(A) The photograph of the microfluidic chip;(B) The photograph of the microfluidic chip after injecting red dyes;(C) Schematic diagram of the designed microfluidic device for CTC isolation using steric hindrance and inertial microfluidics(The device comprised four functional regions:filter region(a) inertial focusing region(b) inertial separation region(c) and steric hindrance region(d));(D)Detailed schematic diagram of inertial focusing region;(E)Detailed schematic diagram of inertial separation region;(F)Detailed schematic diagram of steric hindrance region
1 实验部分
1.1 主要仪器、试剂与材料
WS-400B-6NPP/LITEXI型旋转涂膜仪(美国,Laurell Technologies公司);LSP4-4A型微量注射泵(河北保定兰格恒流泵有限公司);DHG-9030A型鼓风干燥箱(上海精宏实验设备有限公司);BL-220H型分析天平(日本,岛津公司);H-8100型透射电子显微镜(日本,日立公司)。
聚二甲基硅氧烷(Polydimethyliloxane,PDMS)、固化剂购自美国Momentive Performance Materials公司;DMEM高糖培养基、RPMI-1640培养基、胎牛血清(Foetal Bovine Serum,FBS)、胰蛋白酶和CellTracker活细胞荧光染料,均购自Invitrogen公司;L-谷氨酰胺购自Amresco公司;吖啶橙(Acridine Orange,AO)和碘化丙啶(Propidium Iodide,PI)均购自Sigma公司;人源性乳腺癌细胞(MCF-7)和人源性宫颈癌细胞(HeLa)均购自中国科学院上海细胞库;人全血,从一位健康的志愿者身上采集,加入含有抗凝血剂的试管中,保存在4 ℃冰箱中。光掩膜由深圳美精微光电有限公司制作;其他试剂均为国产分析纯。本实验所用细胞培养相关的溶液均进行无菌处理。
1.2 实验方法
1.2.1芯片制备本实验使用的微流控芯片采用AutoCAD(AutoCAD 2007,Autodesk Inc.)软件绘制和设计,设计完成后由深圳美精微光电有限公司制备光掩膜。随后利用阳性光刻胶(AZ 50XT)制作模板微结构,进一步采用模塑法中的软刻技术制备微流控芯片,并采用PDMS部分固化法封接芯片。图1A和1B清晰的展示出已制备完成的微流控芯片。
1.2.2细胞染色本实验采用AO/PI双染色法,分析两种循环肿瘤细胞的活性,并利用细胞活性荧光染料(CellTracker Green CMFDA和CellTracker Orange CMRA)标记肿瘤细胞,观察其生长和增殖状态,具体方法如下: (1)细胞活性分析:首先除去培养基,用磷酸盐缓冲溶液(PBS)清洗,然后取500 μL AO的染液(20 μg/mL),用PBS定容至2 mL,配制成终浓度为10 μg/mL的溶液,放入培养皿中室温下孵育10 min;再将PI染液用PBS配制成相同的终浓度溶液,放入培养皿室温下孵育10 min;用荧光显微镜观察。(2)活细胞染色:首先除去培养基,然后取适量CellTracker工作液(10 μmol/L,37 ℃预热)孵育40 min;弃染液,添加已预热(37 ℃)的新鲜DMEM溶液,继续培养30 min。最后制备适宜浓度的细胞悬液。
1.2.3图像获取与分析粒子运动荧光图片通过荧光倒置显微镜(OLYMPUS,CKX41)和配套的CCD图像采集系统(OLYMPUS,DP73)来拍摄。图片以及数据分别通过Image-Pro© Plus 6.0(Media Cyternetics,Silver Spring,MD),origin 9(origin Inc.),和 SPSS 12.0(SPSS Inc.)软件来处理和分析。图中的结果和误差线通过平均值±标准偏差来表示。
1.2.4分离效率计算公式循环肿瘤细胞回收率和富集率的计算公式如下所示:

(1)

(2)
其中,noutlet 1代表从出口1收集的血细胞数量,ninlet代表初始灌注时血细胞的数量,Routlet 1代表出口1收集的癌细胞数量与血细胞数量的比值,Rinlet代表初始灌注时癌细胞数量与血细胞的比值。
2 结果与讨论
2.1 芯片设计原理

图2 四种功能区域(过滤区域(A)、惯性聚集区域(B)、惯性分离区域(C)和空间位阻区域(D))的扫描电镜(SEM)图(标尺分别为400 μm(A)、90 μm(B)、250 μm(C)、50 μm(D))Fig.2 SEM images of four functional regions(filter region(A),inertial focusing region(B) inertial separation region(C) and steric hindrance region(D))(Scale bar:400 μm in Fig.2A,90 μm in Fig.2B,250 μm in Fig.2C,and 50 μm Fig.2D)
如图1C所示,芯片包括四种功能区域:过滤区域(a)、惯性聚集区域(b)、惯性分离区域(c)和空间位阻区域(d)。过滤区域通过十字形结构的设置(图2A),可以有效防止聚集的细胞或外来碎片堵塞微管道,是处理高通量血液样品的关键步骤。惯性聚集区域是由120个收缩/扩张管道单元组成,总长为3.6 cm。每个收缩扩张管道长度均为150 μm,其中扩张管道的宽度为180 μm,收缩管道的宽度为60 μm(图2B)。细胞在一连串的收缩扩张管道运动中,能够形成不同运动轨迹[11],较大体积的癌细胞可以聚焦在中间,较小体积的血细胞会分布在两边(图1D)。惯性分离区域的主通道是由两个侧通道和一个中央通道组成(图2C),其中两个侧通道分别与出口1和出口3相连接,用于移除小尺寸的细胞(血细胞)。中央通道与出口2相连接用于收集大尺寸的靶细胞(CTC)(图1E)。空间位阻区域包含周期性的相互具有固定间隔的等腰梯形微柱阵列栏杆(图2D),具体设置参数如表1和图3所示。这些微柱阵列的设置则可进一步筛选不同体积大小的细胞,实现肿瘤细胞的二次富集(图1F)。

图3 微流控装置中空间位阻区域的结构示意图(放大图片展示出等腰梯形微柱阵列的设计图,更详细的设计参数如表1所示)Fig.3 Schematic diagram of the steric hindrance region in the microfluidic device(The amplifying image shows the diagram of isosceles trapezoid-shaped pillar array,more detailed design parameters can be found in Table 1)
2.2 惯性微流分离细胞
本实验分别将人源性乳腺癌细胞(数量为~50 cells/mL,直径为18.8 ± 2.3 μm),以及人源性宫颈癌细胞(数量为~50 cells/mL,直径为14.6 ± 2.8 μm),添加到2%血细胞比容(~2.64 ×108cells/mL)的血液中来模拟全血中的低丰度肿瘤细胞样品(循环肿瘤细胞与血细胞比率为~1/107)。人类血细胞主要包括红细胞和白细胞。红细胞直径6.0~8.5 μm,厚度为1.8~2.8 μm,呈双凹圆盘状,具有高度变形性;白细胞近乎球形,直径为7.0~20 μm,也具有可变形性质。大部分血细胞的直径大小都要小于所要灌注的癌细胞直径[12]。
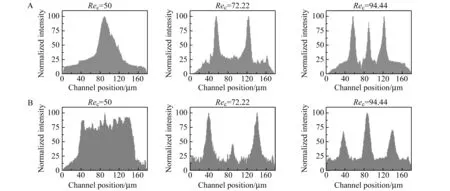
图5 不同Rec条件下细胞运动轨迹分析结果图Fig.5 Analytical results of cell trajectories under different Rec

图4 在不同Rec下惯性聚焦区域(A)和惯性分离区域(B)中的细胞运动轨迹(红色虚线被用于分析相同纵向位置的细胞分布情况,分析结果分别在图5中展示出来(标尺为100 μm))Fig.4 Effects of Rec on cell trajectories in the inertial focusing region(A) and separation region(B)(The red dotted lines were used to analyze cell distributions at the same longitudinal positions.Analytical results are listed in Fig.5A,corresponding to Fig.4A;Fig.5B,corresponding to Fig.4B,respectively(Scale bar:100 μm))
然后将癌细胞和血细胞的混合样品以不同管道雷诺数:Rec=ρUmDh/μ(ρ代表流体密度,μ代表流体动态粘度,Um代表管道中流体的最大速度,Dh代表管道的流体力学直径)灌入所设计的微流控芯片,进行血液中循环肿瘤细胞的分离筛选。首先我们将同样位置的无细胞背景图片提前拍摄,然后再利用背景矫正功能与相同位置的血细胞运动图片相叠加,得到高清晰度的血细胞运动轨迹。如图4A所示,当Rec为50时,血细胞和癌细胞只能运动聚焦到管道的中心位置,而当Rec增加到72.22时,几乎所有的血细胞都能聚焦到靠近两侧管壁的平衡位置上,并形成清晰的60~120 μm宽度(图5A)(这个宽度是通过测量血细胞占据两个区域距离的半峰全宽得到的)。这种现象的形成是因为随着Rec的增加,较大的惯性升力促使直径较小的血细胞更好的克服拖曳力向两侧管壁方向聚焦。最后当Rec增加到94.44时,血细胞和癌细胞形成了三条细胞条带,彼此之间不能清晰分开。因此基于上述结果,当Rec为72.22时,血细胞在惯性聚焦区域能够获得聚焦到两侧管壁的最佳灌注条件。
随后,为进一步验证实验的准确性,惯性分离区域中样品的运动情况也被研究(图4B)。另外,通过测量其对应的细胞光强度值,更清晰的细胞运动情况能被观察到(图5B)。当Rec为50时,血细胞会在惯性分离区域形成一个较宽的分布范围。随着Rec的增加,血细胞开始倾向于向两边侧管道运动。如图6A所示,直到Rec为72.22时,几乎所有的血细胞都会向两侧运动,癌细胞在中间运动(红色箭头标注)。当Rec再进一步增加到94.44时,血细胞又会出现三条细胞带的分布情况,这与惯性聚焦区域中观察到的细胞轨迹现象是一致的。由于三条细胞带中的一条细胞带是要从中央管道出去,它会降低癌细胞在中央管道出口处(出口2)的富集率。所以基于上述实验结果,Rec=72.22是血液中CTC分离的最佳灌注条件,这与惯性聚焦区域的实验结果一致。
2.3 空间位组分离细胞

图6 在管道Rec=72.22下惯性分离区域(A)和空间位组区域(B)中细胞的运动轨迹图。(A)红色箭头展示出惯性分离区域中癌细胞运动轨迹图;(B)红色箭头展示出分离后的癌细胞在栏杆作用下运动轨迹图(标尺为200 μm)Fig.6 Cell trajectories in the inertial separation region(A) and steric hindrance region(B) under Rec=72.22.(A) The red arrows indicate that the cell trajectories of isolated cells in the inertial separation region;(B) The red arrows indicate that the isolated cells were railed by the micropost array(Scale bar:200 μm)
利用前面优化出的灌注条件,空间位阻区域中的混合样品运动轨迹也被研究(图6B)。当人源性乳腺癌细胞或人源性宫颈癌细胞进入空间位阻区域后,有些细胞并不能在中心线上形成单一的中央细胞条带。本研究通过设置间距为10 μm的等腰梯形微柱阵列栏杆,能够引导没有聚焦在中心线的癌细胞沿着微柱阵列栏杆运动(红色箭头标注),最终进入出口2,实现CTC的二次富集。另外,在惯性分离区域中未分离出的血细胞还会被设置的微柱阵列栏杆过滤掉,实现血细胞的二次移除,增加癌细胞的回收率和富集率。
2.4 分离效率与细胞活性

图7 血细胞中人源性乳腺癌细胞分离前(Ⅰ和i)和分离后出口2(Ⅱ和ii),出口1(Ⅲ和iii),以及出口3(Ⅳ和ⅳ)的明视场图和暗视场图(为方便细胞回收率的计数,人源性乳腺癌细胞在实验前通过CellTracker Green进行活细胞染色)(标尺为150 μm)Fig.7 Comparison of bright-field(Ⅰ-Ⅳ) and fluorescence(ⅰ to ⅳ) images of the mixture of MCF-7 and blood cells before separation(Ⅰ and ⅰ),cells collected from outlet 2(Ⅱ and ⅱ),cells from outlet 1(Ⅲ and ⅲ),and cells from outlet 3(Ⅳ and ⅳ)(To facilitate the count of cell recovery,MCF-7 cells were stained with CellTracker Green)(Scale bar:150 μm)
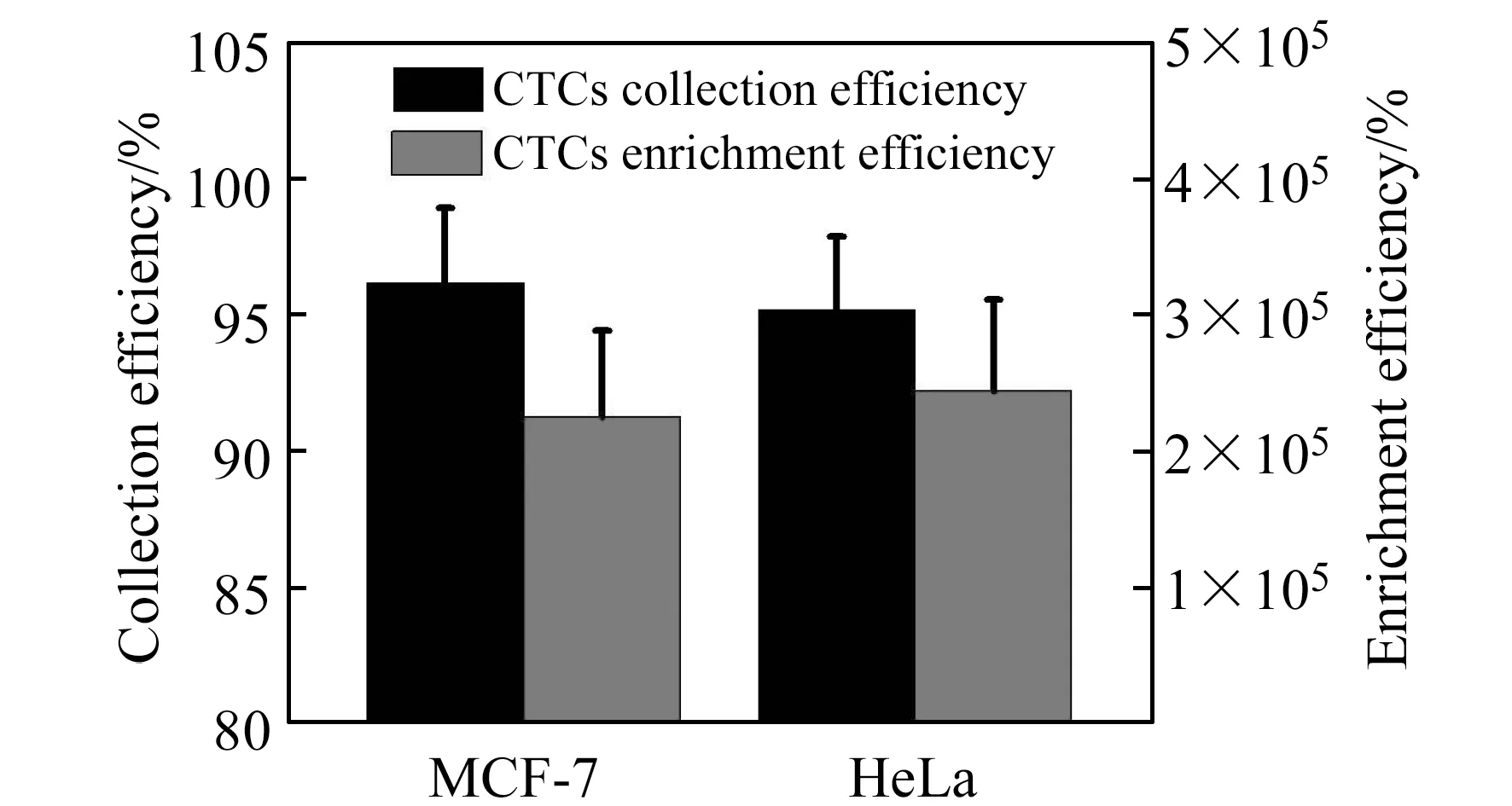
图8 人源性乳腺癌细胞和人源性宫颈癌细胞收集效率和富集效率统计结果图Fig.8 Evaluation of microfluidic system performance using cancer cells(MCF-7 and HeLa cells)
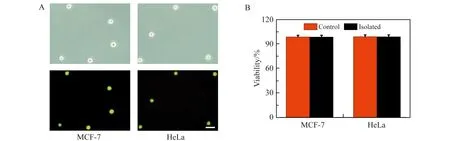
图9 AO/PI双重染色法细胞活性测试图。(A)两种癌细胞的明视场图(上)和暗视场图(下);(B)两种癌细胞活性的定量分析图(标尺为50 μm)Fig.9 Cell viability of separated MCF-7 and HeLa cells using AO/PI double-staining method.(A) The bright-field(top) and fluorescence(bottom) images of two cancer cells;(B) Quantitative analysis of cellular viability of control(unseparated) and separated rare cells(Scale bars:50 μm)
最后,在最优灌注条件Rec=72.22下,我们对每个独立样品进行了分离效率的统计分析(图7)。首先,癌细胞在灌注前通过活细胞染色进行了荧光标记,便于计算其回收率和富集率(人源性乳腺癌细胞用CellTracker Green CMFDA进行活细胞染色,人源性宫颈癌细胞用CellTracker Orange CMRA进行活细胞染色)。实验结果表明,两种癌细胞的回收率均大于95.20%,富集效率均大于2.05×105(图8)。由于一些没有良好聚焦的癌细胞在经过等腰梯形微柱阵列栏杆时,会受到高剪切应力的影响,它们的细胞活性需要被进一步检测。利用AO/PI双重染色法对参与分离和未参与分离(对照组)的癌细胞进行活性分析统计。结果表明,通过芯片结构分离后的癌细胞仍然具有较好的活性,与对照组的癌细胞活性相似,都能达到93%以上的细胞存活率(图9)。

图10 分选后人源性乳腺癌细胞和人源性宫颈癌细胞活性测试图(培养36 h)(标尺为50 μm)Fig.10 Cellular viability assay of isolated MCF-7 and HeLa cells by reseeding them back in culture for 36 h(Scale bar:50 μm)
最后,我们通过培养和增殖两种染色的癌细胞,如图10所示。进一步证明了本实验方法不会对CTC活性产生影响。
为此,本研究将高通量的惯性微流方法与高回收率的空间位阻方法结合,建立一种新型血液CTC分离装置。该装置能够通过惯性微流分离区域移除大量的血液细胞,然后再通过等腰梯形微柱阵列栏杆来进行二次分离,最终完成高通量、高效率和高活性的CTC分离。基于这种新方法,利用实验室所培养的人源性乳腺癌细胞和人源性宫颈癌细胞混入正常的人体血液,从而模拟癌症患者血液,可以在不使用任何抗体标记的情况下从血细胞比容2%的血液中成功分离出癌细胞。分离速率均达到3.43 × 107cell/min,癌细胞回收率与富集率均分别大于95.20%和2.05×105。对比目前存在的诸多循环肿瘤细胞分离方法,该技术具有高回收率、高通量、高活性及高富集率的明显优势,结果如表2所示。

表2 血液中循环肿瘤细胞不同分离方法的比较
3 结论
本研究以微流控芯片为基础,整合不同功能的多级连续分离装置,有潜力应用于血液中循环肿瘤细胞的“液体活检”,为癌症早期诊断及治疗提供及时、方便、准确的检测方法。这种方法不仅可以达到高效率分离,而且对比其他微流控方法,具有结构简单(无需机械或电子部件)、操作方便、易于作为功能模块与现有的一些实验设备结合的优点。这些优点不但可以大大降低微流控装置的制作成本,还有利于微流控技术的推广和使用。作为一种新的研究方向,微流控芯片上惯性微流与空间位阻的结合研究具有的诸多优势和特点,一定会在生物分析、医学研究以及临床诊断等领域中具有更加广阔的应用前景。作为一种非侵入性的新型诊断工具,它对建立新型癌症患者病情检测微型分析平台具有重要意义。

