毛细管区带电泳-红色激光诱导荧光检测磷酸化氨基酸
夏丽君, 郭小峰, 王 红
(生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉 430072)
蛋白质磷酸化是一种重要的蛋白质修饰类型,在真核生物细胞增殖和分化、细胞凋亡、基因表达、信号传导以及新陈代谢等细胞调控过程中起到关键作用[1-2],其失调与癌症、糖尿病和高血压等[3]许多疾病有关。最常见的磷酸化类型为苏氨酸、丝氨酸和酪氨酸残基的磷酸化,它们具有作为控制蛋白质-蛋白质相互作用的分子开关的能力[4]。蛋白质的水解和生物体代谢活动可生成对应的磷酸化氨基酸,通过对它们的定量分析,可以了解蛋白质磷酸化程度,并探讨磷酸化对蛋白质功能的影响[5]。
目前,已有多种磷酸化氨基酸的分析方法,如薄层色谱法[6]、同位素标记法[7]、高效液相色谱法(HPLC)[8]、毛细管电泳法(CE)[5]和液相色谱-质谱法(LC-MS)[2]等。其中,CE不仅灵敏度高、分离速度快,且样品消耗量远少于其它方法,特别适合生物样品的分析。但是,磷酸化氨基酸本身不具备可检测的荧光信号,需要使用荧光衍生试剂。已报道的用于检测磷酸化氨基酸的荧光衍生试剂主要有:荧光素异硫氰酸酯(FITC)[9]、2,3-萘二醛(NDA)[10]、9-芴基甲基氯甲酸酯(FMOC)[11]、6-氧-(N-羟基琥珀酰亚胺乙酸酯)-9-(2′-甲氧羰基)荧光素(SAMF)[12]、1-(ε-琥珀酰亚胺羧戊基)-1′-甲基-3,3,3′,3′-四甲基吲哚碳菁-5,5′-二磺酸单钾盐(MeCy5-OSu)[5]、N-羟基琥珀酰亚胺-荧光素-O-乙酸酯(SIFA)[13]、3-(2-呋喃甲酰基)喹啉-2-甲醛(FQ)[14]和5-(4,6-二氯-s-三嗪-2-氨基)荧光素(DTAF)[15]等,它们均通过与磷酸化氨基酸上的氨基反应实现荧光标记。
1,7-二甲基-3,5-二苯乙烯基-8-苯基-(4′-氧乙酸-N-羟基琥珀酰亚胺酯)-二氟化硼-二吡咯甲烷(DMDSPAB-OSu)是本课题组近期自行设计并合成的氨基荧光衍生试剂,其结构见图1。DMDSPAB-OSu以二氟化硼二吡咯甲烷(BODIPY)为荧光基团,以高活性的N-羟基琥珀酰亚胺酯为反应基团,其激发/发射波长(617/625 nm)可匹配商品化的半导体激光诱导荧光检测器。本研究采用DMDSPAB-OSu为荧光衍生试剂,其与磷酸化氨基酸在0.07 mol·L-1H3BO3-Na2B4O7缓冲溶液(pH=8.5)中,室温下衍生反应仅需5 min,衍生产物用毛细管区带电泳-激光诱导荧光(CZE-LIF)分离检测,在17.5 min内实现基线分离,检出限(S/N=3)为1.5~3.2 nmol·L-1,生物样品中内源荧光物质和常见氨基化合物均无干扰,方法用于牛奶样品分析,加标回收率为91.1%~103.8%。
1 实验部分
1.1 仪器及试剂
Beckman-Coulter P/ACE MDQ毛细管电泳仪(美国,贝克曼库尔特),配有半导体激光诱导荧光检测器(635/675 nm,2 mW)。Delta 320酸度计(梅特勒-托利多(上海))。
L-磷酸化丝氨酸(P-Ser)、L-磷酸化苏氨酸(P-Thr)、L-磷酸化酪氨酸(P-Tyr)标准品购于Sigma公司(上海),溶于水配成5 mmol·L-1的储备溶液,使用时稀释到所需的浓度。H3BO3、Na2B4O7、一水合柠檬酸、二水合柠檬酸钠、乙醇、乙腈购于上海国药(集团)试剂有限公司。DMDSPAB-OSu由本实验室自行合成,溶于乙腈配成2 mmol·L-1储备溶液。
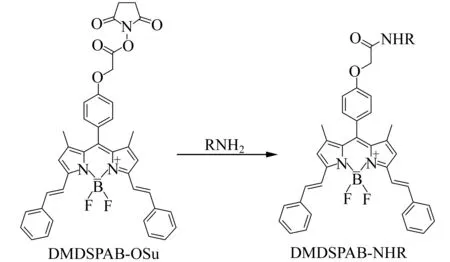
图1 DMDSPAB-OSu与氨基化合物的衍生反应Fig.1 The reaction of DMDSPAB-OSu with amino compound
1.2 DMDSPAB-OSu与磷酸化氨基酸的衍生
DMDSPAB-OSu与氨基化合物的衍生反应如图1所示。向含有15 μL磷酸化氨基酸混合溶液的Eppendorf管中,加入10 μL 0.07 mol·L-1H3BO3-Na2B4O7缓冲溶液(pH=8.5),15 μL的DMDSPAB-OSu溶液(2 mmol·L-1)和10 μL乙腈,充分混合后,于室温下反应5 min。
1.3 样品处理
牛奶酪蛋白提取:将预热到40 ℃的HAc-NaAc溶液(20 mL,0.2 mol·L-1,pH=4.7)缓慢加入到20 mL的40 ℃牛奶中。然后将溶液pH调到4.7,溶液变成白色悬浊液。冷却至室温后,离心,弃去上清液,得酪蛋白粗产物。最后依次用水、乙醇、乙醚和乙醇的混合溶液各洗涤3遍。
酪蛋白水解:将15 mL 6 mol·L-1的HCl慢慢倒入加入了酪蛋白粗产物的三口瓶中,加热回流过夜。将酪蛋白水解液用浓NaOH溶液调pH至中性,然后用0.22 μm滤膜过滤后,定容至20 mL,稀释10倍后按1.2节所述衍生方法进行衍生。
1.4 毛细管区带电泳分离-激光诱导荧光检测
毛细管总长为55 cm,有效长度45 cm,内径75 μm(河北永年光纤厂)在使用前依次用甲醇、水、1 mol·L-1NaOH溶液、水、1 mol·L-1HCl、水冲洗30 min。每天使用前,毛细管依次用水、0.1 mol·L-1NaOH溶液、水、0.1 mol·L-1HCl、水各冲洗3 min,然后用电泳缓冲溶液平衡毛细管5 min。衍生物用背景电解质稀释10倍后进行分离测定。工作条件:压力进样:0.5 psi、5.0 s;分离电压:20.0 kV;温度:室温。激光诱导荧光检测器:激发/发射波长为617/625 nm。
2 结果与讨论
2.1 分离条件优化
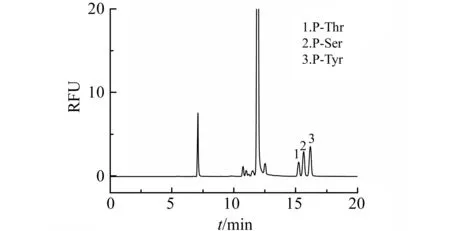
图2 DMDSPABOSu-磷酸化氨基酸衍生物的电泳图Fig.2 Electropherogram of DMDSPABOSu-phosphorylated amino acids derivativesRunning buffer:13.5 mmol·L-1 pH=8.5 H3Cit-Na3Cit buffer,55%(V/V) acetonitrile. Separation voltage:20 kV;Injection:5 s,0.5 psi.
CZE是CE中最简便的分离模式,利用分析物在毛细管中迁移速率的不同而实现分离。迁移速率是电泳和电渗两种速率的矢量和,而背景电解质的组成是影响迁移速率的主要因素。通常背景电解质由一定组成的缓冲溶液构成,但考虑到DMDSPAB-OSu的溶解性,因此,需要在背景电解质中添加一定比例的有机溶剂。我们研究了乙腈含量、柠檬酸盐缓冲溶液pH和浓度对迁移时间的影响。结果表明,3种磷酸化氨基酸衍生产物的迁移时间随乙腈含量(40%~70%)和缓冲溶液浓度(9~18 mmol·L-1)升高而增加,随pH升高而减少,且在50%~60%乙腈含量时分离效果最好。综合考虑分离速度和分离效果,最终选择含有55%乙腈的13.5 mmol·L-1柠檬酸盐缓冲溶液(pH=8.5)作为背景电解质,3种磷酸化氨基酸标样分离图如图2所示。
2.2 衍生条件优化
N-羟基琥珀酰亚胺酯是常用的氨基化合物衍生基团,其与氨基化合物反应的同时,自身也会发生水解反应[16 - 17]。因此,通常需要使用过量的衍生试剂以保证衍生效率。如图3(a)所示,当DMDSPAB-OSu浓度高于6.0×10-4mol·L-1时,各衍生物的峰面积达到最大并保持不变。因此,我们选择6.0×10-4mol·L-1作为DMDSPAB-OSu最佳衍生浓度。DMDSPAB-OSu与氨基化合物的衍生过程与衍生介质pH密切相关。因此,我们研究了H3BO3-Na2B4O7缓冲溶液在pH=8.25~9.0内对峰面积的影响。根据结果(图3(b))所示,衍生物的峰面积在pH=8.5时达到最大,所以选择pH=8.5作为最佳衍生pH。加热可以加速DMDSPAB-OSu衍生反应,同时也会加速DMDSPAB-OSu中N-羟基琥珀酰亚胺酯基团的水解。如图3(c),5 min内3种磷酸化氨基酸衍生物的峰面积在25 ℃时达到最大,继续增加反应温度峰面积有所降低,可能是水解速率加快所致,所以选择室温(25 ℃)作为最优衍生温度。随后,在25 ℃下,5~25 min范围内研究衍生化时间的影响。如图3(d)所示,5 min内衍生已基本完成,选择最佳衍生时间5 min。
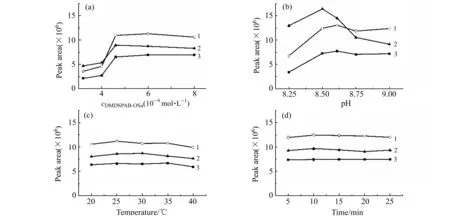
图3 衍生试剂浓度(a)、pH(b)、反应温度(c)及反应时间(d)对DMDSPAB-磷酸化氨基酸衍生物峰面积的影响Fig.3 Effect of cDMDSPAB-OSu (a),pH(b),reaction temperature(c) and reaction time(d) on the peak area of DMDSPABOSu-phosphorylated amino acids derivatives1.Tyr;2.P-Ser;3.P-Thr.
2.3 干扰实验
DMDSPAB-OSu可与氨基化合物反应,用于磷酸化氨基酸的分离,其可能的干扰主要源自生物样品基质中普遍存在的脂肪胺、生物胺、氨基酸等各种氨基化合物。CZE中迁移时间主要由质荷比决定,而在上述弱碱性背景电解质中,脂肪胺和生物胺的衍生产物在该条件下不带电荷,磷酸化氨基酸的磷酸基团发生解离,其所带负电荷较基本氨基酸更多,质荷比有较大的差别,理论上脂肪胺、生物胺和基本氨基酸对磷酸化氨基酸的分离应无干扰。实验结果也表明,脂肪胺(甲胺至正十二胺共十二种)、生物胺(组胺,酪胺,苯乙胺,色胺,5-羟色胺,胍基丁胺,乙醇胺,腐胺,尸胺,亚精胺,精胺共十一种)以及常见氨基酸的DMDSPAB-OSu衍生产物迁移时间与3种磷酸化氨基酸差别显著,对分离不产生干扰。
2.4 分析性能
在上述优化的衍生和分离条件下,获得了3种磷酸化氨基酸的浓度与峰面积的线性方程、线性范围、日内和日间相对标准偏差,其检出限(S/N=3)为1.5~3.2 nmol·L-1,如表1所示。与其它用于磷酸化氨基酸检测的荧光试剂相比,DMDSPAB-OSu衍生条件更温和、反应速度更快,采用红色LIF检测以避免生物样品内源性荧光干扰的同时,可获得不输于绿色LIF检测方法的灵敏度,见表2。
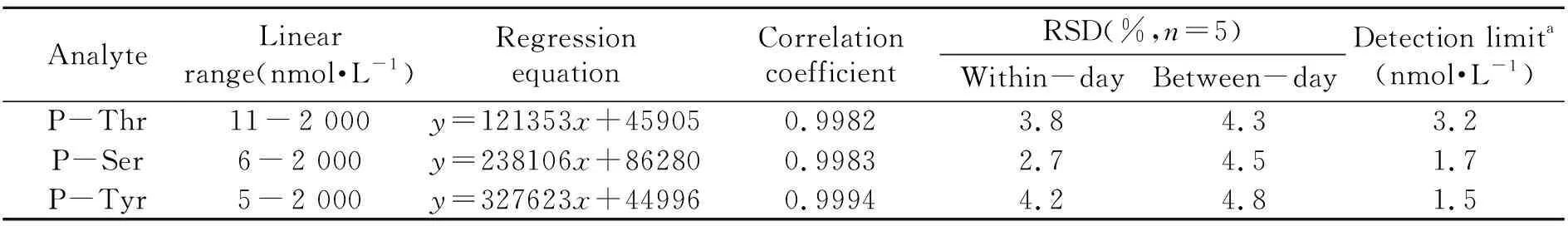
表1 磷酸化氨基酸的线性范围,线性方程和检出限
aS/N=3;X:concentration of amine(μmol·L-1);Y:peak area of DMDSPAB-phosphorylated amino acids.
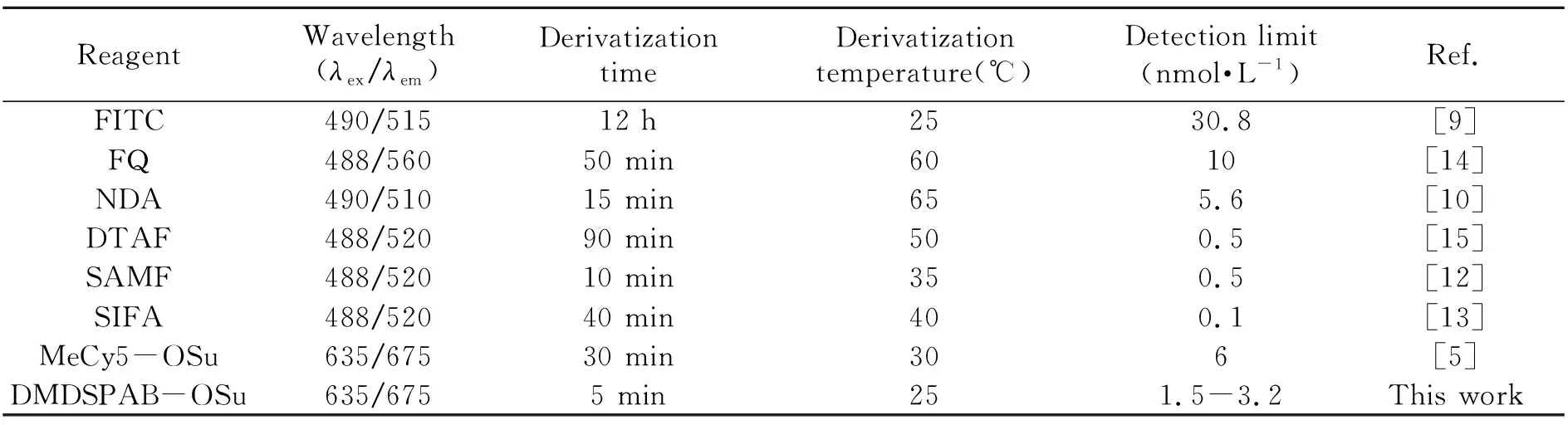
表2 DMDSPAB-OSu与已报道的磷酸化氨基酸衍生试剂对比
2.5 样品分析
牛奶中主要的蛋白质是酪蛋白[18],其中含有较为丰富的磷酸化丝氨酸残基[19]。图4是牛奶中酪蛋白水解样品及其加标回收的电泳图谱,其检测结果如表3所示。可以看出,牛奶中酪蛋白的磷酸化丝氨酸残基浓度为5.17×10-4mol·L-1。
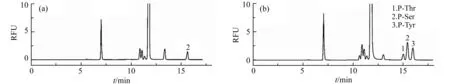
图4 牛奶中酪蛋白水解样品加入5.0×10-4 mol·L-1标准磷酸氨基酸前(a)后(b)的电泳图谱Fig.4 Electropherograms obtained from (a) hydrolyzed casein of milk and (b) hydrolyzed casein of milk spiked with 5.0×10-4 mol·L-1 of standard phosphoamino acidsRunning buffer:13.5 mmol·L-1 pH=8.5 H3Cit-Na3Cit buffer,55%(V/V) acetonitrile.Separation voltage:20 kV;Injection 5 s at 0.5 psi.

AnalyteAdded(10-5 mol·L-1)Found(10-5 mol·L-1)RSD(%,n=5)Recovery(%)AnalyteAdded(10-5 mol·L-1)Found(10-5 mol·L-1)RSD(%,n=5)Recovery(%)P-Thr00P-Tyr0050.051.95.5103.850.045.85.891.6150.0149.65.199.7150.0136.76.391.1P-Ser051.750.098.26.293.0150.0197.25.297.0
3 结论
本文基于DMDSPAB-OSu的优异荧光特性,建立了CZE-LIF分离检测实际样品中磷酸化氨基酸的新方法。室温下,在70 mmol·L-1pH=8.5 H3BO3-Na2B4O7缓冲液中,DMDSPAB-OSu与3种磷酸化氨基酸的衍生反应仅需5 min。在含有13.5 mmol·L-1pH=8.5的柠檬酸盐缓冲溶液和55%(V/V)乙腈的背景电解质中,磷酸化氨基酸衍生物分离用时17.5 min。较之已报道的CE-LIF相关检测方法,DMDSPAB-OSu衍生条件温和、反应迅速、灵敏度较高,且采用红色LIF检测能够避免生物样品内源性荧光干扰。

