适形调强放疗联合内分泌治疗对局部晚期前列腺癌患者血清肿瘤学指标与无转移生存率的影响
余 杰,王 旸,贾彦召,杨 峥,张 森,刘瀚文,饶石磊,张 凯
(南阳市中心医院放疗科,河南南阳 473009)
作为男性泌尿生殖系统最常见的恶性肿瘤,前列腺癌是欧美国家男性死亡的主要疾病之一[1]。随着我国社会经济的发展,人们生活习惯、饮食结构的改变以及社会老龄化进程的加快,前列腺疾病的发病率近年来逐年攀升,对中老年男性的生命健康和生活质量造成严重威胁。前列腺癌发病隐匿,早期无明显症状或症状较轻,如尿频、尿急、夜尿增多、尿线细且无力等,大部分患者待出现明显症状而被检出时已属于中晚期,且因年龄较大、基础疾病多、身体耐受差而不适宜行手术治疗。因此,放疗、内分泌等综合治疗成为常见手段[2-3]。目前,如何选择疗效确切、毒副反应轻、中老年患者耐受的治疗方法用于局部晚期前列腺癌的临床治疗成为医学热点、难点之一。在此背景下,本研究回顾性分析适形调强放疗联合内分泌治疗对局部晚期前列腺癌患者血清肿瘤学指标与无转移生存率的积极影响。
1 资料与方法
1.1临床资料回顾性收集我院2009年1月至2015年2月期间收治的97例局部晚期前列腺癌患者的临床资料,入选标准:①出现明显症状,如排尿困难、尿频尿急、肉眼血尿、血精、肛周及尿道等处疼痛、尿后滴沥或滴白等;②直肠指诊触及硬性结节,均行RTE、MRI扫描检查提示TNM分期Ⅲ期或Ⅳ期,前列腺癌Gleason分级[4]4~5级,肿瘤侵犯前列腺包膜或提肛肌、外括约肌等精囊外邻近结构;③经病理组织学诊断证实,且不适宜行根治性前列腺切除术或拒绝接受手术治疗者;④Gleason评分8~10分;⑤血清前列腺特异抗原(prostate specific antigen,PSA)≥20 ng/mL;⑥临床资料及随访资料完整。排除标准:①已确诊的慢性前列腺炎、前列腺增生及早期前列腺癌;②发生脑转移;③合并感染,心、脑血管、肝肾及造血系统等严重原发性疾病;④合并其他来源的恶性肿瘤;⑤合并发生严重的尿路感染、尿道狭窄及膀胱结石;⑥伴发引起逼尿肌活动过度或逼尿肌无力及排尿障碍症状的其他疾病;⑦对本研究内分泌治疗药物过敏。根据放疗方法不同,97例患者被分为调强组55例和常规适形组42例。调强组年龄49~78(64.55±6.95)岁,体重53~82(66.73±6.20)kg,其中TNM分期Ⅲ期29例、Ⅳ期26例,病理Gleason分级4级22例、5级23例;常规适形组年龄46~75(62.55±7.37)岁,体重55~86(67.89±5.63)kg,其中TNM分期Ⅲ期23例、Ⅳ期19例,病理Gleason分级4级20例、5级22例。两组性别、年龄、TNM分期、病理Gleason分级接近,比较差异无统计学意义(P>0.05)。
1.2治疗方法调强组55例患者行适形调强放疗联合内分泌治疗,常规适形组42例患者行常规或三维适形放疗联合内分泌治疗。所有患者治疗期间均密切关注不良反应情况并及时针对性处理。①适形调强放疗:模拟CT定位(Discovery 590KT CT模拟机)后自L2至坐骨下缘下10 cm扫描,层厚5 mm,间距3 mm;以CT扫描与盆腔MR图像勾画肿瘤靶区(gross tumor volume,GTV),包括前列腺整体、精囊(双侧)和盆腔淋巴结引流区;临床靶区(clinical target volume,CTV)同GTV,CTV基础上外放1 cm则为计划靶区(planning target volume,PTV),后外扩0.5 cm,各靶区勾画完毕后,按照每例患者实际情况明确放疗计划,采用6 000 kV X射线照射,CTV 2.23 Gy/次,5次/周,共计35次,总剂量78.05 Gy;PTV 2.17 Gy/次,5次/周,共计35次,总剂量75.95 Gy;95% PTV体积接受剂量≥76 Gy;邻近敏感器官如直肠、膀胱等为V70≤25%,股骨头(双侧)V50≤5%,耻骨V70≤25%。②常规和适形放疗:实施前后、两侧野照射或三维适形三野照射,上界为骶1上缘,下界为坐骨节下缘,前后野侧界、侧野上下界为真骨盆外1~2 cm,处方剂量为:2.0 Gy/次,每周5次,总剂量70 Gy。③内分泌治疗:放疗第1日给予3.75 mg亮丙瑞林(国药准字H20093852,上海丽珠制药有限公司,规格3.75 mg)皮下注射,1次/28 d+50 mg比卡鲁胺(国药准字H20113535,上海复旦复华药业有限公司,规格50 mg)口服,1次/d,待PSA<0.2 ng/mL且维持最低值2个月后停药,而如果随访期间出现生化复发(PSA超过最低值2 ng/mL)时再次按上述方法用药,如此循环。
1.3观察指标①治疗结束后2个月通过影像学复查评估结果进行近期疗效评定[5]。完全缓解(complete remission,CR):肿瘤完全消退并维持超过4周以上;部分缓解(partial remission,PR):肿瘤消退≥50%并维持超过4周;无变化(no change,NC):肿瘤消退<50%或增大<25%;病变进展(progression of disease,PD):肿瘤增大≥25%或出现新病灶。总缓解率(remission rate,RR)以CR、PR计算。②血清肿瘤学指标检测:治疗前及结束后2个月采集所有患者外周血5 mL,以1 000 r/min常规离心(日本KOKUSAN H-103N离心机,离心半径15 cm)处理5 min,检测血清标本中PSA、游离前列腺抗原(free prostate specific antigen,fPSA)浓度。③本次研究随访截止至2017年12月31日,所有患者均至少随访3年,统计无转移生存率及累计生存率。

2 结 果
2.1两组患者临床疗效比较调强组、常规适形组RR分别为61.82%、45.24%,差异无统计学意义(χ2=2.64,P>0.05),但前者疗效分布明显优于后者,差异有统计学意义(Z=4.40,P<0.05)。见表1。
2.2两组不同分期、分级患者临床疗效比较调强组Ⅲ期、Ⅳ期患者RR与常规适形组患者相比无统计学意义(χ2=3.13,0.54,P>0.05)。调强组Gleason分级4级、5级患者RR与常规适形组相比亦无统计学意义(χ2=3.39,0.60,P>0.05)。见表2~3。
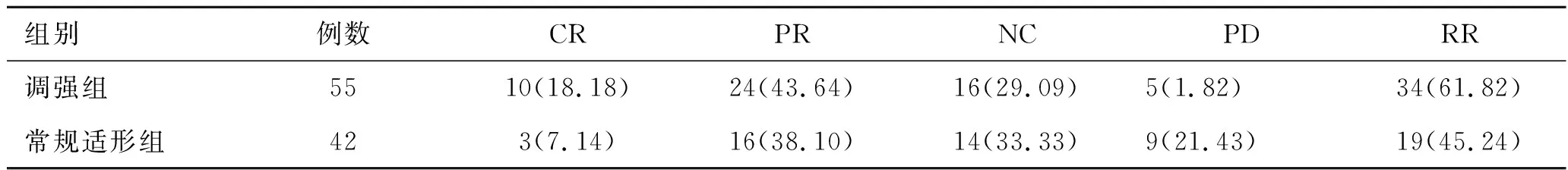
表1 两组患者临床疗效比较[例(%)]
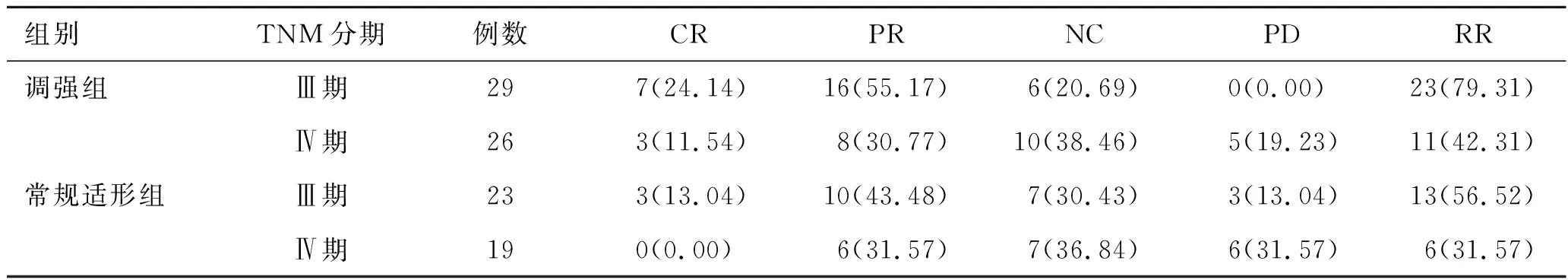
表2 两组不同分期患者疗效比较[例(%)]
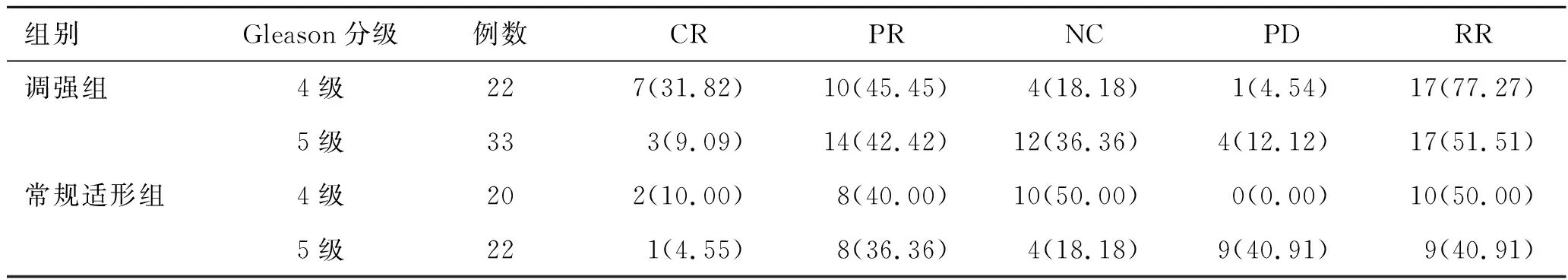
表3 两组不同分级患者疗效比较[例(%)]
2.3两组患者治疗前后血清肿瘤学指标比较两组治疗前血清PSA、fPSA浓度接近,差异无统计学意义(P>0.05),治疗后血清PSA、fPSA浓度均明显较治疗前下降,但调强组下降幅度显著大于常规适形组,差异有统计学意义(P<0.05)。见表4。
2.4两组患者生存率比较两组治疗结束后1年、3年累计生存率接近,差异无统计学意义(P>0.05),但调强组1年、3年无转移生存率为60.00%、38.18%,明显高于常规适形组的38.09%、19.05%,差异有统计学意义(P<0.05)。见表5。


组别PSA(ng/mL)治疗前治疗后fPSA(ng/mL)治疗前治疗后调强组60.45±11.8614.26±3.05*11.49±2.512.08±0.51*常规适形组59.95±12.0426.98±5.23*11.70±2.483.55±0.86*t值0.2015.010.4110.50P值>0.05<0.05>0.05<0.05
与同组治疗前相比,*P<0.05;PSA:前列腺特异抗原;fPSA:游离前列腺特异抗原。
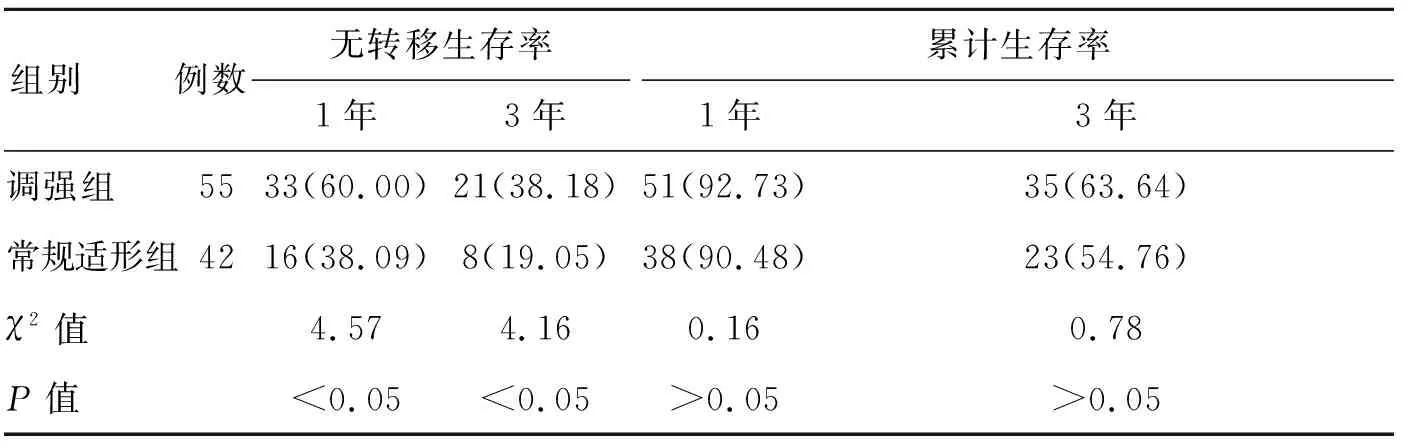
表5 两组患者生存率比较[例(%)]
3 讨 论
虽然我国前列腺癌的发病率相比西方发达国家较低,但由于人口基数大,老龄化现象日益突出,前列腺癌就诊患者基数庞大。早期前列腺癌治疗多采用公认的根治性前列腺癌切除术,患者通常预后较好。然而,中晚期尤其是局部晚期前列腺癌患者基本已错过手术最佳时间,预后往往较差[6]。对于中晚期前列腺癌的治疗,目前多主张联合治疗。欧洲泌尿协会更新的前列腺癌诊疗指南中明确建议中晚期前列腺癌推荐采取联合应用放射治疗加激素治疗[7]。雄激素依赖性是前列腺癌内分泌治疗的基础,故通过有效手段降低体内雄激素浓度、抑制肾上腺来源的雄激素的合成有助于抑制睾酮转化为双氢睾酮,并可一定程度阻断雄激素与其受体结合,继而达到抑制或控制前列腺癌细胞生长的目的[8]。本研究内科治疗药物选用亮丙瑞林+比卡鲁胺,有助于降低患者血清雄激素水平,促使体内雄激素敏感细胞死亡而实现肿瘤生长被抑制的目的,可一定程度缓解肿瘤的转移,消除放疗后癌细胞增殖,从而增强放疗效果[9]。外放射治疗具有疗效好、适应证广、并发症少、安全有效等特点,是前列腺癌患者最重要的治疗手段之一。对于局部晚期前列腺癌而言,可通过电离辐射(X辐射能量)不同程度的杀伤、破坏癌组织,使肿瘤体积缩小。随着放疗技术及医疗设备的不断改进,调强适形放疗主张通过输出非均匀照射剂量使不同靶区获得的剂量不同,可适度增加肿瘤局部照射剂量及靶区的照射总量的同时,减少对周围正常组织器官(直肠、膀胱等)的照射剂量,在增加放疗剂量及控制直肠辐射量方面明显优于常规和三维适形放疗方法[10]。
故本研究结果显示,虽然调强组、常规适形组RR差异不明显,但前者疗效分布明显优于后者。廖海球等[11]的研究结果显示适形调强放疗同步给予间歇性内分泌治疗中晚期前列腺癌,其RR高达84%,明显高于三维适形、常规放疗。均表明适形调强放疗联合内分泌可明显提高局部晚期前列腺癌的临床治疗疗效,主要与适形调强放疗可在保证安全性的前提下增加肿瘤局部照射剂量及靶区照射总量有关。同时,值得注意的是,调强组Ⅲ期、Ⅳ期患者RR与常规适形组患者相比,Gleason分级4级、5级患者RR与常规适形组患者相比均无明显差异,提示局部晚期前列腺癌患者临床分期、病理分级可能对综合治疗疗效的影响不明显,亦有可能与本研究纳入样本量较少有关,其仍有待进一步探索。为进一步分析两组的治疗效果,我们对比分析了两组血清PSA、fPSA浓度,其中PSA作为前列腺腺泡分泌的糖蛋白,是前列腺癌的血清肿瘤标志物,具有较高的敏感性和特异度;正常情况下机体的淋巴系统与前列腺腺泡被屏障分隔,一旦肿瘤屏障被破坏,大量PSA随机进入淋巴系统,导致血中PSA、fPSA浓度升高[12]。本研究两组患者治疗后血清PSA、fPSA浓度均明显较治疗前下降,但调强组下降幅度显著大于常规组,证实适形调强放疗联合内分泌治疗对调节局部晚期前列腺癌患者血清肿瘤学指标浓度有突出作用,与曹敬毅等[13]的报道相符。此外,生存率方面,调强组1年、3年无转移生存率为60.00%、38.18%,明显高于常规组的38.09%、19.05%,证实适形调强放疗有助于提高局部晚期前列腺癌患者局部控制率和无转移生存率,从而有助于改善患者预后,与骆华春等[14]的观点一致。然而本研究中,两组治疗结束后1年、3年累计生存率接近,可能与随访期较短及研究样本量少有关,适形调强放疗对局部晚期前列腺癌患者远期预后改善作用仍需经过将来随访后给予论证。

