人骨髓间充质干细胞促进乳腺癌细胞系MCF7上皮间质转化
许 峰,金晓霞,施民新*
(南通大学附属肿瘤医院 南通市肿瘤医院 1.胸外科; 2.病理科, 江苏 南通 226361)
中国乳腺癌的发病率和致死率正逐年增加,是女性最常罹患的恶性肿瘤,癌细胞发生侵袭与转移影响是乳腺癌患者生存期的根本原因之一[1]。上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞失去细胞间的紧密连接获得间质样表型的生物学过程,使肿瘤细胞获得较强的迁移侵袭和转移的能力[2- 3]。EMT的发生不仅与肿瘤本身有关,也和肿瘤的微环境密切相关[4]。目前认为骨髓间充质干细胞(human bone marrow derived mesenchymal stem cells,hBMSCs)可以被募集至肿瘤周围而构成肿瘤微环境。有报道称hBMSCs能和乳腺癌细胞相互作用,并且可以促进乳腺癌细胞的侵袭和转移,而乳腺癌的侵袭和转移又与EMT关系密切[5- 6]。因此,研究hBMSCs在乳腺癌EMT过程中的相互作用有助于更加深入地探索肿瘤微环境,揭示hBMSCs促进乳腺癌侵袭及转移的新机制,为临床工作中乳腺癌的治疗提供新的思路。
本研究从hBMSCs与乳腺癌细胞系的相互作用入手,探索乳腺癌微环境中的hBMSCs对乳腺癌细胞EMT的影响,揭示hBMSCs在乳腺癌转移中的潜在作用,为乳腺癌治疗提供新的靶点。
1 材料与方法
1.1 材料
DMEM、DMEM/Fl2、RMPI1640、胎牛血清、EDTA和0.25%胰蛋白酶(Gibco公司);干细胞生长因子(Sigma-Aldrich公司);SYBR Pre mix Ex TaqⅢ试剂盒(TaKaRa公司);反转录及PCR扩增试剂(天根生化科技有限公司);兔抗人CD44和CD71抗体(BD Pharmingen公司)。MCF- 7细胞系(中国科学院上海细胞研究所)。
1.2 方法
1.2.1 骨髓间充质干细胞的分离、培养和鉴定:骨髓取自健康成年志愿者。告之志愿者并签订知情同意书,并由南通市肿瘤医院伦理委员会批准后于右侧髂前上嵴行骨髓穿刺抽取骨髓10 mL置于抗凝管中。
骨髓置于离心管中,加入15 mL红细胞裂解液,轻轻吹打混匀,作用10 min,1 000 r/min离心5 min,弃去上清,收集沉淀。加入无血清培养基离心洗涤3次,重悬细胞,加入20%胎牛血清的DMEM培养基,调整细胞为2×105/mL接种于培养瓶中。置于培养箱中,48 h后第一次换液,此后2~3 d换液1次,适当传代。
hBMSCs的表型鉴定:取第3代hMSCs,0.25%胰蛋白酶消化贴壁细胞,离心重悬,各取100 μL于试管中,分别加入Mouse IgG- 1、IgG- 2、CD44和CD71各表型抗体10 μL;避光作用15 min,洗涤2次,加入4%多聚甲醛固定液重悬,流式细胞仪检测。
1.2.2 hBMSCs与乳腺癌细胞系间接共培养:实验组(共培养组):胰蛋白酶消化MCF- 7细胞后,用MSCs培养基重悬,将约2 ×105个细胞接种于6孔板Transwell小室中,过夜贴壁,消化hBMSCs后,将约2×105个细胞接种于Transwell下室。37℃培养箱内孵育,隔日换液。
1.2.3 实时定量PCR检测vimentin、E-cadherin、β-catennin和α-SMA mRNA的表达:按照TaKaRa公司SYBR Premix Ex TaqTM试剂盒说明,在IQ5实时定量PCR仪上运行real-time PCR。每份样品设置3个复孔,独立实验重复3次。引物序列如下:GAPDH:上游引物:5′-GCACCGTCAAGGCTGAGA AC-3′,下游引物:5′-TGGTGAAGACGCCAGTGGA-3′;vimentin:上游引物:5′-TGAGTACCGGAGACAG GTGCAG-3′,下游引物:5′-TAGCAGCTTCAACGGC AAAGTTC-3′;E-cadherin:上游引物:5′-CCCACC ACGTACAAAGGGTC-3′,下游引物:5′-ATGCCATC GTTGTTCACTGGA-3′;β-catenin,上游引物:5′-GC TACCTCAAGCTGATTTGATGA-3′,下游引物:5′-GG TAGTGGCACCAGAATGGATT-3′; α-SMA:上游引物:5′-TGGTATTGTGCTGGACTCTG-3′,下游引物:5′-CCATCAGGCAGTTCGTAG-3′。
1.2.4 蛋白质免疫印迹检测vimentin、E-cadherin、β-catennin和α-SMA的蛋白表达:冰上裂解细胞;电压100 V进行电泳;采用湿转法转膜:恒定电流300 mA,1 h;转膜后,5%脱脂奶粉室温下封闭1 h;5%脱脂奶粉稀释一抗抗体,4℃孵育过夜;TBST(TBS+0.1% Tween) 室温摇洗3次,5min/次;常温孵育HRP标记的羊抗小鼠或者抗兔IgG 2 h,TBST摇洗3次,5 min/次;ECL显色,胶片曝光。
1.2.5 免疫荧光检测vimentin、E-cadherin、β-caten-nin的表达:分别在4 mm×4 mm小圆玻片上种植hBMSCs、MCF7细胞或两者的混合物,密度20%~30%,培养72 h;常温下,4%多聚甲醛固定30 min;0.1% Triton X- 100室温通透15 min,山羊血清封闭30 min,加入一抗4 ℃孵育过夜;PBS洗3次,每次5 min;加CY3或者FITC标记的羊抗鼠或羊抗兔二抗,常温孵育2 h,PBS洗3次,每次5 min;DAPI(1∶4 000)染核10 min,PBS洗3次,封片。
1.2.6 酶联免疫法检测细胞增殖:对数增殖期细胞以1×103个/孔接种于96孔板,分别于培养的第1、2、3、4和5天定时取样检测。每孔加入10 μL CCK8溶液,37 ℃孵育2 h,微量振荡10 min。在酶联免疫检测仪上测定各孔吸光度值,波长为450 nm,每组3平行个复孔,取平均值,绘制细胞增殖曲线。
1.2.7 细胞周期的检测:对数增殖期的细胞以2×105个/孔接种于6孔板中,贴壁后进行相应的处理,48 h后进行取样测定。胰蛋白酶消化,PBS洗1~2遍,打散细胞,每管加70%的冷乙醇2 mL,于4 ℃固定过夜,PBS洗2遍,0.5 mL PBS重悬细胞,加RNaseA,终浓度l0 mg/L,置37 ℃恒温水浴箱孵育30 min。加终浓度为50 mg/ L的碘化丙啶(PI)染色,4℃孵育30 min,流式细胞仪检测。重复实验3次,以处在各个细胞周期的细胞百分数(%)统计结果。
1.2.8 体外迁移及侵袭实验:于6孔板中接种约2×105个细胞,过夜贴壁,根据BD公司的24孔基质胶包被的侵袭小室使用说明书进行。观察各组细胞的迁移及侵袭情况,终止实验后用4%的多聚甲醛固定上室底面的细胞,结晶紫染色后拍照和计数。
1.3 统计学分析
2 结果
2.1 人骨髓间充质干细胞(hBMSCs)的形态和表型
在全骨髓贴壁法基础上改良和分离培养hBMSCs,细胞贴壁呈梭形,似成纤维细胞,呈放射状和漩涡状增殖,排列规则(图1A)。流式细胞仪检测第3代hBMSCs:CD44阳性率为95.05%,CD71为78.86%(图1B)。

A.morphology of hBMSCs(×100);B.flow cytometric profile of hBMSCs图1 人骨髓间充质干细胞的细胞形态及免疫表型鉴定Fig 1 Morphology and typical phenotype of hBMSCs
2.2 人乳腺癌细胞系MCF- 7与hBMSCs共培养后表现出EMT的特征性变化
共培养第7天,MCF- 7由上皮样细胞的多角形转变为间质细胞特有的梭形(图2A)。与对照组相比,共培养实验组MCF- 7细胞的上皮性标志基因E-cadherin表达随着共培养的时间延长逐渐下调,到第7天的时候降低了67%,而间质性标志基因vimentin、α-SMA均明显上调,EMT标志物β-catenin同样表达上调 (图2B)。在培养7 d后检测各培养组(hBMSCs、MCF7和hBMSCs+MCF7组)相关EMT标志分子,均出现上皮性标志物表达下调,间皮标志物上调的现象(图2C~E)。
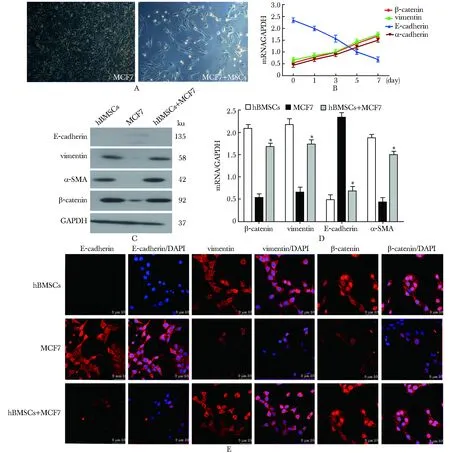
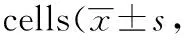
图2人乳腺癌细胞MCF-7与hBMSCs共培养后表现出EMT的特征性变化
Fig2MCF-7cellsexhibitEMTchangesafterco-culturedwithhBMSCs
2.3 旁分泌机制促进MCF- 7细胞发生EMT转换并促进MCF- 7细胞的增殖、侵袭及转移
提取共培养时的条件培养基,直接作用于MCF7细胞。作用24 h后,MCF- 7细胞发生梭形改变(图3A)。与在普通培养基中增殖的MCF7细胞相比,条件培养基培育下的细胞上皮性标志物下调,间质性标志物表达上升(图3B)。MCF- 7细胞加入条件培养基共培养5 d后,增殖能力明显上调(图3C),促进细胞周期G1/S 转化,周期变快(图3D),侵袭和迁移能力分别增强(图3E~F)。
A.cell morphology of MCF7 cultured with normal condition or co-cultured medium (Co-CM) condition for 24 hours(×100); B.protein expression level of EMT markers with or without co-cultured medium for 5 days; C.cell viability of MCF7 cells; D.changes of cell cycles of MCF7 cells; E.changes of cell invation of MCF7 cells; F.changes of cell migration of MCF7 cells;*P<0.01 compared with MCF7 cultured with normal condition
图3旁分泌机制促进MCF-7细胞发生EMT转换并促进MCF-7的增殖、侵袭及转移
Fig3ParacrinemechanismpromotesEMTtransformation,proliferation,invasionandmetastasisofMCF-7cells
2.4 人乳腺癌细胞MCF- 7与hBMSCs共培养后对MCF凋亡未产生影响(图4)
3 讨论
上皮间质转化(EMT)一直以来都是肿瘤研究的热点,绝大部分肿瘤转移时中往往会丢失上皮特征发生EMT。上皮细胞发生EMT后脱离基底层,细胞变化呈纤维细胞样,获得侵袭及迁移能力,有利于肿瘤细胞发生转移[7]。有研究组发现人骨髓间充质干细胞(hBMSCs)可以促进乳腺癌的增殖和转移,但是目前尚未有关于EMT与hBMSCs之间相互关系的研究报道[8]。为进一步阐明hBMSCs是否通过影响肿瘤细胞的EMT而促进肿瘤细胞侵袭和转移,本研究将乳腺癌细胞系MCF7与hBMSCs采用Transswell系统间接共培养,结果表明经过共培养后,上皮标志性基因(E-cadherin)与间质标志性基因(vimentin、α-SMA)及β-catenin均有明显的改变。因此提示在乳腺癌微环境中的hBMSCs可能通过分泌细胞因子等方式改变乳腺癌微环境,启动乳腺癌细胞的EMT,进而促进乳腺癌发生转移。
接下来检测了EMT的发生是否是通过活化的MCF7细胞或者hBMSCs分泌细胞因子来促进的。提取共培养时的条件培养基,直接作用于MCF7细胞,细胞由原来的多边形变成明显的长梭形细胞,伸出伪足,这种现象最早可在24 h就出现,MCF- 7细胞的EMT标志物都发生相应改变。同时条件培养基还促进细胞增殖,周期加快,在Transwell模型中同样促进了MCF- 7细胞的侵袭迁移。因此可以推断条件培养中存在的旁分泌信号促进乳腺癌细胞发生EMT,并且这种信号促进乳腺癌细胞增殖,提高其侵袭迁移的能力。
但是肿瘤微环境中hBMSCs影响EMT的具体机制尚不清楚,还有待进一步的研究。本研究的意义在于揭示了被募集至肿瘤微环境中的hBMSCs通过旁分泌机制促进EMT的发生,从而调控乳腺癌细胞的增殖、侵袭和转移,为临床上进一步地探索预防及治疗乳腺癌的侵袭和转移提供理论依据及可能的干预靶点。
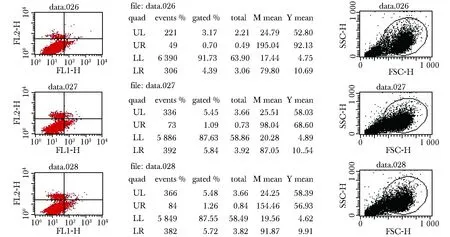
图4 人乳腺癌细胞MCF7与hBMSCs共培养后对其凋亡的影响Fig 4 Effect on apoptosis of MCF7 after co-culture with hBMSCs

