溶氧波动对湖泊沉积物氧化亚氮产生和氮物质转化的影响
梁 霞,李彬彬,孙弋祺,张文静,李卫平
(1.上海大学环境与化学工程学院,上海200444;
2.内蒙古科技大学能源与环境学院,内蒙古自治区包头,014010)
由于温室气体排放而导致的全球变暖问题已日益显著[1].作为一种重要的温室气体,氧化亚氮(N2O)的全球增温潜能(global warming potential,GWP)约是CO2的320倍,且其对总GWP的贡献未来可能增加到10%[2].湖泊是淡水生态系统中的重要氮“汇”[3].随着近年来人类活动干扰的不断加剧,湖泊中外源氮输入负荷呈增加趋势,由此产生的富营养化对湖泊系统的氮物质循环及N2O排放产生了重要影响.已有研究表明,富营养湖泊水体中的N2O饱和度明显高于贫营养和中度富营养湖泊[4].
一般而言,N2O主要通过微生物脱氮过程中的硝化、反硝化和氨氧化产生,其中溶氧(dissolved oxygen,DO)在平衡硝化和反硝化过程以及决定系统N2O产量中扮演着重要的角色[5].研究表明,湖泊系统中的N2O排放通量随着水体深度的降低和DO浓度的上升而增加,其中湖泊滨岸带的N2O排放量通常最高[6].这是由于湖泊滨岸带浅水位受到水文干扰和水气交换的影响,其沉积物-水界面的DO浓度高于湖心,而高DO浓度又促进了硝化和反硝化进程的同时加速,增加了沉积物N2O的产生.因此,相对于DO浓度较为稳定的河流和湿地系统,湖泊中DO浓度的改变对于N2O的排放具有重要的影响.目前,国内外对于湖泊N2O排放的研究相比河流和湿地系统仍较少,这很大程度上是由于湖泊系统中较低的DO水平限制了湖泊微生物的硝化、反硝化过程,使得N2O总排放量显著低于河流和湿地系统[7].因此,研究DO改变对于富营养化湖泊N2O排放的影响,对于深入理解湖泊系统对于全球N2O总量的贡献作用,以及富营养化湖泊系统中的氮循环过程,具有重要的意义.
在草型浅水湖泊中,由于水生植物光合呼吸作用的影响,水体及沉积物表层的DO浓度往往呈现剧烈的昼夜波动[8].如果湖泊存在大量的人为氮源输入,水体及沉积物中的不完全的硝化/反硝化过程将会随着DO浓度的昼夜波动而反复出现,并最终影响水体中氮物质的去除以及N2O的产生[9].本工作以一个受人为氮源输入影响的草型富营养化浅水湖泊为例,在实验室条件下研究DO浓度剧烈变化对于湖泊沉积物中N2O产生以及氮物质去除的影响,揭示DO的影响作用机制,为全面理解湖泊系统N2O产生以及草型浅水湖泊的氮循环过程提供参考.
1 实验材料与方法
1.1 研究区域
沉积物采集自乌梁素海湖.乌梁素海湖是我国第八大淡水湖,位于内蒙古高原西部干旱区,属于典型的浅水草型湖泊[10].湖区整体呈狭长型,南北长35∼40 km,东西宽5∼10 km.2011年的监测数据显示,湖泊水域面积459.03 km2,平均水深1.5 m,最深处可达4.0 m[11].区域内年均气温5.6∼7.4°C,年均湿度28%∼104%,平均降雨量为162.3 mm,蒸发量2 253.5 mm[12].湖区内主要分布着以挺水植物芦苇和沉水植物龙须眼子菜群落为优势的水生植物群落[13].农田退水是乌梁素海湖的主要补给水源.受河套灌区农田退水的影响,大量营养盐随之输入乌梁素海湖,致使湖泊水体氮物质平均含量超过国家地表水环境质量标准中Ⅴ类水体的氮浓度水平[14].近十年来,乌梁素海湖富营养化呈现加剧趋势,已逐渐成为富营养化草型浅水湖泊[15].
1.2 沉积物样品采集
湖泊沉积物采集自乌梁素海湖泊北部的西大滩.该区域靠近湖区主要农业退水排水口(总排干),湖泊表层沉积物呈现黑灰色且伴有腥臭味,以粉细颗粒组成为主,下部为浅黄色原土质.该区域沉水植物生长密集,且大多已在水面形成茂密的水生植物冠层.采样点选择在沉水植物生长区周边的一块裸露区域,水体呈现淡绿色,清澈见底,水深1.68 m,流速0.12 m/s.使用抓斗式采泥器采集表层沉积物,置于密封袋中低温保存,并于当天运回实验室置于4°C冰箱储存.
1.3 实验设计
在实验室内首先将湖泊沉积物风干过100目筛,取50 g土壤样品置于100 mL锥形瓶内,并缓慢加入蒸馏水使上覆水体积至40 mL;然后,用装有三通阀的塞子密封锥形瓶,其中一根导管接在三通阀底部并置于泥水界面,另一根导管暴露在瓶内顶空位置;最后打开三通阀门,将锥形瓶置于28°C恒温人工气候培养箱(RTOP-300D,由浙江托普仪器有限公司提供)进行5 d预培养.设置处理组和空白对照组总计120个锥形瓶样品.处理组通过人为控制水体溶氧浓度,使之呈现出昼夜变化趋势(2.0∼12.0 mg/L);空白对照组无任何额外操作,仅每天补充水体保持原水位不变.处理组DO浓度的变化范围参照湖泊水体DO浓度现场监测的结果进行设置.实验为期20 d.在实验开始前测定处理组水体DO浓度,随后密封瓶口并关闭阀门,每隔0.5 h向水体缓慢注入不同剂量纯氧,同时排出相应体积顶空气体,使DO浓度呈现随时间变化的趋势.具体操作方法如下:实验开始后的4 h内,使水体DO浓度保持在2.0∼5.0 mg/L,4∼8 h内水体DO浓度保持为5.0∼9.0 mg/L,9∼12 h内水体DO浓度为9.0∼12.0 mg/L;随后12∼24 h内,关闭人工气候室光照并停止向实验组补充纯氧.此时,由于沉积物微生物呼吸作用,水体DO浓度呈现自然下降趋势,至实验开始后的18 h内,DO浓度降至6.0∼7.0 mg/L,至24 h后降至2.0 mg/L左右.空白对照组不补充纯氧,仅通过大气补给调节沉积物-水界面的DO浓度.由于所采集的沉积物中有机质和氮营养盐含量丰富,对照组水体DO在好氧微生物作用影响下消耗明显.实验期间空白对照组DO溶度保持为3.0∼4.0 mg/L.
1.4 实验样品的采集与分析
(1)气体样品.实验开始后,每隔4 h收集50 mL顶空气体并置于真空采样袋中,同时采集实验室空气作为背景值.使用带电子捕获检测器(electron capture detector,ECD)的气相色谱仪(安捷伦6890N)测定N2O浓度[16],使用内填80/100目Porapark-Q填料的不锈钢填充色谱柱(3 m×3 m),柱温70°C,高纯N2(浓度>99.999%)载气,流量25 mL/min,检测器温度为330°C.使用带热导检测器(thermal conductivity detector,TCD)的气相色谱仪(HP5890)测定N2浓度[17],使用HP-5A分子筛色谱柱(30 m ×0.32 mm,25µm),柱温40°C.高纯氩气(浓度>99.999%)载气,流量5 mL/min.检测器温度100°C,手动进样,进样量200µL.锥形瓶中顶空N2O和N2浓度分别以µmol/L和mmol/L表示.气体饱和度为[18]

式中,

其中Cw为气体在锥形瓶水相中的浓度,Cq为自然条件下水体中的气体饱和浓度,CA1为锥形瓶中的顶空气体浓度,CA为气体的大气浓度,VA1为锥形瓶中的顶空体积,Vw为锥形瓶中水相的体积,α为Bunsen系数.
(2)水体样品.气体采样结束后打开瓶塞,使用便携式溶氧仪(HI 98186,意大利哈纳公司)、氧化还原电位仪(PHSJ-3F,上海精密科学仪器有限公司)和pH计(PHS-3C,上海精密科学仪器有限公司)测定水体DO、氧化还原电位(oxidation-reduction potontial,ORP)、pH值和温度.每隔24 h采集实验组和空白组水样,参照国标方法测定水体离子浓度(总氮、氨氮、硝酸根离子、亚硝酸根)[19].每隔7 d测定水体的溶解有机碳(dissolved organic carbon,DOC)浓度.DOC浓度采用总有机碳(total organic carbon,TOC)分析仪(Analytik Jena AG Multi N/C 3000,德国)测定.上述样品均重复测试3次.
(3)沉积物和孔隙水样品的采集与分析.实验开始后,每隔7 d采集孔隙水样品,测定孔隙水TOC和DOC浓度.实验结束后,采集沉积物样品,测定潜在硝化速率(potential nitrif i cation rate,PNR)、潜在反硝化速率(potential denitrif i cation rate,PDR)、潜在氨氧化率(potential ammonia oxidation,PAO)和潜在亚硝氮氧化率(potential nitrite oxidation,PNO).具体操作方法如下:待气样、上覆水样品均采集完成后,采用孔隙水采样器(Rhizon)采集沉积物不同深度的孔隙水,混合后过滤(0.45µmol/L滤膜)用于测定,所有样品均重复测试3次;采集不同深度的沉积物40 g,混合后分成2份装入自封袋中,其中1份用于测定PNR,PDR,PAO和PNO,另一份保存在4°C冰箱中,用于测定沉积物的含水率和碳氮含量.采用烯丙基硫脲(allyl thiourea,ATU)抑制法测定[20].潜在反硝化速率用乙炔抑制法测定[21].氨氧化速率和亚硝酸速率按照Niboyet A[14]的方法测定.用于沉积物含水率测定的样品在105°C的烘箱内烘6∼8 h至恒重,沉积物TOC含量和总氮(total nitrogen,TN)浓度采用利曼元素分析仪EA3000进行测定.
1.5 统计分析
实验数据采用SPSS 18.0进行统计分析,使用单因素方差分析(one-factor analysis of variance,one-ANOVA)表征测量值间的差异显著性,显著性水平为0.05.使用Pearson相关性检验分析N2O排放通量与各环境因子之间的相互关系,并筛选出与N2O排放通量具有显著相关性的环境因子进行回归分析.使用SPSS 19.0软件进行方差分析、Pearson检验和回归分析.使用OriginPro 8.5进行数据结果绘图.
2 结果与讨论
2.1 水体DO浓度和沉积物ORP值
图1为实验期间水体DO浓度和沉积物ORP的变化曲线.由图1可以看出;随着时间的推移,处理组水体DO浓度为1.46∼13.8 mg/L,ORP为−240∼−10 mV,且二者表现出较为一致的变化趋势;与之相反,空白对照组的DO和ORP水平则保持相对稳定状态,平均值分别为3.29±0.07 mg/L和−204.41±1.36 mV.通常情况下,水体中的DO水平变化会影响沉积物的ORP值.已有研究表明,土壤中的ORP介于−100∼400 mV时,微生物硝化和反硝化过程均无法完全进行,中间产物N2O的释放量将同时增加[22].因此,处理组DO和ORP水平的提高,将有可能促进系统中N2O的排放.

图1 实验期间水体DO浓度和沉积物ORP的变化Fig.1 Variations of water DO concentrations and sediment ORP during experimental periods
2.2 N2O和N2浓度
图2为实验期间N2O和N2的浓度变化曲线.由图2可以看出:实验期间,处理组N2O和N2的浓度均表现出随水体DO和沉积物ORP变化而变化的趋势;而与之相反,空白对照组中的气体浓度波动较小.此外,处理组最大N2O浓度和平均浓度均显著高于空白对照组.在处理组中,顶空N2O浓度变化为69.91∼161.61µmol/L,平均浓度为116.08±4.14µmol/L,较之空白组(84.95±0.31µmol/L)约增加26.82%.处理组中的N2浓度相较空白对照组也出现了明显的波动变化,介于35.27∼41.46 mmol/L之间,但N2的平均浓度(38.83±1.78 mmol/L)显著低于空白对照组(40.09±0.25 mmol/L).为了进一步验证水体N2O和N2饱和溶解度对水体DO浓度变化的响应,进行相关性分析,结果如图3所示.DO浓度与N2O饱和度呈现出显著的正相关关系(y=202.38x0.36,r2=0.685),而与N2饱和度间呈显著负相关关系(y=126.99 x−0.067,r2=0.842).已有研究表明,河流水体DO浓度与沉积物N2O产生速率具有显著的正相关性[23],而湿地系统中较高的溶氧环境也是造成系统中N2O大量释放的主要原因[24].因此,DO浓度的剧烈变化以及平均DO浓度的增加,促进了实验系统中不完全硝化-反硝化过程持续进行,从而造成N2O产量增加和N2排放量的下降.
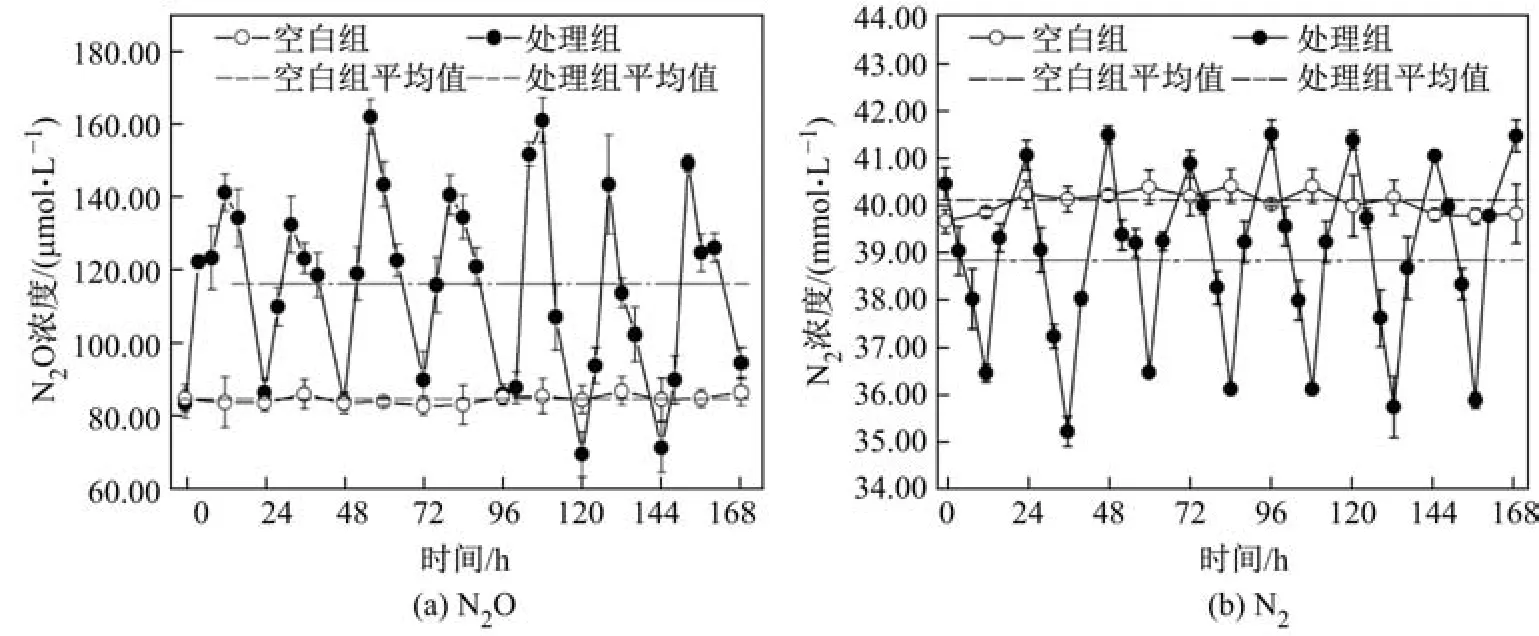
图2 实验期间N2O和N2的浓度变化Fig.2 Variations of N2O and N2concentrations during experimental periods

图3 实验期间水体DO浓度与N2O和N2饱和溶解度的相关性Fig.3 Linking DO concentration and N2O-saturation,N2-saturation
2.3 碳氮物质浓度


图4 实验期间上覆水和孔隙水氮物质浓度的变化Fig.4 Variations of nitrogen concentrations in overlying water and pore water during experimental periods
图4为实验期间上覆水和孔隙水氮物质的浓度变化曲线,由图4可以看出,沉积物中的有机碳和氮物质不断释放进入上覆水体,导致实验装置中水体TN,NH4-N,NO3-N和NO2-N的浓度都呈现出随时间推移而逐渐增加的趋势,并于8∼16 d达到最高浓度,之后逐渐下降;从第6天开始,处理组水体TN和NH4-N浓度较之对照组均表现出显著的下降趋势,而处理组的NO3-N浓度则出现了显著上升;处理组和对照组的NO2-N浓度无显著差异.作为N2O产生的底物,自然环境中NO2-N存在并积累.由于多种还原酶之间的电子竞争,以及氧化亚氮还原酶对电子较弱的亲和力,导致系统中N2O积累[5].对沉积物孔隙水氮浓度变化进行分析,结果表明:孔隙水TN,NH4-N和NO3-N,NO2-N浓度表现出与上覆水体一致的变化趋势,其中处理组孔隙水TN和NH4-N浓度在实验开始后的第7天开始出现显著下降,至实验结束后仍低于空白对照组;NO3-N和NO2-N浓度在第7天时开始显著上升,其浓度在实验结束时与对照组无明显差异.
图5为实验期间上覆水和孔隙水DOC浓度的变化曲线.由图5可以看出:相较于空白对照组,处理组中的DOC浓度出现了显著下降,尤其是在实验结束时,孔隙水DOC浓度降幅达到30.39%.沉积物中的有机碳和氮物质浓度如表1所示.由表1可知,处理组沉积物TN,NH4-N含量出现了显著的下降,而NO3-N和NO2-N含量则无明显变化.这说明处理系统沉积物中的硝化、反硝化过程都得到加强,其中反硝化作用加速了系统中硝酸盐消耗[25].此外,处理组中的TOC和DOC含量也出现了显著降低,,表明该系统中沉积物微生物活性受到溶氧改变的影响而增强[26],其对于有机碳的消耗量也相应增加.综上分析可知,剧烈的水体DO浓度变化和较高的平均DO浓度,促进了处理组系统中的硝化和反硝化反应过程,并使系统表现出显著的脱氮效果.

图5 实验期间上覆水和孔隙水DOC浓度的变化Fig.5 Variations of DOC concentrations in overlying water and pore water during experimental periods

表1 实验期间沉积物中有机碳和氮物质的浓度Table 1 Organic carbon and nitrogen concentrations of sediments during experiment periodsmg/kg
2.4 PNR,PDR,PAO,PNO
实验结束后,对硝化反应过程中的氨氧化和亚硝氮氧化以及潜在硝化和反硝化速率进行分析.表2为实验期间沉积物PNR,PDR,PAO和PNO的变化.结果表明,处理组中的微生物硝化和反硝化活性都显著高于空白对照组,其中代表硝化反应过程的PAO和PNO分别增加了22.07%和33.34%,而表征反硝化微生物活性的PDR增加了42.37%.通常情况下,硝化过程可分为两个阶段进行,其中PAO可用于表征第一阶段亚硝化过程的生物酶(如氨单加氧酶、羟胺氧化酶)活性,而PNO则反映第二阶段硝化过程的生物酶(如亚硝酸盐氧化还原酶)活性[26].处理组水体DO增加,扩大了表层沉积物中的有氧层面积,进而有利于硝化反应的进行[27-28].尽管反硝化过程会由于DO浓度增加而受到抑制,但研究表明,NO3-N作为反硝化过程的关键底物,对反硝化过程的限制作用远高于溶氧[29].因此,处理组增强的硝化反应过程可以为沉积物反硝化细菌提供丰富的NO3-N底物,从而促进反硝化微生物活性以及反硝化过程的进
行[30-31].

表2 实验期间沉积物PNR,PDR,PAO和PNO的变化Table 2 Variations of PNR,PDR,PAO and PNO in sediments during experimental periods
3 结束语
DO浓度的昼夜波动以及DO平均浓度的增加,促进了水体NH4-N向NO3-N的转化,并增加了中间产物N2O的产生,这主要是由于水体DO浓度昼夜波动促进系统硝化和反硝化耦合过程.因此,在草型富营养化湖泊中,由水生植物光合呼吸作用引起的水体DO浓度昼夜剧烈波动,将有可能促进湖泊N2O排放并改变沉积物中的氮物质循环过程.然而,由于野外环境条件下N2O的排放还会受到其他因素的综合影响,因此后续研究中需要加强野外条件下的监测和分析工作,明确昼夜DO在富营养化浅水湖泊氮物质循环中所扮演的角色.

