酒石酸作为碳同位素内源标志物在食品掺假检测中的应用
张佩敏,钟其顶*,王道兵,岳红卫,李国辉
1(中国食品发酵工业研究院,北京,100015) 2(全国食品发酵标准化中心,北京,100015)
随着人民生活水平不断提高,健康、纯天然的高品质食品逐渐受到消费者青睐。然而,受经济利益的驱使,一些不法商家为降低成本,采用掺假掺杂、混乱标注等手段制造假冒伪劣食品,如葡萄汁中外源添加廉价糖,用“三精一水”配制“葡萄酒”等[1]。因此,对食品进行真实性检验已成为现代食品检测研究的重要内容[2],但传统的理化、感官分析等方法难以解决上述廉价原料和混乱标注问题。稳定同位素技术探究食品(或其特征组分)的原子水平信息,可鉴别不同来源的同种化合物,因此在食品掺假检测中发挥着重要作用[3],在蜂蜜[4]、果汁[5]、葡萄酒[5]等食品的真伪鉴别中发挥着重要作用,其中一些方法已被欧洲标准委员会(Comité Européen de Normalisation,CEN)、美国分析化学家协会(Association of Official Analytical Chemists,AOAC)采纳为标准方法。
分馏是同位素的自然属性[2],同类食品/化合物的同位素特征也会在一定范围内波动,因此当前同位素技术的应用以同位素数据库的建设为前提,如CEN建立了欧洲葡萄酒同位素数据银行,国际果蔬汁行业协会(Sure-Global-Fair,SGF)建立了全球果汁同位素数据库,但数据库的构建与维护成本高昂,也难以涵盖所有样品。利用同位素内源标志物建立食品的稳定同位素指纹图谱是近年来的研究热点[2]。内源标志物(以下简称内标物)是指与目标物来源相同或相关,且同位素组成具稳定、良好的相关性的一类物质[6-7]。如蜂蜜和果汁造假时普遍掺入廉价糖浆,但蜂蜜的总糖与蛋白质δ13CVPDB值密切相关[8],果汁的总糖与果肉δ13CVPDB值相近[9]。近年来,CABANERO[10]和ELFLEIN[11]等人分别研究了蜂蜜中葡萄糖、果糖和蔗糖的碳同位素特征,互相作为内标物以提高蜂蜜真伪鉴别能力;GUYON曾分析了20个法国葡萄酒样品的甘油和乙醇的δ13CVPDB特征,但由于甘油在葡萄酒感官体验中的重要作用而易被掺假,因此限制了甘油作为内标物的应用[14]。
酒石酸(tartaric acid)是葡萄汁和葡萄酒中的主要有机酸和特征酸[13]。虽然GB2760中允许酒石酸作为食品添加剂加入葡萄酒,但如果葡萄汁的糖酸比平衡,就不存在外源添加酒石酸的情况。当前一些厂家打出了“完全无添加”葡萄酒的旗号,打造高端葡萄酒产品[14],针对此类葡萄酒中是否含有外源酒精的检测问题,可以尝试以酒石酸进行碳同位素内标物的应用研究。
本课题研究了葡萄汁和葡萄酒中总糖、乙醇和酒石酸的同位素分布特征,分析发酵过程对酒石酸碳同位素组成的影响,并探讨酒石酸作为葡萄汁中总糖的碳同位素内标物、作为葡萄酒中乙醇的碳同位素内标物在掺假检测中应用的可行性。
1 材料与方法
1.1 材料与试剂
氦气、二氧化碳气体(纯度99.99%),北京北温气体制造厂;丙酮(色谱纯),DUKSAN Pure Chemicals;Ca(OH)2、NaOH和HCl(分析纯),北京化学试剂厂;乙醇RM(色谱纯,国产,室标reference material δ13CVPDB=-10.98‰);IAEA-CH-6[国际原子能机构,δ13CVPDB=(-10.45±0.2)‰];IAEA-601[国际原子能机构,δ13CVPDB=(-27.77±0.04)‰];锡杯,Element Microanalysis公司产品。
从4个庄园收集16个葡萄酒样品,其中8个完全无添加,8个添加外源乙醇。2个标识为有机葡萄酒(完全无添加),购于某超市。2016年8~10月,采集4个不同产区的酿酒葡萄,每个产区取样2份,共计8份酿酒葡萄。
1.2 仪器与设备
气相色谱-燃烧-稳定同位素比值质谱仪(GC-C-IRMS):Delta V Advantage 稳定同位素比值质谱仪(美国Thermo Fisher公司),配备Ultra Trace GC气相色谱与IsoLink接口,以及Triplus自动进样器;HP-INNOwax气相色谱柱(30 m×0.25 mm×0.25 μm,安捷伦科技(中国)有限公司);元素分析仪(EA):与GC-C-IRMS共用稳定同位素比值质谱仪,配备Flash 2000元素分析仪;HPLC:Waters 2695 高效液相色谱仪;配备waters 2998 紫外检测器(安捷伦科技(中国)有限公司);LiChrospher 100RP18色谱柱(5 μm×500 mm×30 mm,德国Merk公司);阳离子交换柱(10 g,Ag50W-X8,200-400 mesh),阴离子交换柱(10 g,Ag1-X8,200-400 mesh,北京泰泽瑞达科技有限公司);离心机(美国Sigma公司);冷冻干燥机(北京亚泰科隆仪器技术有限公司);电热恒温水浴箱(北京中慧天诚科技有限公司);十万分之一电子天平(瑞士Mettler-Toledo公司)。
1.3 试验方法
1.3.1 样品前处理
1.3.1.1 乙醇的前处理方法[15]
根据测定线性范围(2~10 V)及色谱条件,用丙酮将样品稀释至乙醇含量约8 g/L。
1.3.1.2 总糖提取方法[9]
选取健康无破损葡萄榨汁后过滤,取40 mL滤液,加入1.6 g Ca(OH)2粉末,混合均匀并于90 ℃水浴3 min后将上述热溶液转移至50 mL离心管中,1 400×g离心3 min,去除沉淀,用0.1 mol/L H2SO4溶液调节上清液至pH为5.0;将酸化后的上清液置于4 ℃冰箱静置约15 h,再次离心去除沉淀,将溶液冷冻干燥,并均质成粉末后待测。
1.3.1.3 酒石酸的分离方法[16]
应用5 mol/L的HCl溶液活化阳离子交换柱(10 g,Ag50W-X8,200-400 mesh)后,将葡萄酒或发酵液离心取上清液50 mL,用5 mol/L的HCl溶液调节至pH为1.7后上样,用100 mL的25 mmol/L HCl溶液洗脱,氨基酸等阳离子保留于柱体内,收集完整的洗脱液并用5 mol/L NaOH溶液调节pH至 7.0,在阳离子交换柱(10 g,Ag1-X8,200-400 mesh)(活化条件同上)上样,用200 mL超纯水淋洗,做快速测试(颜色反应),确保所有糖均被洗脱。将完全洗脱的糖,应用100 mL 1 mol/L HCl溶液洗脱,将该洗脱液在60 ℃下旋转蒸发浓缩至2.5 mL左右,过0.22 μm滤膜,根据检测信号在线收集整个酒石酸峰的馏出液,备用。
1.3.1.4 葡萄汁发酵
葡萄榨汁取200 mL,加入0.04 g偏重亚硫酸钾(防止发酵过程杂菌干扰),加入1 g活性干酵母在30 ℃条件下恒温厌氧发酵至恒重,每种样品重复发酵2次。
1.3.2 仪器条件
1.3.2.1 GC条件[15]
载气为氦气,柱流速1.2 mL/min;进样口温度240~270 ℃;升温程序为:起始温度40 ℃,保持5 min,以1 ℃/min 升温至50 ℃后保持1 min,再以15 ℃/min 升温至250 ℃并保持2 min;进样体积1 μL;分流比10∶1。
1.3.2.2 乙醇转化条件
燃烧转化装置(IsoLink)中配备陶瓷(Al2O3)氧化管(填料为CuO,NiO和Pt),工作温度为1 000 ℃。
1.3.2.3 EA条件[9]
氧化管温度980 ℃,还原管温度680 ℃,柱温60 ℃,氦气流速100 mL/min,氧气充入时长为3 s(流速250 mL/min);称取0.1 mg有机物于锡杯中,包样后测定。
1.3.2.4 HPLC制备条件[16]
流动相20 mmol/L H3PO4;柱温30 ℃;流速3 mL/min。
1.3.2.5 IRMS条件
离子源电压2.97 kV,真空度1.8×10-6mbar,轰击电压120.8 eV。
1.4 校准与计算
基于国际基准物质V-PDB(Vienna Pee Dee Belemnite Standard,13C/12C=0.011 237 2)得出样品中组分δ13CVPDB值(‰):δ13CVPDB=(13C/12C)样品值/(13C/12C)参考值。IAEA-CH-6(δ13CVPDB)作为实际测定中的参考物质。
采用Excel 2010进行数据处理,采用Origin 9.0绘图。
2 结果与分析
2.1 葡萄汁中酒石酸与总糖碳同位素特征
收集不同产地的酿酒葡萄样品,按照1.3方法测定葡萄汁总糖和酒石酸的δ13CVPDB值,每个样品测定2次,结果见表1。

表1 葡萄汁总糖、酒石酸δ13CVPDB值比较Table 1 Comparison δ13CVPDB values of sugar content and tartaric acid in musts
表1数据表明,4个产地的样品具有不同的同位素特征,总糖和酒石酸δ13CVPDB的分布范围分别为-28.13‰~-23.25‰和-24.48‰~-20.02‰,这是由于酿酒葡萄取自我国4个不同产区,各产区气候条件相差较大,影响了同位素的分馏。对比酒石酸和总糖,酒石酸δ13CVPDB明显比总糖偏正,这是因为葡萄生长过程中以葡萄糖(C6H12O6)为底物在相关酶的作用下产生酒石酸(C4H6O6),该过程有碳原子损失。根据Rossmann的研究结果[17],葡萄糖上6个碳位点上的13C/12C比值为非统计学分布,相对于葡萄糖分子的δ13CVPDB值,C3偏正1.9‰,C4偏正6.3‰,而C1偏负1.3‰,C2偏负0.9‰,C5偏负1.1‰,C6偏负4.5‰;葡萄糖代谢产生含有6个碳的L-抗坏血酸,6个碳原子均来源于葡萄糖,因此同位素丰度不变,L-抗坏血酸经五步代谢过程得到L-酒石酸,中间物质依次为2-酮-L-葡萄糖酸、L-艾杜糖酸、5-酮-D-葡萄糖酸、L-threo-tetruronate[5],最后通过C4~C5裂解途径产生酒石酸与乙醇酸[18],5号碳与6号碳的损失导致酒石酸相对葡萄糖δ13CVPDB偏正。但是二者差异并非固定值,这可能与葡萄生长环境导致葡萄糖6个碳位点上13C/12C比值不同有关。
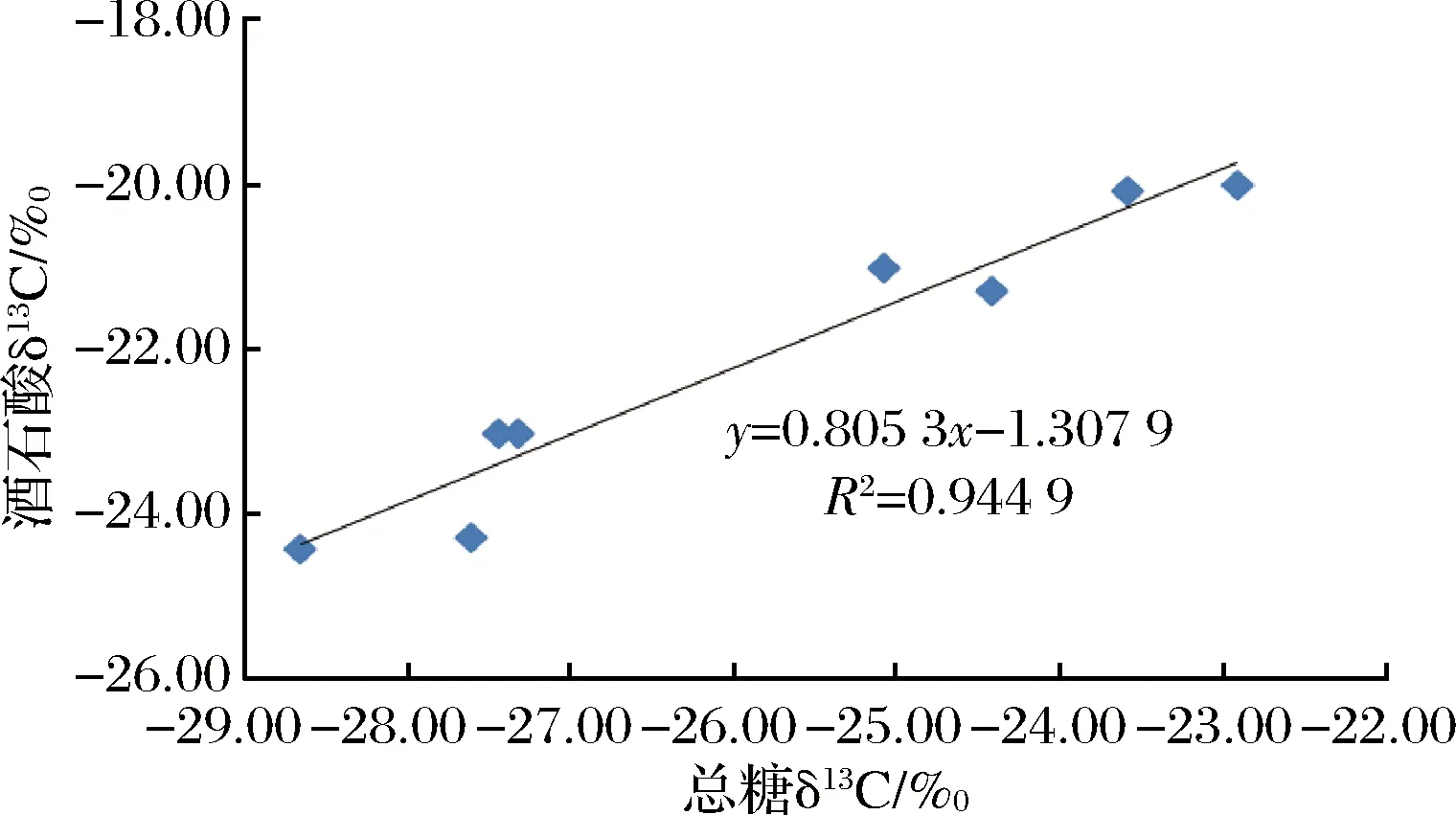
图1 葡萄汁中总糖和酒石酸δ13CVPDB值之间的相关性Fig.1 Correlation of δ13CVPDB values between sugar content and tartaric acid in musts
以总糖δ13CVPDB值为横坐标,酒石酸δ13CVPDB值为纵坐标,绘制其相关性曲线,图1表明总糖与酒石酸碳同位素值存有差异,但二者具有良好相关性(相关系数R2=0.944 9)。选择A产区的葡萄汁样品,以C4糖和蒸馏水为基础配制与葡萄汁浓度相同的糖水溶液,按等比例向葡萄汁样品中加入上述糖水溶液,混合均匀后测定总糖与酒石酸δ13CVPDB值,可以看出总糖δ13CVPDB呈现逐步偏正的趋势,但酒石酸δ13CVPDB值并未出现变化(见图2),说明酒石酸可以作为总糖的碳同位素内标物对葡萄汁进行掺糖检测。
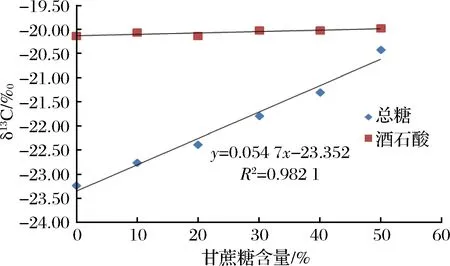
图2 添加不同比例的C4糖后葡萄汁中总糖与酒石酸δ13CVPDB变化Fig.2 Change curve of the δ13CVPDB value of sugar content and tartaric acid with different ratio of C4 sugar
2.2 酒精发酵对葡萄汁中酒石酸δ13CVPDB影响
为探究酒精发酵对葡萄汁中酒石酸δ13CVPDB影响,按照1.3中方法发酵4个产区的葡萄汁,每个产区选取1个样品,每个样品发酵2份并重复测定3次,结果见表2。
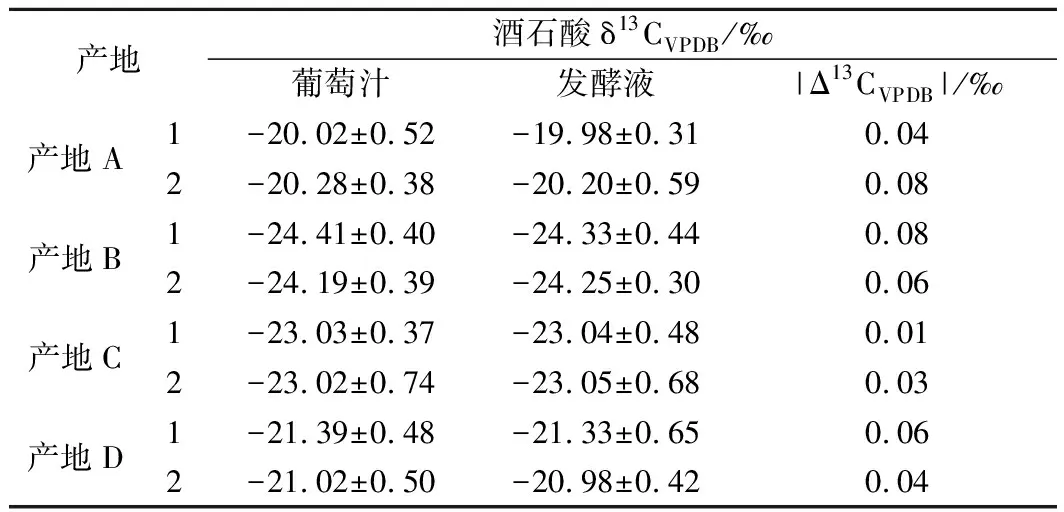
表2 酒精发酵前后酒石酸δ13CVPDB值的变化Table 2 Change of δ13CVPDB values of tartaric acid during fermentation
由表2可知,尽管4个庄园葡萄汁/葡萄酒的酒石酸δ13CVPDB值不同,但葡萄汁发酵前后酒石酸的δ13CVPDB值基本不变(|Δ13CVPDB|<0.1‰),这说明发酵过程中不会改变葡萄汁中酒石酸的碳同位素组成特征。
2.3 酒石酸与乙醇碳同位素特征相关性分析
按照1.3与1.4前处理步骤,测定发酵液中乙醇δ13CVPDB,对比酒石酸与乙醇结果见表3。
由表3数据可知,发酵前葡萄汁总糖δ13CVPDB值分布范围为-28.65‰~-22.91‰,发酵后乙醇δ13CVPDB值分布范围为-29.93‰~-24.23‰,发酵糖δ13CVPDB与对应发酵液中乙醇δ13CVPDB也不完全一致,差异分布范围为-2.03‰~-1.10‰,乙醇比原料葡萄汁总糖的δ13CVPDB值更偏负。尽管如此,乙醇与总糖之间具有明显的正相关性,相关系数可达0.98,既然在葡萄汁中,酒石酸可作为总糖的内标物,且2.2的研究表明发酵过程不影响酒石酸δ13CVPDB值,则酒石酸与乙醇之间必然存在良好相关性。为探究葡萄酒中酒石酸与乙醇的关系,以酒石酸δ13CVPDB值为横坐标,乙醇δ13CVPDB值为纵坐标,绘制相关性曲线,结果见图3。由图3可知,在发酵液中,乙醇与酒石酸具有良好的相关性,相关系数可达0.96。
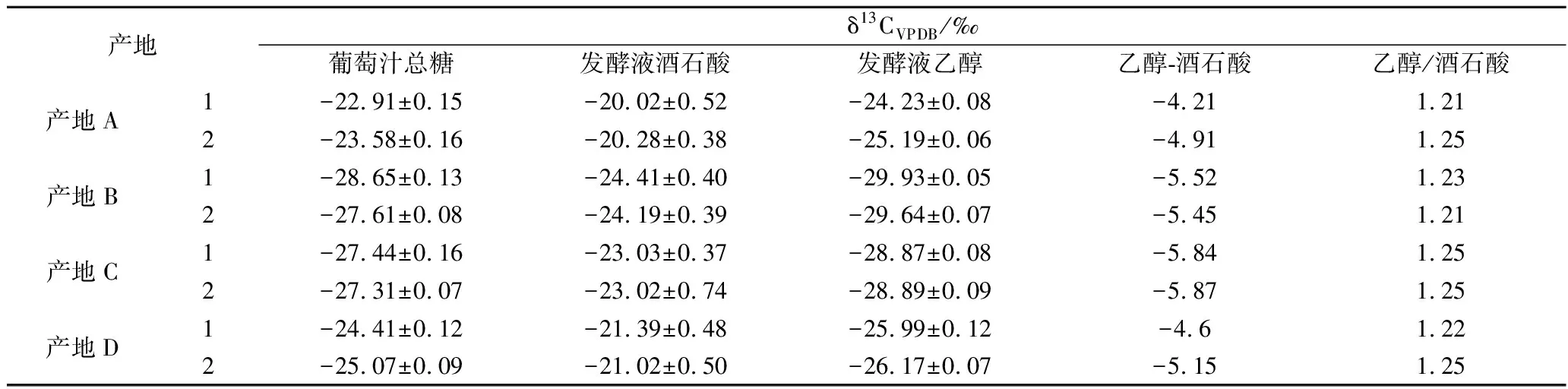
表3 葡萄汁总糖、发酵液中乙醇与酒石酸δ13CVPDB值的比较Table 3 Comparison δ13CVPDB values of sugar content in musts and ethanol, tartaric acid in fermentation liquor
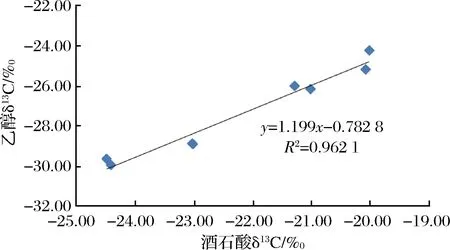
图3 发酵液中乙醇和酒石酸δ13CVPDB值之间的相关性Fig.3 Correlation of δ13CVPDB values between ethanol and tartaric acid in fermentation liquor
以玉米酒精和蒸馏水为基础配制与葡萄酒浓度相同的乙醇水溶液,按等比例向葡萄酒样品中加入上述乙醇水溶液,混合均匀后测定乙醇与酒石酸δ13CVPDB值,结果如图4所示。可以看出乙醇δ13CVPDB呈现逐步偏正的趋势,但酒石酸δ13CVPDB值并未出现变化,说明酒石酸可以作为乙醇的碳同位素内标物对葡萄酒进行掺乙醇检测。
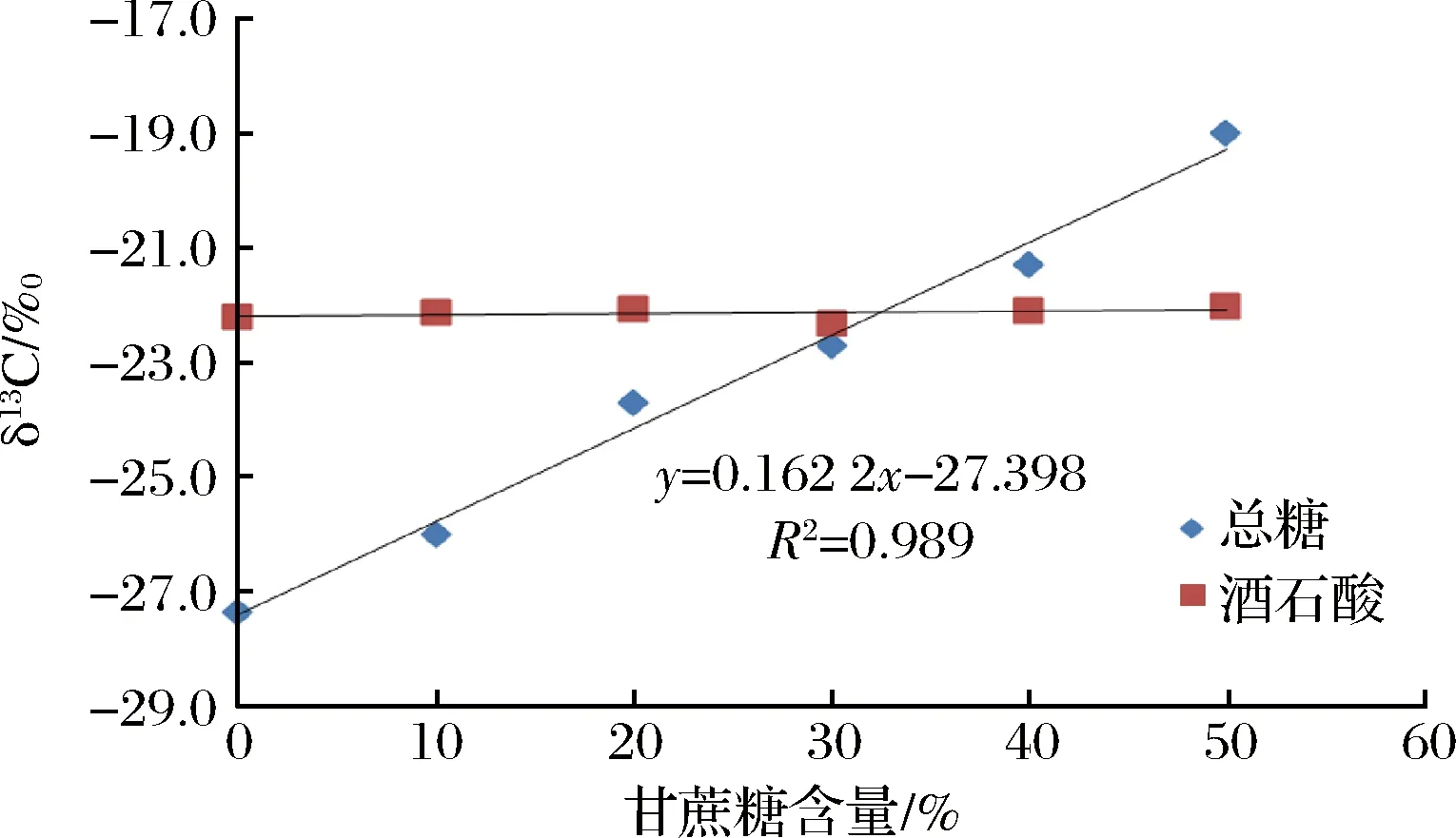
图4 添加不同比例的玉米酒精后葡萄酒中乙醇与酒石酸δ13CVPDB变化Fig.4 Change curve of the δ13CVPDB value of ethanol and tartaric acid with different ratio of exogenous ethanol addition
针对内标物在食品掺假检测中的应用,JAMIN等人应用差值法建立了苹果酸作为糖类内标物的简单模型[16],同时应用比值法建立了橙汁中水和乙醇的数学模型[12],该模型可对橙汁进行鉴别分析。本研究在借鉴JAMIN差值与比值模型的基础上分析了发酵液中乙醇δ13CVPDB与酒石酸δ13CVPDB的差值与比值,乙醇与酒石酸的δ13CVPDB差值范围在-5.20‰±0.39‰之间,比值范围在1.23±0.02之间,差值模型的标准偏差为0.56,比值模型的标准偏差仅为0.02。基于此,建立了差值模型与比值模型用于检测葡萄酒中是否有外源乙醇的添加。
2.4 葡萄酒样品分析
16个葡萄酒样品,其中8个完全无添加,8个添加了外源乙醇。测定样品中酒石酸与乙醇δ13CVPDB(n=3),并分别计算酒石酸与乙醇δ13CVPDB的差值和比值。实验结果见图5与图6。

图5 16个真实样品差值模型分布图Fig.5 The distribution of 16 true samples in difference model
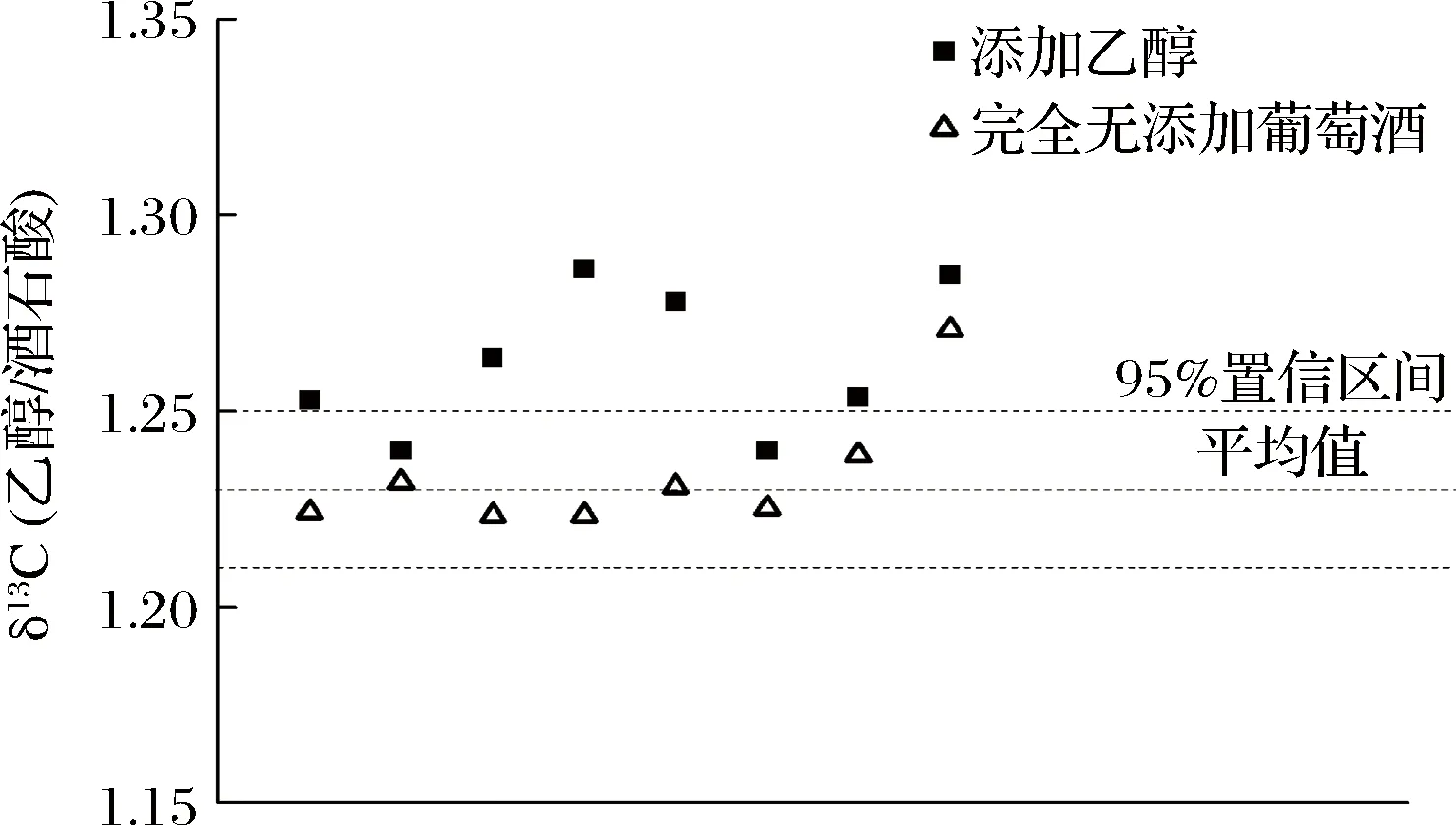
图6 16个真实样品比值模型分布图Fig.6 The distribution of 16 true samples in ratio model
由图5可知,在差值模型中,有7个完全无添加葡萄酒样品的差值处于(-5.20±0.39)‰范围内,有4个添加乙醇的样品处于该范围外,差值模型识别正确率为68.75%。由图6可知,在比值模型中,7个完全无添加葡萄酒样品的比值处于1.23±0.02范围内,有6个添加乙醇的样品处于该范围外,比值模型识别率达到81.25%。由于真实样品数量极为有限,只能初步表明,比值模型与差值模型具有显著性差异(p<0.05),乙醇与酒石酸δ13CVPDB比值模型识别率更高,比值的规律性研究可应用于验证“非添加”葡萄酒中是否有外源添加的乙醇。需要说明的是,若样品满足此模型,不能完全说明该样品一定为“非添加”葡萄酒,可能存在掺入乙醇后其同位素值仍然满足该模型的情况;而不满足该模型的样品,说明其具有掺假行为,具体掺入物质定性与定量分析还需进一步讨论。
2.5 市售葡萄酒的测定结果与分析
收集2个标识为有机葡萄酒的样品(完全无添加)(1#~2#)。测定结果在比值模型中的分布如图7所示。1号样品符合比值模型,认为该样品无外源乙醇掺入;2号样品不符合比值模型,为可疑样品,认为样品生产过程中存在掺入行为。由于本模型未探究外源乙醇掺入量与模型比值的关系,同时考虑到检测的不确定度,因此具体掺入物质的含量无法得出,需要进一步探讨。
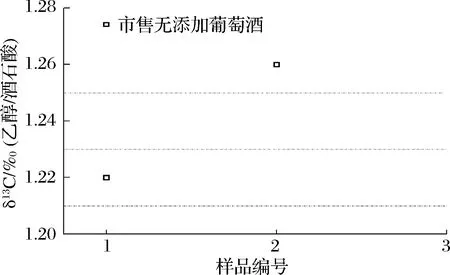
图7 2个葡萄酒样品乙醇与酒石酸δ13CVPDB比值分布Fig.7 The distribution of 2 wines samples in ratio model
3 讨论
本实验探究了葡萄汁中总糖、酒石酸,以及发酵液中乙醇、酒石酸的δ13CVPDB值分布特征,及其之间的相关性规律。葡萄汁中,酒石酸δ13CVPDB比总糖偏正,但与后者呈现良好线性正相关关系(R2=0.94),模拟掺糖试验则验证了此相关性可用于检测葡萄汁中外源添加C4植物糖。在发酵液中,酒石酸δ13CVPDB值不变,乙醇δ13CVPDB值与原料葡萄汁总糖具有明显的正相关性(R2=0.98),既然在葡萄汁中,酒石酸可作为总糖的内标物,则酒石酸与乙醇之间必然存在良好相关性(R2=0.96)。模拟掺乙醇试验验证了此相关性可验证“完全无添加”葡萄酒中是否添加外源乙醇。初步建立了葡萄酒中乙醇与酒石酸的比值模型和差值模型,结果表明比值模型识别率更高。
本试验虽然证明了在无外源糖添加条件下,酒精发酵过程中酒石酸碳同位素特征不变,但是为实现检测葡萄酒在发酵前是否添加外源糖,需要进一步验证酒石酸碳同位素值是否受发酵前添加外源糖的影响,即设计试验添加C4糖后发酵再测定,这也是接下来研究的重点。
需要说明的是本研究仅调查分析了部分产区的葡萄样品及葡萄酒特征,由于植物糖分、有机酸中碳同位素分布受众多因素影响,选择酒石酸δ13CVPDB值作为乙醇内标物建立数学模型还需详尽数据作为应用基础。

