柴达木大肥菇多糖对小鼠的抗疲劳作用
焦迎春,旷慧,吴嘉南,何成日,陈启和
(1.青海大学农牧学院,青海西宁 810016)(2.浙江大学食品科学与营养系,浙江杭州 310058)(3.韩德秀平壤轻工业大学食品科学研究所,朝鲜平壤)
柴 达 木 大 肥 菇 (Agaricus bitorquis(Quél.) Sacc.Chaidam)是青藏高原柴达木盆地特殊生态环境条件下的一种野生大型食用真菌,营腐生[1]。子实体肥大,子实体颜色从白色至暗黄色,平均重400 g~800 g,菌肉肥厚,味道细嫩鲜美[2]。菌肉结构紧密、含水量低、耐储运,很受当地农牧民的喜爱,被广泛采食和销售。研究表明,柴达木大肥菇中必需氨基酸含量丰富,占氨基酸总量的35.84%,粗蛋白、粗脂肪、粗纤维含量分别为24.0%,2.10%和17.32%,同时维生素B2和钾、磷、钙和镁等矿质元素含量较高[3]。
运动性疲劳是一个极其复杂的身体变化综合反应过程,研究证明在长时间高强度运动中,糖原耗尽、血糖浓度降低、乳酸堆积、尿素氮积累、运动过程中离子(如K+、Ca2+、Mg2+)等代谢紊乱、氧自由基的积累等因素都能诱发运动性疲劳的发生[4]。通过有针对性地补充外源性营养补剂或者药物活性成分来延缓或者防止运动疲劳的发生,是解决运动性疲劳的有效途径之一。目前相关研究表明,多糖不仅具有抗氧化、抗肿瘤、抗缺氧和预防心血管疾病等功能[5,6],还具有抗疲劳作用[7]。Du等[8]研究发现,从粒毛盘菌中分离得到的多糖能延长小鼠力竭游泳时间,具有抗疲劳作用;Li等[9]研究发现从玛卡中分离得到的多糖组分MPS-1和MPS-2均能延长小鼠的游泳时间,降低小鼠血清中LA、LDH和BUN水平,提高HG水平,表明该两种多糖具有抗疲劳作用,且其抗疲劳活性呈现剂量效应。Ni等[10]研究表明,西藏地区生长的四种药用植物多糖可以延长小鼠力竭游泳时间,降低血液中葡萄糖水平和超氧化物歧化酶和谷胱甘肽过氧化物酶活性,增加血液中尿素氮、甘油三酯、丙二醛水平和乳酸脱氢酶活性,从而表现出抗疲劳作用。
目前国内外关于柴达木大肥菇的研究较少,且主要集中于柴木大大肥菇子实体的营养成分分析、菌丝体生物学特性等相关的研究,而尚未见关于柴达木大肥菇多糖及其生物功能活性的研究。本研究通过采用热水浸提法提取柴达木大肥菇子实体多糖、发酵液多糖和菌丝体多糖,并研究三种多糖对小鼠力竭游泳时间及力竭游泳结束后小鼠血液中Hb、血清中BUN、LDH和LA含量、肝脏中HG含量变化的差异性,研究柴达木大肥菇多糖的抗疲劳作用,为在青藏高原独特生境下这一野生珍稀食用真菌的进一步开发利用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试验动物
SPF级昆明种小鼠(雌雄各半)购自甘肃中医学院,体重 26~28 g。饲养环境适宜,通风,安静,温度为18~25 ℃,湿度为35%~50%。
1.1.2 试验材料
野生型柴达木大肥菇子实体和斜面菌种均由青海省农林科学院野生所提供。挑选菇型整齐、发育成熟、无病虫害的子实体进行冻干处理,得到的干粉冷藏(4 ℃)备用。
斜面菌种采用PDA斜面在23 ℃下活化15 d,得到的活化菌种4 ℃下保藏备用。
1.1.3 主要试剂
尿素氮(BUN)、氰化高铁血红蛋白(Hb)、乳酸(LA)、乳酸脱氢酶(LDH)、肝糖原(HG)等试剂盒,南京建成生物工程研究所;红景天苷(纯度>99%),国药生物制品检定所;DEAE-52纤维素,北京鼎国昌盛生物技术有限公司;葡聚糖系列标准品(3000、4320、12600、50000和110000 u),北京索莱宝科技有限公司。
1.2 仪器与设备
Agilent 1260 infinity HPLC-GPC 系统,安捷伦科技有限公司;Agilent G1362A示差折光检测器,安捷伦科技有限公司;DHP-9082电热恒温培养箱,上海一恒科学仪器有限公司;Eppendorf Centrifuge 5417R小型台式冷冻型离心机,德国 Eppendorf公司;Freezone 2.5冷冻干燥仪,美国Labconco公司;RV8旋转蒸发仪,德国IKA公司;电子天平,赛多利斯科学仪器有限公司;TU-181紫外可见分光光度计,北京普析通用仪器有限公司;SW-CJ-IQ单人净化工作台,苏州净化设备有限公司。
1.3 方法
1.3.1 多糖标准曲线制作
采用苯酚-硫酸法测定多糖浓度[11]。称取干燥至恒重的标准无水葡萄糖20 mg,加入20 mL蒸馏水,配制成1 mg/mL的葡萄糖溶液。分别吸取0、0.1、0.2、0.3/、0.4、0.5、0.6、0.7、0.8、0.9 和 1 mL 葡萄糖溶液,用蒸馏水定容到1 mL,在1 mL多糖溶液中加入0.5 mL 6%苯酚溶液和 5 mL 浓硫酸,沸水浴中加热15 min后冷却,于490 nm下测定吸光值。以葡萄糖浓度(mg/mL)为横坐标,吸光值为纵坐标,绘制准曲线y=0.0121x+0.0564,R2=0.9988。
1.3.2 多糖提取
1.3.2.1 子实体多糖(PS)
参考文献方法,采用热水浸提法[12]。按料液比=1:20(g/mL)(柴达木大肥菇子实体干粉1 g:蒸馏水20 mL),于 80 ℃下水浴提取 3 h,离心、浓缩,得到子实体多糖提取物。
1.3.2.2 发酵液多糖(PFB)
取1 cm大小的斜面菌种2~3块,接于液体种子培养基中(100 mL/250 mL三角瓶,培养基组成为(g/L):土豆提取物 200 g,葡萄糖 20 g,蛋白胨 5 g),于摇床避光震荡培养(20±2 ℃,130±5 r/min)7~8 d。按照10%的接种量将种子液接种于新鲜液体发酵培养基中(100 mL/250 mL三角瓶,培养基组成(g/L):土豆 200 g,麦芽糖 35 g,CaCl20.1 g,复合维生素 B 1 g,蛋白胨5.5 g),放入摇床避光震荡培养(培养条件同上)[13]。将发酵液混合体系进行过滤,滤液即为发酵液。按料液比=1:5(mL/mL)(柴达木大肥菇发酵液 1 mL:蒸馏水 5 mL),于 80 ℃下水浴提取 3 h 后离心浓缩。
1.3.2.3 菌丝体多糖(PM)
将1.3.2.2中液体培养后的发酵液混合体系进行过滤,得到的固形菌丝体用蒸馏水冲洗3遍,放入干燥箱中进行烘干,用无菌处理后的研钵将菌丝体研碎,称重。按料液比=1:10(g/mL)(柴达木大肥菇菌丝体干粉 1 g:蒸馏水 10 mL),于 80 ℃下水浴提取 3 h 后离心浓缩。
1.3.3 多糖处理
脱色:采用活性炭进行脱色[14]。在100 mL多糖液体中加入6 g活性炭水浴(60 ℃)脱色5 min,边搅拌边脱色。
脱蛋白:Sevage法脱蛋白[15]。V多糖溶液:VSevage试剂=1:2配置成混合溶液经过剧烈振摇 20~30 min脱蛋白,VSevage试剂=V正丁醇:V氯仿=1:5。蛋白质变性后形成凝胶沉淀,通过离心分离后分出水层和溶剂层交界处的变性蛋白质。从得到的粗多糖经过脱蛋白后,计算柴达木大肥菇子实体、发酵液、菌丝体中多糖含量分别为:
15.25±0.13 g/100 g、11.98±0.09 g/100 mL、48.14±0.11 g/100 g。
纯化:分别称取脱蛋白后的子实体、发酵液、菌丝体粗多糖 100 mg溶解于 5 mL去离子水中,用DEAE-52纤维素层析柱层析。用去离子水洗脱,流速0.5 mL/min,分部收集,每管5 mL,苯酚-硫酸法检测各管多糖含量(波长490 nm处吸光度),分别收集不同的组分,合并相同组分,50 ℃减压蒸发浓缩,透析48 h后将透析液真空冷冻干燥,得纯化后的柴达木大肥菇子实体、发酵液、菌丝体多糖冻干后冷藏,备用。
1.3.4 多糖分子量测定
1.3.4.1 色谱条件
色谱条件:Agilent PL aquagel-OH 40(8 μm,300 mm×7.5 mm)凝胶色谱柱;柱温35 ℃;流动相为纯水;流速0.8 mL/min;进样量20 μL。检测器为示差折光检测器(RID)。
1.3.4.2 多糖标准品分子量大小测定
采用高效凝胶渗透色谱法(HPGPC)测定多糖分子量大小。将一系列葡聚糖标准品用流动相溶解,配制质量浓度为1.0 mg/mL的系列标准溶液,摇匀,过0.45 μm水系纳滤膜后按照1.3.4.1中的色谱条件测定系列葡聚糖标品的分子量,以标准品相对分子质量的对数值为纵坐标,以相应色谱峰的保留时间为横坐标进行线性回归,得回归方程y=-0.1732x+7.6534(R2=0.9951),根据回归方程计算多糖相对分子质量。 1.3.4.3 样品分子量测定
分别将柴达木大肥菇子实体、发酵液、菌丝体多糖用流动相配成质量浓度为2 mg/mL的样液,经0.45 μm水系滤膜过滤后按照1.3.4.1中的色谱条件测定多糖的分子量。根据其保留时间和多糖分子量标准曲线,计算柴达木大肥菇子实体、发酵液、菌丝体多糖的分子量大小。
1.3.5 多糖对小鼠的抗疲劳活性
1.3.5.1 动物分组
将 100只小鼠随机分为空白组(Control),红景天苷组(Rhodiola),子实体组(PS),发酵液组(PFB)和菌丝体组(PM),每组20只,雌雄各半。分别将纯化后的子实体多糖、发酵液多糖和菌丝体多糖中3个组分按照自然比例混合,得到纯化后的子实体混合多糖、发酵液混合多糖和菌丝体混合多糖,喂养小鼠。每天在灌胃前两个小时停止喂食,按照100 mg/kg的剂量对5组实验小鼠分别进行灌胃35 d,空白组以同等体积的生理盐水进行灌胃。 1.3.5.2 小鼠的力竭游泳实验
参考West等[17]方法,略有改进。在第35 d灌胃结束后,60 min后称量每只小鼠的体重,在水桶(高30 cm,直径25 cm)内放入一定量的水,水的高度为20 cm,并保持水温在25 ℃,一桶一鼠。当小鼠头部露出水面超过10 s,同时漂浮不动时视为体力耗竭,立即记录小鼠游泳时间。
1.3.5.3 生化指标测定
小鼠游泳实验结束后,立即用乙醚麻醉,采样,测定生化指标。
(1)全血的采集:采用摘眼球法收集全血,按照试剂盒说明书检测Hb含量。
(2)血清的采集:将收集的全血进行低温离心(4 ℃,8000 r/min,10 min),上清液(即为血清)放入-20 ℃冰箱中保存,按照试剂盒说明书检测血清中LD、LDH、BUN含量。
(3)肝脏的收集:待全血取出后,立即将小鼠肝脏取出,用低温生理盐水漂洗3次,滤纸吸干后称量每只小鼠肝脏重量,将小鼠肝脏组织放入-20 ℃冰箱中保存,按照试剂盒说明书检测HG含量。
1.4 数据处理
数据以平均值(x)+标准差(SD)表示,并分别采用SPSS 19.0软件和Origin 8.5软件对数据进行处理分析和作图。
2 结果与讨论
2.1 结果
2.1.1 PS、PFB、PM分子量的测定
由表1可知,从柴达木大肥菇子实体、发酵液和菌丝体中均分离得到3种多糖组分,但3种多糖的分子量大小存在差异。在3种多糖组分中,从子实体多糖分离出来的3个多糖组分分子量均较大,其次是菌丝体多糖,而发酵液多糖组分的分子量相对最小。其中 PS-Ⅰ、PFB-Ⅰ、PM-Ⅰ所占的比例较大,其次为PS-Ⅱ、PFB-Ⅱ、PM-Ⅱ,而 PS-Ⅲ、PFB-Ⅲ、PM-Ⅲ所占的比例最小。

图1 PS(a)、PFB(b)、PM(c)的HPGPC 图谱Fig.1 HPGPC chromatograms of PS (a), PFB (b) and PM (c)

表1 PS、PFB、PM分子量的测定Table 1 Determination of the molecular weights of PS, PFB and PM fractions
2.1.2 PS、PFB、PM 对小鼠力竭游泳时间的影响
运动耐力是抗疲劳活性的一个直接反映指标,小鼠力竭游泳试验被广泛用做检测多糖的抗疲劳活性[18]。由图2可知,与空白对照组和阳性对照组(红景天苷组)相比,子实体多糖组、发酵液多糖组、菌丝体多糖组的小鼠力竭游泳时间均显著延长(p<0.05);3种多糖组中小鼠力竭游泳时间从大到小的排列顺序为:发酵液多糖>菌丝体多糖>菌丝体多糖,且三组之间具有显著差异性(p<0.05)。菌丝体多糖组的小鼠力竭游泳时间最长,为 89.97±4.38 min,分别是空白组和红景天苷组小鼠力竭游泳时间的3.03倍和1.81倍。发酵液多糖组和子实体多糖组小鼠的力竭游泳时间分别是空白组的2.33倍和1.93倍。结果表明,柴达木大肥菇子实体、发酵液和菌丝体多糖可以延长小鼠力竭游泳时间,具有抗疲劳活性,且菌丝体的抗疲劳活性优于发酵液多糖和子实体多糖。

图2 PS、PFB、PM对小鼠游泳时间的影响Fig.2 Effect of PS、PFB、PM on the forced swimming time of mice
2.1.3 PS、PFB、PM对小鼠血液中Hb含量的影响

图3 PS、PFB、PM对小鼠血液中Hb含量的影响Fig.3 Effect of PS, PFB, PM on Hb in blood serum of mice
剧烈运动导致机体对氧气的需求量增加,在运动疲劳中,Hb水平可以作为在机体生理变化的一个重要反映指标[19]。由图3可知,与空白对照组相比,3种多糖组的小鼠血清中Hb含量均有所提高,其中菌丝体多糖组的小鼠血液中Hb含量最高(517.48±101.69 mg/mL),显著大于空白对照(236.72±15.20 mg/mL)和阳性对照组(345.12±15.28 mg/mL)。子实体和发酵液多糖组的小鼠血液中Hb含量无显著差异,分别为(355.32±49.53 mg/mL)和(417.87±53.94 mg/mL)(p>0.05);子实体多糖组的小鼠血液中Hb含量显著高于空白对照组(p<0.05),但发酵液多糖组小鼠血液中Hb含量与空白对照组和阳性对照组均无显著差异(p>0.05)。
2.1.4 PS、PFB、PM对小鼠血清中BUN、LA和LDH含量的影响
2.1.4.1 PS、PFB、PM对小鼠血清中BUN含量的影响
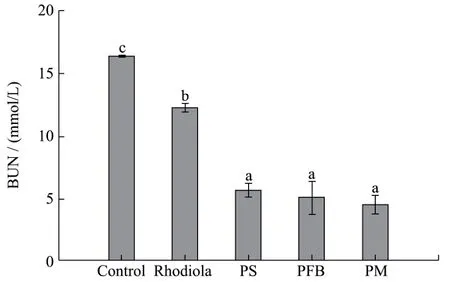
图4 PS、PFB、PM对小鼠血液中BUN含量的影响Fig.4 Effect of PS, PFB, PM on BUN in blood serum of mice
BUN、LA和LDH的变化可以直接反应机体疲劳情况的变化,也可用来评价抗疲劳活性的有效反应指标。在运动耐力过程中,BUN含量显著下降表明机体能有效缓解运动疲劳[20]。由图4可知,与空白对照组相比(16.28±0.04 mmol/L),子实体多糖组、发酵液多糖组、菌丝体多糖组和阳性对照组小鼠血清中 BUN含量均显著下降(p<0.05),且分别下降了 65.78%、69.14%、72.79%和 25.68%。3种多糖组小鼠血清中BUN 含量均无显著差异(p>0.05),但均显著高于与阳性对照组(p<0.05)。
2.1.4.2 PS、PFB、PM对小鼠血清中LA和LDH含量的影响

图5 PS、PFB、PM对小鼠血液中LA和LDH含量的影响Fig.5 Effect of PS, PFB, PM on LA and LDH in blood serum of mice
在高强度的剧烈运动中,血清中LA含量通常会升高,同时乳酸与运动过程中肌肉力量的减弱和肌肉酸痛的产生密切相关[21]。LDH可以催化丙酮酸和乳酸的相互转化,在运动过程中,LDH活性的增加和LA含量的下降有助于缓解运动疲劳,提高运动耐力[21]。由图 5 可知,与空白对照组相比(24.32±2.65 mmol/L),3种多糖组和阳性对照组小鼠血清中LA含量均显著下降(p<0.05),且分别下降了25.21%、34.29%、37.34%和37.95%;虽然3组多糖组与阳性对照组之间均无显著差异(p>0.05),但多糖组小鼠血清中LA含量低于阳性对照组。同时与空白对照组相比,3种多糖组和阳性对照组小鼠血清中 LDH活性均显著升高(p<0.05),且分别升高了 34.47%、38.29%、43.72%和27.03%。虽然3组多糖组与阳性对照组之间均无显著差异(p>0.05),但阳性对照组小鼠血清中LDA含量低于3种多糖实验组,且菌丝体多糖组小鼠血清中LDA 含量最高,为(14.30±0.69 KU/L)。
2.1.5 PS、PFB、PM 对小鼠肝脏中 HG 含量的影响
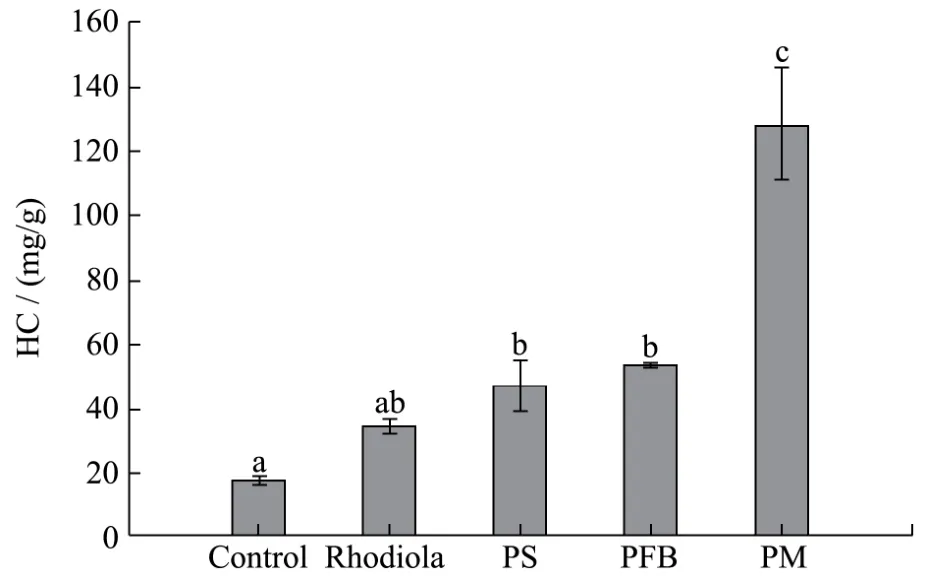
图6 PS、PFB、PM对小鼠肝脏中HG含量的影响Fig.6 Effect of PS, PFB, PM on HG in mice liver
在剧烈运动过程中,除了葡萄糖,HG是主要的能源物质,增加肝糖原储备有利于提高运动耐力和运动能力[22]。由图6可知,与空白对照组相比(17.61±1.29 mg/g),子实体多糖组、发酵液多糖组和菌丝体多糖组的小鼠肝脏中肝糖原的含量显著升高(p<0.05),且菌丝体多糖组的小鼠肝脏中肝糖原含量最高(127.65±18.34 mg/g),显著高于子实体多糖组和发酵液多糖组(分别为 47.14±7.87、53.72±0.18 mg/g)(p<0.05)。子实体多糖组和发酵液多糖组小鼠肝脏中肝糖原含量大于阳性对照组,但无显著差异(p>0.05)。
2.2 讨论
柴达木大肥菇子实体、发酵液和菌丝体多糖的分子量大小不同,它们的抗疲劳活性具有差异性,该差异性可能与多糖的结构、分子量大小相关。Li等[9]研究表明,从玛卡中分离得到的两种多糖(MPS-1和MPS-2)平均分子量分别为 7.6×103u 和 6.7×103u;MPS-1是由木糖、阿拉伯糖、半乳糖和葡萄糖组成,而MPS-2是由阿拉伯糖、半乳糖和葡萄糖构成;在小鼠的被迫游泳实验过程中,分子量较小的 MPS-2比MPS-1抗疲劳活性更强。
研究表明,多糖的抗疲劳作用机理可能与多糖能缓解生物体氧化应激损伤有关,相关研究表明,在抗疲劳实验中,多糖会显著影响 MDA、超氧化物歧化酶(SOD)和谷胱甘肽酶(GSH-Px)水平[23,24]。Wang等[24]研究表明,人参多糖具有抗疲劳作用,可以提高LDH、肌酸磷激酶(CK)、葡葡萄糖和MDA水平,降低血清中TG和GSH-Px水平,其抗疲劳作用机理可能是通过调节抗氧化酶的活性来减慢脂质氧化过程,从而减弱细胞膜的氧化损害。同时他们推测,血清中TG水平的降低和葡萄糖水平的持续升高可能表明运动过程中合成的 TG被机体不断利用来提供能量,导致糖原和葡萄糖积累,从而可以缓解运动疲劳。在剧烈运动过程中,Hb含量的升高可以帮助提高小鼠细胞内氧气运输的能力增强,从而提高细胞的有氧呼吸作用[25]。随着细胞的有氧呼吸作用增强,运动过程中积累的LA被消耗或LA的合成作用减弱,同时伴随着 LDH的活性增强和葡萄糖的积累,该过程有利于缓解运动过程中肌肉疲劳和紧张,从而提高运动耐力[26]。目前对柴达木大肥菇的基础研究比较少,而对柴达木大肥菇活性多糖的生物学功能研究地更少。本研究结果发现柴达木大肥菇多糖具有抗疲劳活性,但是其抗疲劳作用机理还有待深入研究。下一步研究可以从多糖分子结构与抗疲劳活性之间的构效关系、运动过程中脂类代谢、能量代谢、葡萄糖代谢和相关抗氧化酶活性的变化等方面来阐明柴达木大肥菇多糖的抗疲劳作用机理。
3 结论
通过比较柴达木大肥菇子实体多糖、发酵液多糖和菌丝体多糖对小鼠力竭游泳时间及力竭游泳结束后小鼠血液中Hb、血清中BUN、LDH和LA含量、肝脏中HG含量变化的差异性,结果表明柴达木大肥菇子实体多糖、发酵液多糖和菌丝体多糖通过延长小鼠力竭游泳时间、提高小鼠血液中 Hb、HG和血清中LDH含量、降低小鼠血清中BUN和LA含量,从而提高小鼠的运动耐力、缓解运动疲劳。说明该3种多糖具有抗疲劳作用,且菌丝体多糖的抗疲劳效果优于子实体多糖和发酵液多糖,但是柴达木大肥菇多糖的抗疲劳作用机制还需进一步研究。

