3 .0T MR 扩散加权成像中的表观弥散系数在鼻咽癌放化疗疗效的评估价值
张可名,王小红,孙世元,刘淑霞,刘汉菊,李 丽,许 珊,王月琦
(吉化集团公司总医院 医学影像中心,吉林 吉林132022)
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国最常见的头颈部恶性肿瘤之一,癌细胞生长活跃,呈浸润性生长,常发生颈部淋巴结转移,而且鼻咽癌发病部位隐蔽,周围结构复杂,毗邻许多重要器官,手术切除困难。鼻咽癌对放射线敏感,又鉴于特殊的临床生物学行为和复杂的解剖结构,目前鼻咽癌的治疗模式是以放射治疗为主的综合治疗。因此,如何早期预测疗效从而及时调整治疗方案并进行个体化治疗已成为目前临床进行鼻咽癌治疗的研究热点。然而,肿瘤直径体积在治疗的早期并不会发生明显变化,形态影像学已不能准确对肿瘤疗效进行早期的预测评估。扩散加权成像(diffusion weighted imaging,DWI)是磁共振功能成像,具有分子功能影像的特点,是目前唯一能够观察活体水分子微观运动的医学影像学方法,并且能同时提供定量参数表观弥散系数(ADC),ADC值在以往对其他肿瘤的研究中被证实可以用来评估疗效[1,2]。然而目前关于DWI早期评估鼻咽癌放化疗(chemoradiotherapy,CRT)疗效的报道较少。因此,本研究旨在探讨DWI对鼻咽癌放化疗疗效的早期预测价值。
1 材料与方法
1.1 临床资料
搜集我院2014-03-2015-04 53例鼻咽癌患者,其中男38例,女15例,年龄35-78岁,平均55.6±8.2岁。所有病人均有完整的临床及MRI资料,而且均经过鼻咽镜活检病理诊断为鼻咽癌,其中鳞癌,49例,腺癌1例,未分化癌3例,首次MRI扫描前未经任何治疗,全程规范的放射治疗。经我院伦理委员会批准,所有患者自愿参加该研究,均签署知情同意书,患者资料的使用遵循匿名原则。
1.2 设备及扫描参数
美国 GE 公司 Discovery MR750 3.0T 超导磁共振成像仪,8通道头颈联合线圈。受检者头颈部固定,耳塞屏蔽噪音。采用单次激发的平面回波成像SE-EPI 序列。扫描方位:横轴位 。 扫 描 参 数 : TR/TE=6 000 ms/系统默认最小值,矩阵128×128,FOV=22 cm×22 cm,层厚5 mm,层间距0.5 mm。分别在 X、Y、Z 轴 3 个方向上施加扩散敏感梯度。频率编码方向:R/L,b值选用 0、800 s/mm2,NEX=2,自动开启匀场及脂肪抑制。扫描时间:1 min12 s。扫描范围:颞叶中部至胸廓入口水平。对比剂为钆喷酸葡胺注射液(北京北陆药业股份有限公司),0.2 ml/kg,高压注射器肘静脉注射。
1.3 治疗方案、检查时间及分组
治疗方案:48例病人放疗,5例病人放疗同时辅助化疗。(1)放疗:适形调强放射治疗,每次原发灶放射剂量1.8-2.0Gy,每日照射一次,每周5次,总放射剂量70-73Gy,同时对颈部淋巴结引流区域行常规分割式预防性照射,总剂量50Gy。(2)化疗:FLP方案或FP方案(F:5-氟尿嘧啶,L:亚叶酸钙,P:顺铂或奈达铂)。
检查时间:CRT前一周、CRT2周、CRT5周(放射剂量达50Gy)、CRT结束、CRT结束一个月。
分组方案:根据随访结果肿瘤范围按RECIST[3](response evaluation criteria in solid tumors)标准,分为完全有效(CR)组,肿瘤消失,部分有效(PR)组,肿瘤长径缩小>30%,无效(SD)组,肿瘤长径缩小<30%或增大<20%。
1.4 图像分析及数据测量
将原始图像传至 GE ADW4.4 工作站,均由2名10年以上颈部影像诊断经验放射医师进行肿瘤体积大小及ADC值测量,肿瘤边界划线有争议时协商后确定,在增强T1WI上勾画出肿瘤及转移性淋巴结。测定肿瘤体积:由Functool软件自动生成每层的多形性兴趣区(region of interest,ROI)面积,体积(V)=每层ROI面积总和×(层厚+层间距)。肿瘤ADC值亦由Functool软件自动算出,ROI测量时包括层面内所有异常信号区,取平均值得到肿瘤的ADC值。
肿瘤及转移性淋巴结体积降低比例=(前次体积-本次体积)/前次体积
ADC值提高比例=(本次ADC值-前次ADC值)/前次ADC值
1.5 统计学分析
用 SPSS17.0 统计软件对数据进行分析,在数据经分析符合正态分布及方差齐性后采用单因素方差分析及SNK法两两比较以下几组数值有无统计学差异,P<0.05有统计学意义。(1) CRT前一周CR、PR及SD组的肿瘤及转移性淋巴结体积。(2) CRT2周、CRT5周CR、PR及SD组的肿瘤及转移性淋巴结降低比例。(3) CRT前一周、CRT2周、CRT5周、CRT结束CR、PR及SD组的ADC值。(4) CRT2周、CRT5周CR、PR及SD组的ADC值提高比例。
2 结果
见表1。
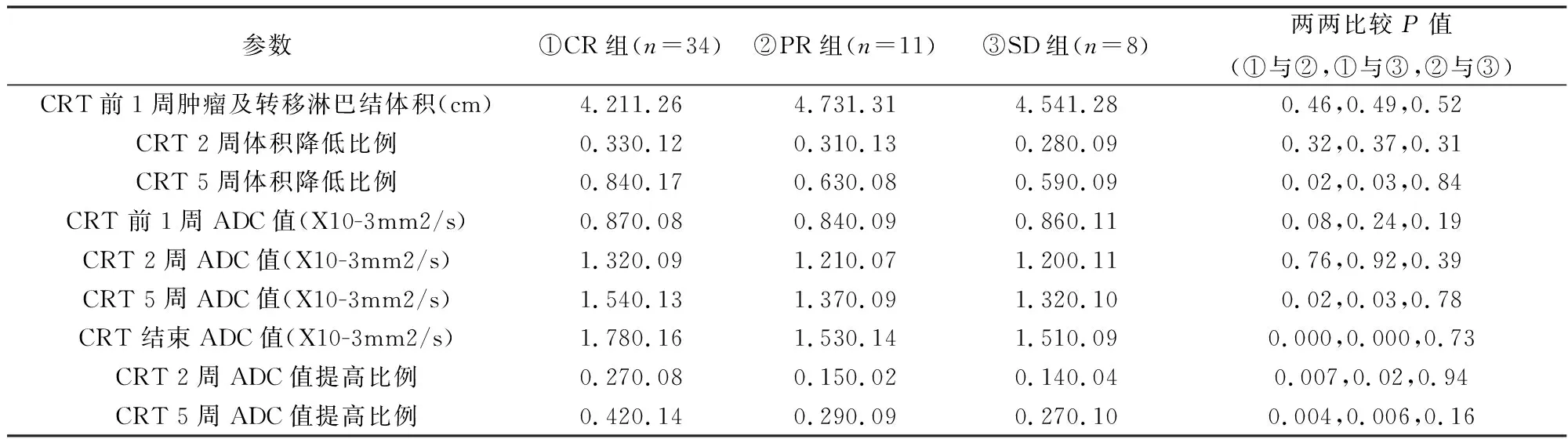
表1 各肿瘤组CRT前一周、CRT2周、CRT5周、CRT结相关数据
3 讨论
DWI能从分子水平反映人体水分子的功能变化,可以检测出与组织含水量改变有关的形态学和病理生理学的早期改变,是目前唯一能观察活体水分子微观运动的影像学方法。既往多数动物模型及临床实验研究证实DWI技术在评估和预测肿瘤治疗疗效方面具有重要价值[1,3-6]。早期DWI序列因扫描时间长对运动伪影非常敏感,随着3.0T高场强磁共振的应用,尤其是单次激发平面回波成像EPI及多线圈并行采集技术的应用,明显缩短了扫描时间,采集时间可缩短至50 ms以下,呼吸、心跳、血流和胃肠道蠕动等生理活动均可被冻结,对图像质量的影响降至最低,使体部DWI的应用成为可能。目前DWI对鼻咽癌的研究主要集中在肿瘤的检出、分期及良恶性肿瘤鉴别诊断方面,而对鼻咽癌放化疗疗效研究较少。笔者将鼻咽癌治疗前、治疗早期、治疗中期及治疗结束后MRI病灶大小及ADC值动态观察,旨在更全面详细评估ADC值对鼻咽癌放化疗疗效的预测及检测价值,为临床个体化治疗方案制定提供客观依据。
3.1 治疗前
本研究结果显示治疗前CR、PR及SD各肿瘤组肿瘤及转移淋巴结体积、ADC值间差异均无统计学意义,由此笔者推论鼻咽癌病人的最终疗效与治疗前肿瘤及转移淋巴结体积、ADC值均无明显相关性。
3.2 治疗早期
放化疗2周时,CR、PR及SD各肿瘤组在治疗早期肿瘤及转移淋巴结体积降低比例之间及ADC值之间无明显差异,而CR组的ADC值提高比例均高于PR组与SD组。各肿瘤组治疗早期的ADC值提高比例与肿瘤及转移淋巴结体积降低比例之间均无统计学意义,这说明肿瘤在治疗早期的ADC值改变早于组织的宏观形态学变化,ADC值可体现组织的微观生理学变化,因此根据肿瘤在治疗早期的ADC值变化能较准确地预测疗效。
既往研究[7,8]显示,恶性肿瘤细胞扩增迅速,细胞密度增高,细胞外容积减小,同时,细胞膜的限制以及大分子物质如蛋白质对水分子的吸附作用的增强,这些因素都限制了肿瘤内水分子的有效运动,限制了扩散,使得ADC值降低。放射线及化疗药物可导致肿瘤细胞膜的破坏,细胞质游离钙及活性氧类物质增多,引起肿瘤细胞损伤及凋亡,肿瘤细胞密度减低,细胞周围间隙增宽,水分子扩散能力增强,ADC值升高[5]。陈等[9]通过观察NPC转移性淋巴结早期的放疗反应,发现在肿瘤放疗 1周后对放疗有反应的病灶 ADC值升高,而无反应的病灶ADC值降低或无变化。因此,ADC值能在肿瘤体积变化之前观察肿瘤细胞的微观变化,并可进行定量分析,早期预测肿瘤治疗的疗效。
3.3 治疗中期
放化疗5周时CR、PR及SD各肿瘤组在肿瘤及转移淋巴结体积降低比例、ADC值、ADC值提高比例间差异均有统计学意义,以ADC值提高比例预测NPC疗效敏感度最高,可达94.7%,特异度91.3%,这说明放化疗5周时肿瘤及转移淋巴结体积降低比例、ADC值虽可反映NPC对治疗的敏感性,但ADC值提高比例仍是预测NPC疗效敏感性较好的指标。这与Pan等[10]通过ADC值预测异种移植鼻咽癌小鼠放射敏感性动物模型研究的结论相似,研究发现放疗后体积变化与ADC之具有相关性,ADC值变化率是预测NPC放射敏感性的较好指标。
3.4 治疗结束后
CRT结束后CR组的ADC值明显高于PR及SD组,而PR组ADC值仅略高于SD组,且此差异并无统计学意义,说明在治疗结束后即可根据ADC值有效判断有无肿瘤残余。
3.5 研究局限性
考虑到数据量较大及扫描时间等因素,多b值DWI未纳入本研究,今后将加大样本量,针对不同病理类型,采用多b值联合DWI,分项研究ADC值对预测NPC疗效的临床价值。
综上所述,通过笔者对扩散加权成像中的表观弥散系数ADC值在鼻咽癌治疗中动态观测,认为肿瘤水分子微观变化较形态学变化能更早发生,从而ADC值能在早期预测鼻咽癌放化疗疗效。随着磁共振技术的日益发展,扩散加权成像必将有更广泛的发展空间和临床应用前景。这将有助于我们寻找更简便、准确、无创的鼻咽癌治疗敏感性的预测方法,对实施鼻咽癌个体化治疗、提高鼻咽癌的疗效具有重要的意义。

