HMGB1移位和释放与肝脏缺血再灌注损伤的机制
刘树雄,何 建
(上海东方肝胆外科医院 急诊科,上海200438)
造成肝脏缺血再灌注损伤后组织出现不可逆性的病理损伤的主要因素即炎症因子的联式的反应与瀑布样富集[1-3]。高迁移率族蛋白1(HMGB-1)属于晚期炎症因子,HMGB-1的表达在急性重型肝炎等多种肝脏疾病患者体内异常升高,且HMGB-1的表达还关联到患者预后。采用人工输注的方式抑制肝部疾病患者血清的HMGB-1表达,可有效降低肝细胞的凋亡率[4-7]。本研究即探究大鼠发生肝脏缺血再灌注损伤后肝组织中HMGB-1的表达,并分析其机制。
1 材料与方法
1.1 实验动物
本研究选取45只1月龄的雄性SD大鼠。购自武汉大学实验动物中心。
1.2 肝脏缺血再灌注模型的建立及分组
采用随机数字法,将45例受试大鼠随机分为三组,每组15只大鼠。术前12 h、术前1 h向HMGB1干预组受试大鼠腹腔输注兔抗小鼠HMGBI抗体,分别与术前12 h、术前1 h向缺血再灌注组受试大鼠腹腔输注生理盐水,假手术组大鼠不采取任何预处理措施。缺血再灌注组及HMGB1干预组大鼠麻醉后,取仰位进行固定,打开腹腔,夹闭其肝门静脉以及肝动脉,1 h后恢复血流再灌注以制造肝脏缺血再灌注大鼠模型。假手术组大鼠打开腹腔后不夹闭肝门静脉及肝动脉。
1.3 方法
1.3.1血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)含量 恒温条件下应用小鼠约70%的肝缺血再灌注模型,缺血再灌注后6 h断尾取血,将血液样本置于离心机内以4 000 rpm的转速离心10 min,分离血清后保存于-80℃冰箱中待测;用自动生化分析仪(BS-300型,迈瑞全)检测大鼠血清ALT、AST含量。
1.3.2肝组织中细胞凋亡指数 肝细胞凋亡指数采用Annexin V-FITC/EGFP 细胞凋亡测试剂盒(上海翊圣公司)进行测定,采用PBS洗涤正常培养以及诱导凋亡的悬浮细胞2次,加入100 μl Binding Buffer以及10 μl FITC标记的Annexin-V(浓度20μg/mL),室温避光条件下静置30 min后加入5 μl PI(浓度50 μg/mL),避光条件下反应5 min后加入Binding Buffer 400 μl,采用FAC Scan流式细胞术测定,阴性对照不加Annexin VFITC和PI。
1.3.3肝组织中MPO含量 取大鼠肝组织,采用滤纸将肝组织表面血渗液吸干后将其置于-80℃冰箱中冷冻;取出冷冻的肝组织,将其置于预冷的生理盐水中进行漂洗,随后采用滤纸吸干水分,向适量肝组织中加入试剂二混匀,混匀后将0.1 ml试剂三加入0.9 ml组织匀浆中再次混匀,置于37℃水浴中15 min;向匀浆中依次加入试剂四以及显色剂,置于37℃水浴中30 min;向匀浆中加入试剂七,充分混匀后,置于60℃水浴中10 min;取出,在460 nm波长条件下测定OD值。MPO(U/g)计算公式=(测定管OD值-对照管OD值)/×11.3肝组织量(g)。ELISA试剂盒购自上海广锐公司。
1.3.4肝组织中HMGB1 mRNA及蛋白表达测定 HMGB-1mRNA表达采用RT-PCR测定,逆转录试剂盒购自Takara公司,10 μl反应体系的反应条件如下:94℃预变性3 min、94℃变性3 s、55℃退火30 s、72℃延伸60 s,循环共计30次。mRNA相对表达量采用紫外分光光度计测定的HMGB-1mRNA吸光度值表示。HMGB1蛋白表达采用ELISA试剂盒检测:将HMGB-1单抗包被于酶标板,加入试剂盒内抗HMGB-1抗体以及亲和素,加显色底物和终止液,用酶标仪测定450 nm波长下吸光度值,HMGB-1蛋白通过绘制标准曲线计算。
1.3.5ELISA法测定肝组织中炎性因子及氧化应激水平 炎性因子包括肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)。氧化应激指标包括超氧化物歧化酶(SOD)、丙二醛(MDA),ELISA试剂盒购自上海凯博生化试剂有限公司。
1.4 统计学处理
采用SPSS20.0统计软件(美国IBM公司);计量资料采用“均数±标准差”表示,组间比较用单因素方差分析,两两比较采用LSD-t检验;计数资料采用百分率(%)表示,比较采用χ2分析;P<0.05代表差异有统计意义。
2 结果
2.1 肝功能指标
缺血再灌注组ALT、AST水平明显高于假手术组(P<0.05);HMGB1干预组ALT、AST水平高于假手术组(P<0.05),见表1。
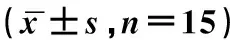
表1 三组受试大鼠肝功能指标比较
2.2 三组受试大鼠肝组织细胞凋亡指数比较
缺血再灌注组肝组织细胞凋亡指数高于假手术组(P<0.05);HMGB1干预组高于假手术组(P<0.05),见表2。
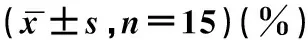
表2 三组受试大鼠肝组织细胞凋亡指数比较
2.3 肝组织中MPO含量
缺血再灌注组肝组织中MPO含量高于假手术组(P<0.05);HMGB1干预组肝组织MPO含量高于假手术组(P<0.05),见表3。
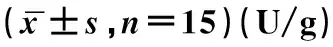
表3 三组受试大鼠肝组织中MPO含量比较
2.4 三组受试大鼠肝组织中HMGB1mRNA及蛋白表达比较
缺血再灌注组肝组织HMGB1 mRNA及蛋白表达高于假手术组(P<0.05);HMGB1干预组肝组织HMGB1 mRNA及蛋白低于缺血再灌注组,但高于假手术组(P<0.05),见表4。
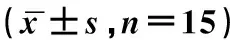
表4 肝组织中HMGB1 mRNA及蛋白表达
2.5 肝组织中炎性因子表达
缺血再灌注组炎性因子高于假手术组,HMGB1干预组低于缺血再灌注组、高于假手术组(P<0.05),见表5。
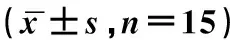
表5 肝组织中炎性因子表达
2.6 氧化应激水平
大鼠氧化应激水平检测结果显示,缺血再灌注组受试大鼠SOD明显低于假手术组,HMGB1干预组明显高于缺血再灌注组、低于假手术组,三组间差异具有统计学意义(P<0.05);缺血再灌注组受试大鼠MDA明显高于假手术组,HMGB1干预组明显低于缺血再灌注组、高于假手术组,三组间差异具有统计学意义(P<0.05);见表6。
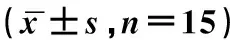
表6 氧化应激水平比较
3 讨论
肝缺血再灌注损伤属于病理生理学事件之一,对患者的肝脏功能造成严重影响。目前关于肝缺血再灌注损伤的机制尚未完全明确,因此在其预防以及治疗方面均无效果显著的方法。HMGB1属于HMG蛋白超家族成员之一,是普遍存在的一种DNA结合蛋白[8]。当机体受到刺激时,免疫或非免疫细胞会向胞外环境释放HMGB1,多种炎症及免疫性疾病的发病机制可能与这一过程相关。已有学者提出,HMGB1的移位与释放与肝脏缺血再灌注损伤的进展相关,HMGB1可能是该损伤机制中的一种重要的调控因子[9-11]。本研究中,缺血再灌注组受试大鼠肝组织中HMGB1水平以及细胞凋亡指数均明显高于假手术组,而术前输注抗HMGB1抗体的干预组受试大鼠肝组织中HMGB1水平以及细胞凋亡指数则明显低于缺血再灌注组,但仍高于假手术组,提示在大鼠肝脏缺血再灌注损伤后,肝组织中HMGB1含量明显上升、细胞凋亡率增加,而建模前腹腔输注抗HMGB1抗体则可以有效环缓解这一现象,由此可以推断在肝脏缺血再灌注损伤及修复过程中HMGB1扮演重要角色[12,13]。
本研究采用ELISA法检测大鼠肝组织中TNF-α、IL-6炎性因子表达发现,缺血再灌注组受试大鼠明显高于假手术组,HMGB1干预组则明显低于缺血再灌注组、但仍高于假手术组,提示抗HMGB1抗体改善大鼠肝脏缺血后再灌注损伤可能是通过下调TNF-α及IL-6水平实现。SOD是机体清除氧自由基的主要成分之一, MDA是一种体内氧化应激的终末产物,本文研究发现,缺血再灌注组受试大鼠SOD水平明显低于假手术组、MDA水平明显高于假手术组,而采用抗HMGB1抗体干预后,大鼠SOD水平明显升高、MDA水平明显降低,提示HMGB1干预降低了肝脏缺血再灌注损伤大鼠的氧化应激程度减轻,其与HMGB1介导的中性粒细胞积聚以及促炎因子趋化相关。
综上所述,大鼠肝脏缺血再灌注损伤后,HMGBI表达显著上升,输注HMGBI抗体可有效改善大鼠肝脏缺血再灌注损伤,其机制可能与下调炎性因子表达、降低炎症引起的细胞凋亡相关。

