非洲猪瘟病毒p30-54融合蛋白基因的构建、表达及其多克隆抗体制备
李 杰,张星星,郭 晶,孟庆玲,乔 军*,张国武,王晓婷,李 妍,才学鹏
(1.石河子大学 动物科技学院,新疆 石河子 832003; 2.新疆农垦科学院 省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子 832000; 3.中国农业科学院 兰州兽医研究所,甘肃 兰州 730046)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起猪的一种急性、热性、高度接触性传染病[1-3],以高热、食欲废绝、皮肤和内脏器官出血为临床特征,病死率高[4]。该病被世界动物卫生组织(OIE)定为法定报告动物疫病[5]。ASF最初主要在非洲流行,随后在意大利撒丁岛、西班牙、葡萄牙、加勒比地区、巴西以及东欧等国家或地区被发现[6]。2017 年,俄罗斯远东地区发生ASF疫情,导致该病传入我国的风险不断增加。因此,我国急需提高对该病的检疫和监测能力。
目前,血清学检测是诊断和监测猪群ASFV感染的重要方法之一[7]。然而,现有的ASFV血清学检测方法中,所使用的ASFV诊断抗原或为细胞培养的全病毒抗原,或为ASFV单一的重组蛋白。细胞培养的全病毒抗原虽然敏感性较高,但需要培养活病毒,存在生物安全方面的问题[8];单一重组蛋白抗原虽具有较高的特异性,但敏感性不高,检出率较低。因此,制备特异性强和敏感性高的ASFV诊断用抗原是研发高效血清学诊断方法的关键。有研究表明,p30和p54蛋白均可诱导特异性免疫反应,其中p30具有最佳的诊断抗原性能[7]。鉴于此,本研究将ASFVp30和p54基因进行融合,构建了p30-54融合基因,并在大肠杆菌表达系统中进行表达,分析了融合蛋白的反应原性,制备了抗ASFV p30-54融合蛋白多克隆抗体,以期为ASFV诊断用抗原的研发奠定基础。
1 材料和方法
1.1 载体、菌株及试剂
pET-28a(+)、pMD18-T载体、E.coliDH5α和E.coliBL21(DE3)由石河子大学动物科技学院寄生虫实验室保存。IPTG、X-gal、DNA Marker、核酸限制性内切酶(EcoRⅠ、XhoⅠ)、T4 DNA Ligase和标准蛋白质Marker均购自TaKaRa公司。ASFV阳性血清由中国农业科学院兰州兽医研究所惠赠。辣根过氧化物酶标记兔抗猪IgG购自北京博奥森生物技术有限公司。商品化ASFV抗体检测ELISA试剂盒(西班牙INGENASA公司生产)购自广州测迪生物科技有限公司。
1.2 ASFV p30和p54基因的体外合成
根据GenBank中登录的ASFVp30和p54基因序列,运用在线软件Racc(http://nihserver.mbi.ucla.edu/RACC)对上述基因序列中大肠杆菌稀有密码子预测分析,将其稀有密码子优化为大肠杆菌偏爱密码子,由华大基因有限公司进行体外合成。
1.3 ASFV pT-p30-54重组质粒的构建
通过重叠延伸PCR技术(SOE-PCR)进行p30-54融合基因的构建。根据p30和p54基因序列,设计PCR引物。Fp30:5′-GGAATTCATGGATTTTATTTTAAATATATCC-3′(下划线部分为EcoRⅠ酶切位点);Rp30:5′-GTTTAATGACCATGAGTCTTA-3′。Fp54:5′-GAGCACATAACTTTATTCAAACCA-3′;Rp54:5′-CCTCGAGTTACAAGGAGTTTTCCAGGTC-3′(下划线部分为XhoⅠ酶切位点)。用Fp30-Rp30扩增p30基因片段、Fp54-Rp54扩增p54基因片段,分别回收PCR产物。SOE-PCR采用20 μL反应体系:Fp30、Rp54引物各0.5 μL,10×Pfu Buffer 2 μL,PCR产物各2 μL,2.5 mmol/L dNTPs 1.6 μL,Pfu DNA聚合酶0.2 μL,加水至20 μL。SOE-PCR反应条件:95 ℃ 4 min;95 ℃ 50 s,60 ℃ 40 s,72 ℃ 60 s,20个循环;72 ℃ 10 min。SOE-PCR产物经1.5%琼脂糖凝胶电泳并回收后,克隆入pMD18-T载体中,构建重组质粒pT-p30-54,进行测序。
1.4 重组表达载体pET-p30-54的构建与鉴定
用EcoRⅠ和XhoⅠ分别对pT-p30-54和pET28a(+)质粒双酶切,用DNA凝胶回收试剂盒回收p30-54目的基因和载体片段,用T4 DNA 连接酶4 ℃过夜连接,然后转化入E.coliDH5α感受态细胞中,在含氨苄青霉素抗性的固体培养基中37 ℃过夜培养,挑取单菌落,再经PCR和双酶切鉴定的方法筛选获得阳性克隆pET-p30-54。
1.5 ASFV p30-54融合蛋白的诱导表达
将鉴定正确的重组载体pET-p30-54转化至E.coliBL21 (DE3)感受态细胞中,次日挑取单个菌落接种于LB液体培养基37 ℃过夜培养,次日取200 μL菌液接种于20 mL含氨苄青霉素抗性的液体LB培养基中,加入1.0 mmol/L IPTG诱导6 h,收集菌液。
1.6 ASFV p30-54融合蛋白的SDS-PAGE检测和 Western blot 分析
将收集的菌液12 000 r/min离心1 min,收集菌体,进行SDS-PAGE电泳分析。以ASFV阳性血清为一抗、辣根过氧化物酶标记的兔抗猪IgG为二抗,对重组融合蛋白进行Western blot 分析。
1.7 多克隆抗体制备、纯化和特异性检测
将 IPTG诱导后的菌液用超声破碎,按照Ni亲和层析柱的操作步骤进行p30-54融合蛋白的纯化。将12只健康的昆明系小鼠分成试验组和对照组,每组6只;将纯化后的p30-54融合蛋白溶液终质量浓度调整为1 mg/mL,与弗氏完全佐剂按体积比1∶1混合,制备免疫原;同时将0.01 mol/L、pH值为7.2的PBS缓冲液与弗氏完全佐剂按体积比1∶1混合作为对照;然后通过皮下多点注射分别注射试验组和对照组小鼠,进行首次免疫,免疫剂量为200 μL;在首免10 d后进行第2次免疫,二免2周后采血,分离血清,利用商品化的ASFV ELISA抗体检测试剂盒进行抗体检测。
2 结果与分析
2.1 重组质粒pT-p30-54的构建与鉴定
pT-p30-54经PCR扩增可得到与预期大小相符的1 140 bp目的基因片段(图1)。经双酶切(EcoRⅠ和XhoⅠ)可得到1 140 bp的目的基因片段和2 692 bp的载体片段(图2)。测序结果显示,构建的重组质粒含有ASFV完整的p30-54基因序列(图3),表明成功构建了重组质粒pT-p30-54。
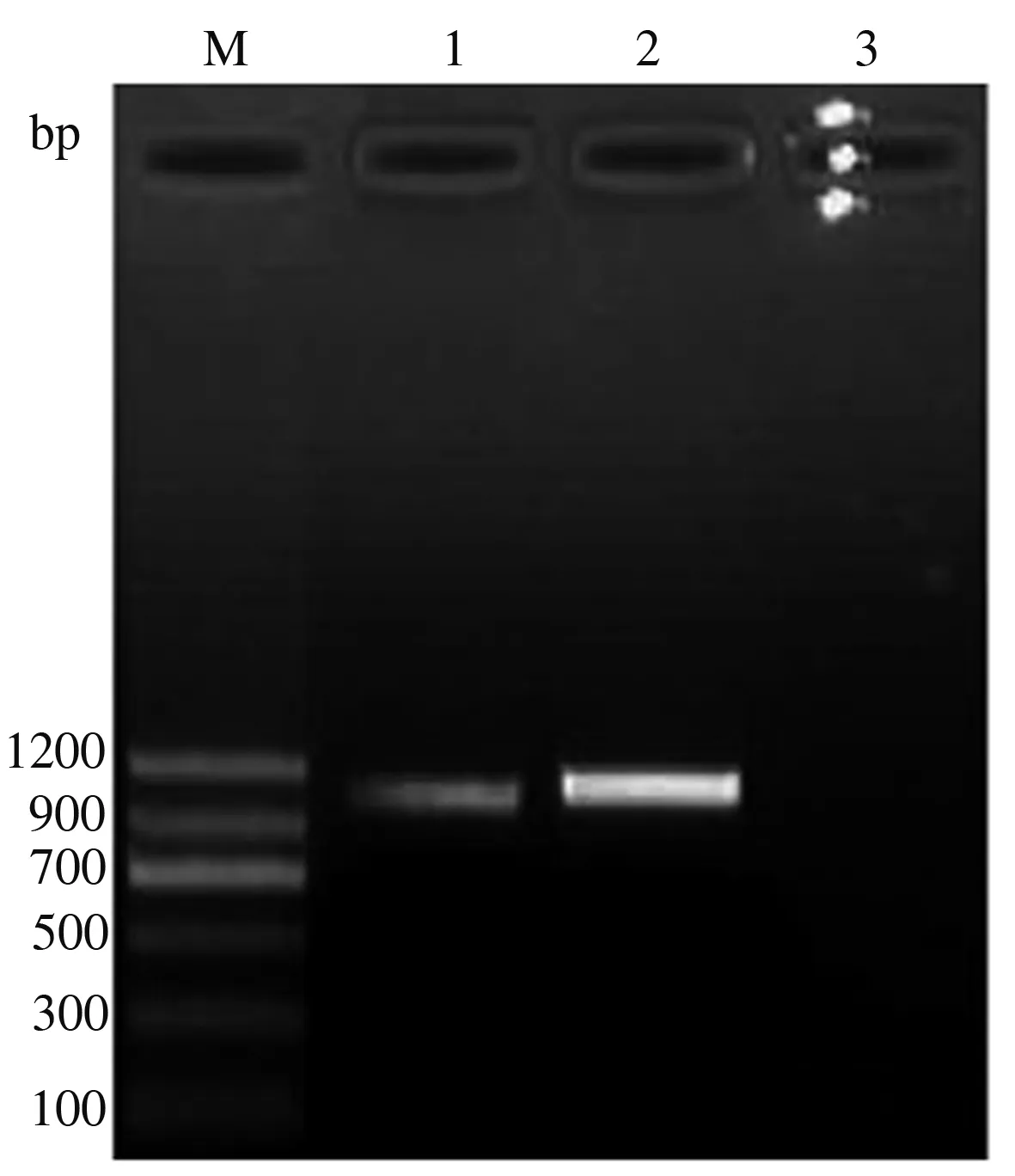
M.DNA Marker ;1—2.重组质粒pT-p30-54;3.阴性对照

M.DNA Marker;1.pT-p30-54双酶切;2.pT-p30-54单酶切

第1行为p30-54融合基因核苷酸序列:1—582位核苷酸为p30基因序列,583—1 140位核苷酸为p54基因序列;第2行为p30-54融合基因编码的氨基酸序列
2.2 重组表达载体pET-p30-54的构建与鉴定
重组质粒利用特异性引物成功扩增出大小为1 140 bp的p30-54融合基因片段(图4)。用EcoRⅠ和XhoⅠ酶切后得到1 140 bp的目的片段和5 369 bp的pET-28a(+)载体片段(图5)。表明成功构建了重组表达载体pET-p30-54。
2.3 ASFV p30-54融合蛋白的SDS-PAGE检测及Western blot分析结果
SDS-PAGE检测结果表明,ASFV融合蛋白p30-54在47.1 ku处有明显条带,与理论完全相符(图6)。Western blot分析发现,表达的p30-54融合蛋白可与ASFV阳性血清发生免疫学反应,提示融合蛋白p30-54具有反应原性。

M.DNA Marker;1—3.pET-p30-54阳性克隆PCR扩增结果;4.阴性对照

M.DNA Marker;1.pET-p30-54;2.pET-p30-54双酶切;3.pET-p30-54 单酶切

M.蛋白质分子质量标准;1—3.pET-28a(+)空载体转化菌株的诱导;6—8.pET-p30-54转化菌株诱导的表达产物;9.Western blot分析
2.4 ASFV p30-54融合蛋白多克隆抗体的制备及特异性检测结果
利用ASFV ELISA抗体检测试剂盒对免疫小鼠的血清进行检测,结果显示,ASFV p30-54融合蛋白免疫的小鼠血清均呈阳性,而对照组小鼠血清均呈阴性,表明成功制备了小鼠抗ASFV p30-54融合蛋白抗体。
3 结论与讨论
ASFV是目前已知的唯一DNA虫媒病毒,基因组为线性双链DNA,长度在170~190 kb[4-5],编码150~200个病毒蛋白,其中p30、p54、p72等结构蛋白是该病毒与宿主细胞相互作用的主要蛋白[6,9-10],不但在病毒黏附和侵入过程中发挥着重要的作用[9],而且可诱导机体产生免疫应答[11]。Lacasta等[12]构建了ASFV基因组表达文库,结果发现,含有ASFVp54、p30、p72和可溶性血凝蛋白(sHA)编码基因的文库可诱导机体产生较强的细胞免疫和体液免疫,表明p30、p54、p72等结构蛋白具有较强的免疫原性和反应原性。
目前,酶联免疫吸附试验(ELISA)是ASFV血清学检测最常用的方法[13-15],国外已经研发出商品化的试剂盒。西班牙研制的ASFV ELISA抗体检测试剂盒通过阻断酶标记免疫吸附测定法,将ASFV抗原预包被于聚苯乙烯微孔板上,加入待检样品后,样品中抗体将与其抗原结合,洗涤后加入酶标记抗体和底物显色,从而检测样品中ASFV抗体水平。然而,进口的ELISA检测试剂盒价格昂贵,限制了其广泛使用,而国内ASFV检测试剂盒尚处于研发中。董志珍等[16]以原核表达的ASFV p30重组蛋白包被反应板,样本或标准品中的ASFV抗体能与酶标板中包被的p30抗原反应,同时加入针对p30的酶标单克隆抗体后参与抗原表位的竞争,建立了一种检测ASFV抗体的竞争ELISA试剂盒。Sastre等[17]建立了基于ASFV p72单抗的免疫层析法(LFA),用于ASFV抗原的检测。结果表明,建立的LFA方法与商品化的ELISA之间存在很好的相关性,虽然其敏感性略低于PCR方法(PCR检测阳性率为38%,LFA为27%),但明显高于ELISA检测试剂盒。该方法适用于野外测试野生动物,并可用于设备简陋的实验室。Kazakova等[8]利用原核表达系统表达了p30蛋白,通过免疫印迹试验评估了p30 重组蛋白对ASFV抗体的检测能力,对试验性和自然感染ASFV的家猪和野猪血清样品进行了检测,其特异性和敏感性可达98.75%和100%,并且感染6~8周后血清样品即可检测出特异性的ASFV抗体。
近年来,中国养猪业正面临着ASF传入的严峻威胁,尤其是新疆北部,新疆边境线长达5 600 km,虽然与俄罗斯接壤地区目前尚未发生ASF疫情,但随着ASF疫情的不断扩散,新疆具有极大的传入风险,可能成为该病传入我国的一个重要窗口。为此,我国农业农村部发布了《非洲猪瘟疫情应急预案》,严防该病从境外传入我国。因此,研发ASFV特异、敏感的检测试剂对于防范ASF传入我国具有十分重要的现实意义。本研究表达了ASFV p30-54融合蛋白,并成功制备了抗该融合蛋白的多克隆抗体,为研发ASFV诊断试剂奠定了基础。
——一道江苏高考题的奥秘解读和拓展

