干预自主神经系统治疗心房颤动的进展
周贤惠, 项 冉
(新疆医科大学第一附属医院心脏起搏与心电生理科, 乌鲁木齐 830054)
心房颤动(atrial fibrillation,AF)是最常见的快速性心律失常之一。按照2016 ESC/EACTS房颤管理指南,在2010年,估计世界范围内AF的男性和女性分别为2 090万和1 260万人,在发达国家中发病率和患病率更高[1-2]。到2030年,预期在欧洲有1 400万~1 700万名AF患者,每年新诊断12万~21.5万名AF患者[2-4]。AF随着年龄增加发病率逐渐增高,随着老龄化时代的来临,AF的发病率和危害也日益加重。目前治疗AF的主要方式为手术消融和药物治疗,王会永等[5]将402例AF患者分为消融组和抗心律失常药物组,进行随访得出结论:消融组治疗有效率为83.2%,药物组治疗有效率为50.2%,虽然消融组有效率高于药物组,但仍有较高的复发率,如何更加有效的治疗AF,增加成功率降低复发率也越来越引起临床医师的重视。AF的发生机制复杂,研究发现AF的发生与遗传因素、心脏自主神经系统(cardiac autonomic nervous system,CANS)的激活和肾素-血管紧张素-醛固酮系统的激活等有关。而越来越多的证据显示自主神经系统(autonomic nervous system,ANS)活动在AF的发生和维持中都起着重要作用,通过干预ANS(包括神经丛消融、肾去神经化治疗、经皮神经刺激、运动训练等)可能提高AF治疗的成功率并降低AF复发率。本文拟对CANS及解剖、引起AF的机制及干预自主神经治疗AF的进展进行综述。
1 与CANS相关的解剖
交感神经纤维主要来源于沿颈部和胸部脊髓的主要自主神经节。这些自主神经节包括颈上神经节(与C1~3相通)、星状(颈胸)神经节(与C7~8至T1~2连通)和胸神经节(低至第七胸神经节)。星状神经节是心脏交感神经支配的主要来源,星状神经节与多个胸内神经和结构以及皮肤相连(图1)。这些神经节容纳大多数节后交感神经元的细胞体,其神经轴突形成上、中、下心脏神经并终止于心脏表面。心脏神经丛(ganglionated plexi,GP)集中在心外膜神经丛以及相互连接的神经节和轴突中。迷走神经支配主要起源于延髓的迷走神经核,自颈部向下通向窦房结和房室结及第三神经丛[6]。在心房中,GP集中在房室壁上的不同位置。右心房GP主要支配窦房结,下腔静脉-心房下GP支配主要支配房室结,肺静脉-左心房交界处GP含有密集的肾上腺素能和胆碱能神经纤维。心室GP主要位于左冠状动脉和右冠状动脉、后降动脉、左钝冠状动脉的起源,包绕主动脉根部[6]。GP是CANS的协调中枢,ANS的平衡对维持正常心脏电生理起着重要作用,当这种平衡被打破时,就会产生异常电活动,导致心律失常的发生。已经有许多研究者通过基础或者临床试验证明,干预自主神经系统治疗AF是可行的[7-12]。例如,低强度迷走神经刺激对多种因素导致的AF具有一定的抑制作用[7];低水平耳屏刺激可以逆转起搏诱发的心房重构并抑制AF的发生[8],使用内关穴针灸可预防电复律持续性AF患者的心律失常复发[9-10],以上这些经皮刺激神经的方法均为治疗AF提供了价值。杜鑫等[11]对1968-2013年6月有关GP消融的文献进行荟萃分析,得出结论:与单纯的肺静脉电隔离或者迷宫手术相比较,肺静脉电隔离或迷宫手术联合神经节消融显著提高了阵发性AF患者窦性心律的维持。去肾交感神经可以通过抑制心房电重构、改变心脏自主神经功能来降低AF的发生[12]。这都为干预ANS治疗心律失常提供了解剖及理论基础。
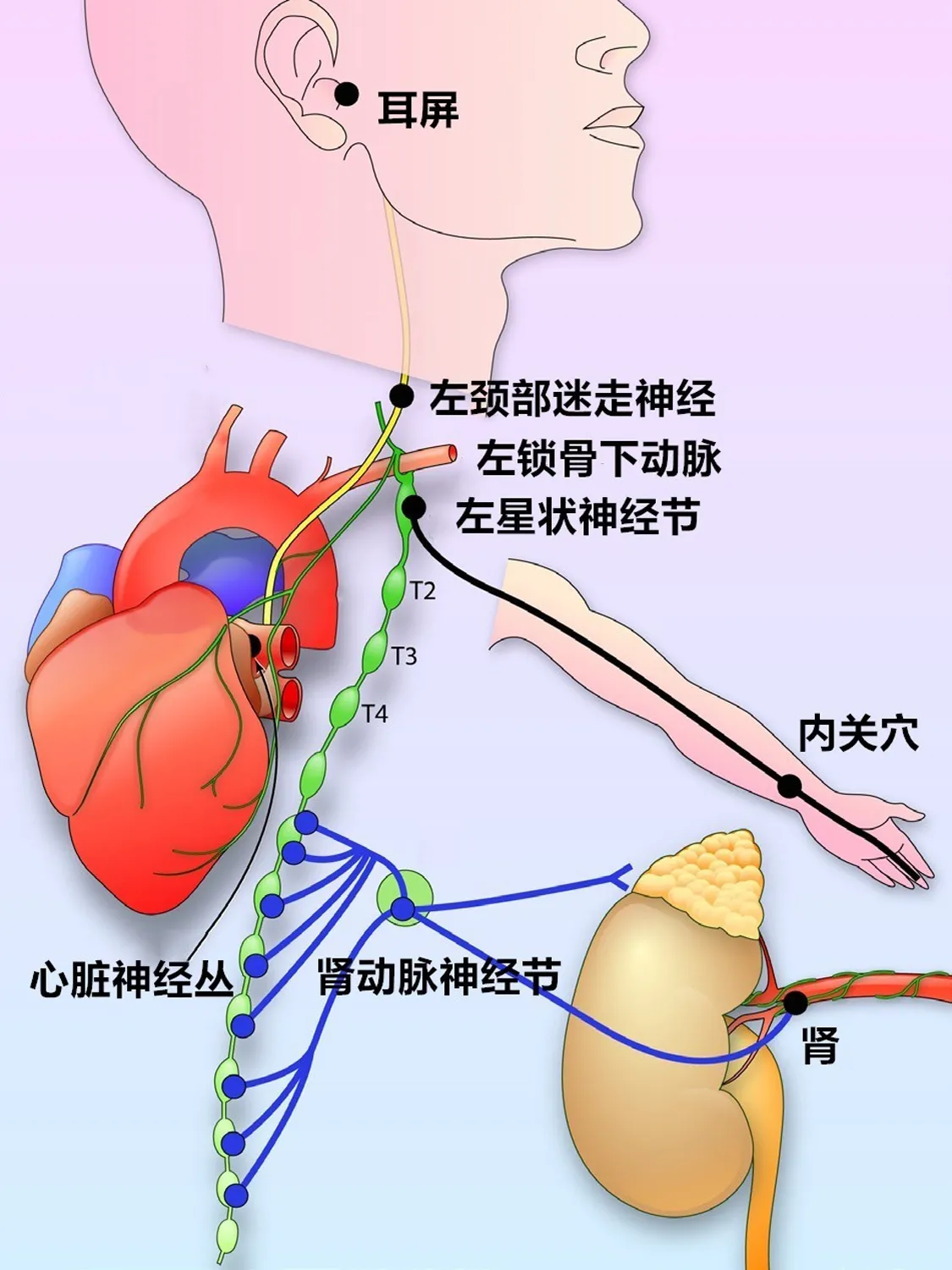
图1 自主神经支配与调节示意图
2 干预自主神经系统治疗心房颤动的机制
众多研究表明,ANS受到刺激或张力增加可缩短心房不应期(atrial refractory period,ARP),增加不应期的离散度,使心房/肺静脉的肌细胞产生自发激动,从而诱发并维持AF,故人们开始探索通过干预ANS治疗AF的研究。通过研究发现,干预心脏ANS治疗AF是可行的,比起单纯的消融手术治疗AF,联合干预心脏ANS治疗AF的有效率更高,复发率低,随着不断深入的研究,未来有望通过干预外源性ANS的方法来预防AF的发生[8-10,12]。
3 干预心脏自主神经治疗心房颤动的方法
3.1GP消融基于自主神经活性对AF的影响,人们也尝试去除交感或者迷走神经节以减少AF的发生。在1991年,就有研究者尝试在犬模型中使用冷冻球囊的方法消融胸腔交感神经节,他们选择单纯消融T2~T4的双侧下部神经节,减少了Horner综合征发生的概率,为这一术式奠定了基础。Tan等[13]通过消融犬左胸交感神经上支发现有以下作用:(1)交感神经及迷走神经对心率的支配作用减弱;(2)心房快速起搏难以诱发AF;(3)心房起搏后房性起搏以及阵发性AF、房速的发生率降低。他们以此推断去除星状神经节具备抑制AF的作用。Ogawa等[14]在犬快速起搏致心力衰竭模型中冷冻消融双侧星状神经节及T2~T4神经节,发现能够明显减少阵发性房速、AF事件。Zhou等[15]通过将18只犬分为2组,依次消融窦房GP和房室结GP,消融前后检测迷走神经电刺激时的窦性心率、AF诱发率和有效不应期变化,得出结论:房室结GP可能在AF的发生和维持中扮演重要的角色。心外膜GP高频刺激也可诱发AF,在心内膜近GP的左上肺静脉和右上肺静脉消融可去除迷走神经诱发的AF。通过以上基础实验研究显示,上腔静脉、肺静脉或心外膜GP消融均可延长心房有效不应期,抑制心房电重构,及预防AF诱发,降低AF易感性。此外,通过碎裂电位消融,同样可以延长心房有效不应期,降低AF易感性,说明消融GP可能有助于抑制AF的发生。
在2012年,Pokushalov等[16]对58名AF患者直接消融左房GP,而未常规进行环肺静脉消融,随访(7.2±0.4)个月,86.2%的患者无AF复发,且无需应用抗心律失常药物。近期,Katritsis等[17]进行了一项前瞻性随机临床试验,将242例阵发性AF(paroxysmal atrial fibrillation ,PAF)分为3组,分别为仅肺静脉隔离(pulmonary vein isolation,PVI)、仅左心房GP消融、PVI加GP消融,经过2 a的随访,PVI、GP消融和PVI + GP消融组分别有56%、48%和74%的患者获得了无AF或房性心动过速的可能,作者得出的结论是:在阵发性AF患者中,与PVI或单纯GP消融相比,PVI加GP消融可以显著提高AF手术的成功率。Qin等[18]研究者对479例接受了PVI的AF患者(其中156例阳性迷走神经反应和323例阴性迷走神经反应)进行了12个月的随访,观察有无AF或其他持续性房性心动过速,以评估手术前、后的自主神经活动,在这项研究中,射频消融的反应是迷走神经激活的证据,证明消融可完全去除迷走神经反射。同时,在临床中,导管消融术可产生神经效应,通过心率变异性可评价自主神经张力,长期随访显示,消融成功组术后心率变异性较复发组进一步降低,这提示AF导管消融产生去神经效应,可提高远期成功率。除导管消融外,微创外科手术已用于PVI和GP消融,结果显著改善[19]。目前的临床证据似乎支持使用GP消融作为AF消融的辅助手术。
3.2肾去神经化治疗肾与心脏在自主神经介导下关系密切,包括下丘脑在内的大多数控制心血管系统的大脑区域,均接受肾神经传入的信号。肾的神经活性能够直接影响心血管系统。RAAS中醛固酮及血管紧张素II可能参与心房的电重构及结构重构。其中醛固酮可促进心肌纤维化,而血管紧张素II可使心房局灶纤维化加重并促进心房扩大,抑制RAAS可以减少心房的重构,延缓AF的发生和发展。而交感神经兴奋是肾释放肾素激活RAAS的主要原因,于是,有学者尝试调整肾交感神经张力以预防AF的发生和发展[12]。
Linz等[20-21]在猪快速心房起搏模型中发现肾去神经化(renal sympathetic denervation,RND)可以抑制心脏交感神经活性,出现负性传导和负向变时,延长房室结有效不应期,增加顺向文氏点周长,有助于AF中心率的控制。RND组能够明显缩短每次AF持续的时间,RND组与对照组相比并未能减少AF的诱发率,但该研究提出了RND在控制AF心室率的作用。Linz等[20-21]还在猪呼吸睡眠暂停模型中发现RND可以防止缺氧造成的ARP缩短,通过此机制减少在呼吸睡眠暂停模型中AF的发生率。Hou等[22]通过刺激左侧星状神经节加心房快速刺激制造犬AF模型,RND可以减少在建模过程中出现的心房有效不应期缩短、不应期离散度增加以及去甲肾上腺素水平增加,从而降低AF的诱发率。Liang等[23]研究了RND在轻度肾损伤AF犬模型中的作用,他们发现RND不仅可以逆转由急性肾损伤AF造成的心率增快、血压增高及P波增宽,还可以延长模型的ARP,减少AF的诱发率,并可以降低AF时心室率。在动物模型中,这种方法已被证明可以消除房性快速性心律失常的发作。于是Pokushalov等[16]将27名有症状的持续性或者阵发性AF病史的患者随机分为2组,14名随机分配到PVI组,13名随机分配到RND + PVI组,在1 a的随访中,他们发现,接受这2种手术的患者中有69%没有发生AF,而仅进行PVI的患者中有29%没有发生AF,虽然试验取得了令人满意的结果,但在RND治疗AF的广泛应用之前,还需要进行大型多中心随机试验。此外,RND是否可以直接抑制AF发生的机制尚不清楚,需要进一步研究。
3.3经皮神经刺激各种形式的躯体感觉刺激都可以产生自主反射反应,这取决于内脏器官和躯体传入刺激。Yu等[24]开发了一种非侵入性经皮方法,以低水平的迷走神经刺激外耳廓,以治疗心律失常如AF,最终通过实验得出结论:低水平的迷走神经刺激可以逆转快速心房起搏诱导的心房重构并抑制AF的发生,这提示未来人们可能通过这种方式无创治疗AF。
另一种治疗神经调节的方法是针灸,针灸的一个作用是调节自主神经。针灸被用于治疗各种患有心血管疾病的患者,在中医药方面,内关穴的刺激已被用于治疗心悸。尽管临床疗效尚未得到证实,但针灸已被广泛应用于疼痛控制[25]。Lomuscio等[26]评估了针灸是否可以预防或减少持续性AF患者的心律失常复发率,他们对80例持续性AF患者进行了电复律恢复窦性心律后的研究,最终得出结论:针灸治疗可以预防持续性AF患者复律后心律失常复发。这2项应用皮肤刺激的研究提高了使用躯体感觉刺激达到调节神经的可能性。一个可能的机制原理是皮肤交感神经的胞体来源于中间的颈椎和星状神经节,这是神经支配心脏的同一神经节[27]。在另一项研究中,针灸可使少数阵发性AF患者的症状性AF发作次数和持续时间显著减少[10],然而,这些研究的局限性相当大,需要进行广泛的进一步研究和临床试验,来验证皮肤神经调节在AF治疗中的功效。个人认为,针灸可能是一种有效的非侵入性和安全的抗心律失常治疗方法。
另一种方法是脊髓电刺激。近期,Wang等[28]通过动物实验研究表明,脊髓电刺激能够显著缩短心房有效不应期,可能通过抑制自主神经重构来抑制快速心房起搏诱导的AF的发生。Dai等[29]研究者通过实验发现,脊髓电刺激可以调节迷走神经、星状神经节和GP之间的外在和内在心脏神经活动,脊髓电刺激也可以促进迷走神经的作用并减弱星状神经节刺激对心房电生理学的影响。脊髓电刺激也有可能成为未来治疗AF的新方法。
3.4运动训练运动训练对自主神经功能具有调节作用,而慢性运动训练对于那些患有多种心脏疾病的人来说是一种公认的治疗方式。虽然已经有研究表明长时间的耐力运动会增加AF的发生率和风险,但是,较轻微的体力活动与AF风险降低有关,目前也有研究表明AF与运动之间存在关联[30]。因此,有研究者提出,运动在永久性AF患者的治疗中也有一定的作用。Guasch等[31]通过实验得出结论,慢性耐力运动增加大鼠的AF易感性,自主神经改变、心房扩张和纤维化被确定为潜在的机械贡献者,迷走神经促进作用尤为重要,可能是由于RGS蛋白表达下调,增加压力感受反射和增加心肌细胞对胆碱能刺激的敏感性。这些观察结果与耐力运动员AF患病率显著增加的临床观察相符合。然而,慢性运动训练可能通过改善心室率来控制AF。Jennifer等[32]对所有英语文献进行了系统和全面的文献回顾,共确定了6项研究,3项随机对照试验共118名参与者,3项观察性研究共93名参与者,得出结论:慢性运动训练似乎在永久性AF的治疗中发挥着有前途的作用。由轻度和中度适当活动导致AF风险降低的机制可能涉及独特的途径[31],运动可以通过对心血管危险因素的有利影响因素潜在地降低AF发生的风险。未来需要研究不同形式的运动训练干预对改善永久性AF患者的临床结果的影响,寻找最适合AF患者的运动训练方式。
4 总结
综上,自主神经活动在AF的发生和维持中起着重要作用,调节自主神经功能可能有助于AF的控制。上述不同治疗AF的方法均可以减弱自主神经失衡效应,从而降低AF的易感性,提高AF治疗效果,提示干预自主神经系统可能成为治疗AF的有效方法,逐渐受到临床医师的重视,这些治疗方法包括神经丛消融、肾去神经化治疗、经皮神经刺激和运动训练,并已经逐渐运用于临床中,但仍具有一定的局限性,还需要更多的研究认识。

