抗磷脂综合征诊治及发病机制
李洁琼,张 文
抗磷脂综合征 (antiphospholipid syndrome,APS) 是一种以血栓形成和/或病理性妊娠为特征、实验室检查以持续性抗磷脂抗体(antiphospholipid antibodies,aPL)阳性为表现的疾病谱。近几年国际上APS研究取得了许多进展,主要涉及发病机制、APS“诊断标准外”的临床表现、aPL类型和治疗等。2017年自然风湿病综述NatureReviewRheumatology发表的一篇综述中详细介绍了APS在发病机制、诊断和治疗等方面的最新认识和观点,本文以该综述为基础,复习并总结APS近年来的进展。
1 APS发病机制
APS血栓的形成是一个复杂的过程,目前提出的是“二次打击”学说[1],“一次打击”即aPL与血管内皮细胞、中性粒细胞、血小板以及单核细胞相互作用,“二次打击”即为诱发因素,如制动、感染、避孕药等。此外,传统的心血管风险因素也进一步促进血栓形成,如高血压、糖尿病、肥胖、吸烟以及高脂血症。
血栓形成的条件之一是血管内皮细胞的功能损害。aPL可以介导血管内皮抗凝功能障碍以及补体激活调控机制失调,从而导致易栓倾向。aPL激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)复合物,从而刺激血管内皮细胞增生,参与血管病变[2-3]。补体C4a、C3a和C5a作为炎症介质在补体诱导的胎盘炎症过程中起重要作用,也可以增加血管通透性,激活血小板和中性粒细胞,并诱导单核细胞释放促炎细胞因子,构成血栓形成微环境[1]。β2糖蛋白I(β2 glycoprotein I,β2GPI)可以通过改变C3构象调控补体活化而促进C3的降解[1],抗β2GPI抗体干扰这一补体调控机制。也有文献报道,APS患者普遍存在H因子(一种补体激活抑制剂)的自身抗体,并与反复静脉血栓形成有关[4]。
除目前诊断标准中包括的3种aPL,即抗心磷脂抗体(anticardiolipin antibody,aCL)、狼疮抗凝物(lupus anticoagulant,LA)和抗β2GPI抗体以外,近年来随着研究方法的进步,发现有多种“诊断标准外”的aPL,包括IgA型抗体、抗磷脂酰丝氨酸/凝血酶原抗体(phosphatidylserine-dependent antiprothrombin antibodies,aPS/PT)、抗第一功能区的β2GPI(domain I of β2GPI,DI)抗体以及抗膜联蛋白抗体等[1],上述“诊断标准外”aPL的致病机制也被进一步研究。膜联蛋白是一种钙依赖性磷脂结合蛋白,其中膜联蛋白A5可以与带负电磷脂结合并形成防护盾样构象,具有抑制凝血酶的强效抗凝作用[5],β2GPI依赖性抗磷脂抗体可以干扰膜联蛋白A5与血管内皮细胞的保护性结合,促进抗β2GPI抗体与暴露的带负电磷脂竞争性结合,从而导致血栓形成,这一机制可能参与心肌梗死和脑卒中的发病过程[6]。膜联蛋白A2是纤维蛋白酶生成和细胞表面定位的辅助因子,同时也作为介导β2GPI与血管内皮细胞结合的受体,抗膜联蛋白A2抗体可以通过活化血管内皮细胞而诱导组织因子的表达,并阻碍纤溶酶原激活剂诱导的纤溶酶原激活过程,进而发挥促血栓形成作用[5]。目前对APS发病机制的研究为APS治疗带来了新的潜在靶点(表1)。
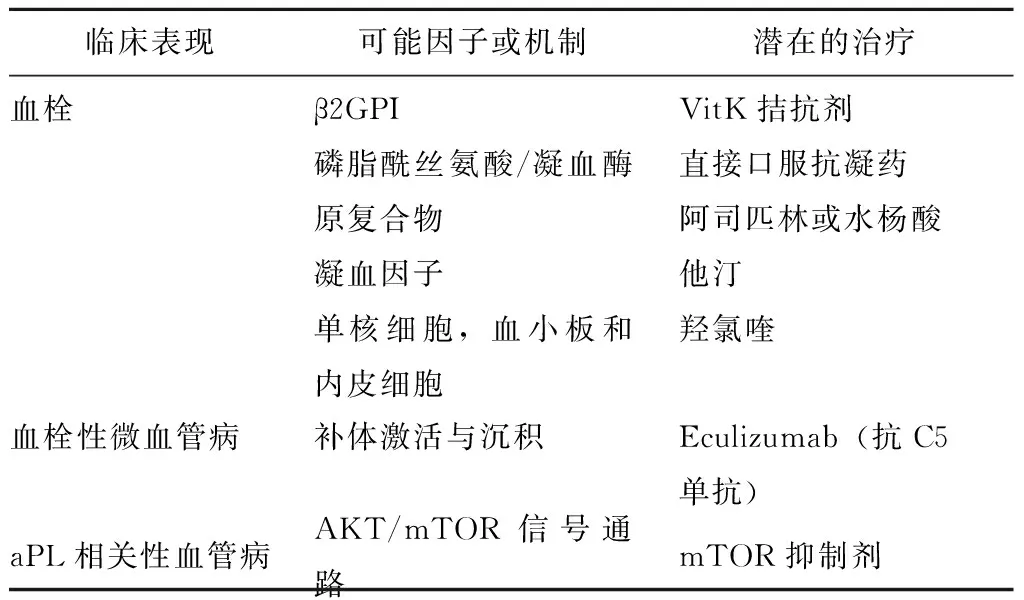
表1 不同临床表现的APS机制及可能的治疗靶点[1]Table 1 Mechanisms underlying the different clinical manifestations in APS and potential targeted therapies[1]
2 APS诊断标准
根据2006年修订的札幌APS分类诊断标准,确诊APS至少要满足一项临床诊断标准(血栓形成或病理性妊娠)和一项实验室诊断标准的aPL阳性反应,实验室的标准为至少发生两次aPL阳性反应,时间间隔不少于12周。分类标准不等同于诊断标准,临床实践发现,aPL阳性反应间隔12周的诊断标准可能会带来诊断时间的延误,也不利于那些有APS相关临床表现但血清学测定结果阴性的患者的临床诊断。因此,Abreu等[7]提出了“诊断标准外”临床表现及aPL类型,Arachchillage等[8]也提出了“诊断标准外”产科型APS(non-criteria obstetric antiphospholipid syndrome,Obs-APS)的诊断,即满足“诊断标准外”的临床表现和一项标准实验室指标或满足典型APS病理性妊娠表现和“诊断标准外”实验室指标。
2.1 “诊断标准外”临床表现
APS是最常见的获得性易栓症,动静脉以及微血管均可发生血栓,可为单血管发病,也可多血管受累,故APS的临床表现谱多种多样。按照受累器官或系统划分,APS“诊断标准外”的临床表现主要包括血小板减少、心脏瓣膜病以及皮肤、肾脏和中枢神经系统等组织器官损害。
aPL相关的血小板减少是APS常见的“诊断标准外”表现,发生率为20%~46%[7],多为轻中度,且出血风险较低,但血小板减少对血栓形成并没有保护作用[1,5]。肾脏是原发性APS和系统性红斑狼疮(systemic lupus erythematosus,SLE)相关性APS的主要靶器官,APS的急性损害通常表现为血栓性微血管病,慢性损害表现为动脉硬化、纤维内膜增生、局灶性皮质萎缩及动脉闭塞,严重者可因肾功能不全而死亡。因此临床上快速识别APS相关性肾病,并与免疫复合物介导的肾脏损害(狼疮肾)相鉴别对于APS患者的诊断尤为重要[1]。心脏瓣膜病在APS患者中发病率较高,且抗凝或抗血小板治疗不能有效控制病变的进展[9],还可能增加血栓再发的风险[5]。中枢神经系统受累可出现偏头痛、癫痫、认知障碍、痴呆、舞蹈症以及眼部症状,如一过性黑朦等,这些表现与aPL的关联性仍存在争议[1,5]。
识别“诊断标准外”APS的临床表现并及时予以有效的干预可以改善患者的治疗结局。第十四届国际aPL大会推荐了作为APS诊断标准条目的“诊断标准外”临床表现:(1)强烈推荐的表现为:APS肾脏病变、心瓣膜病;(2)推荐的表现为:浅静脉血栓、血小板减少、网状青斑、舞蹈症、纵向脊髓炎;(3)不推荐的表现为:癫痫、偏头痛[7]。目前值得期待的APS诊断新标准(ACR/EULAR)正在制定中。
2.2 “诊断标准外”aPL
aPL检测的新技术有助于“诊断标准外”aPLs研究,包括化学发光免疫分析技术(the automated chemiluminescence immunoassay,CLIA)、多线点测定法(multiline dot assays,MLDAs)以及薄层色谱(thin-layer chromatography,TLC)[1]。
aPL是针对磷脂和凝血相关因子的一组抗体或谱系。由于分类标准中尚未包含aCL、LA及aβ2GPI以外的其他aPL,临床上会存在一些“血清学阴性APS”患者。目前发现的“诊断标准外”aPL包括 aPS/PT、抗DI抗体、抗膜联蛋白A5和A2抗体、抗磷脂酰乙醇胺抗体以及抗波形蛋白抗体[1]。
Žigon等[10]研究发现,aPS/PT与早期、晚期流产以及早产有关,一项国际上多中心研究证实,aPS/PT具有良好的诊断特异度(88%~91%)且与APS发病关联性强(OR=10.8)[11]。Pericleous等[12]进行的多中心队列研究显示,在aCL/aβ2GPI测定结果阳性的基础上,aDI测定阳性可使APS的患病风险增加2~4倍,血栓风险增加3倍,同时aDI对APS和非APS有较好的鉴别能力,但并不能完全取代aβ2GPI。此外,IgA/IgG型aDI可以提高APS的诊断率,有助于预测血栓事件及产科事件[13],可见aDI可作为标准aPL诊断的良好补充。膜联蛋白A2抗体虽然在APS患者中有较高阳性率,但疾病特异度较低[5],膜联蛋白A5抗体的临床意义仍有争议,一些研究结果并不支持其与APS患者病理性妊娠及血栓史具有关联性[6]。
3 APS的治疗
3.1 血栓形成的风险评估
APS血栓事件的风险因素与aPL的表型和滴度、自身免疫状态、心血管危险因素以及血栓的部位有关。比如,Yelnik等[14]对“无症状aPL阳性反应患者”(APS-free aPL carriers)的长期随访中证实了aPL“三阳”(即aCL、LA及aβ2GPI均阳性)与血栓形成的关联性(OR=3.38)。Sciascia等[15]结合aPL表型和传统心血管危险因素构建了APS评分(Global APS Score,GAPSS)工具,最先应用于SLE患者血栓性形成及妊娠失败的风险预测,随后在原发性APS队列中也证实了GAPSS是原发性APS血栓形成风险分层的有效工具[16]。最近,Radin等[17]提出了调整GAPSS (the adjusted Global AntiphosPholipid Syndrome Score,aGAPSS),用以预测50岁以下APS患者急性冠脉事件的风险。以上风险分层评分系统有助于临床上判别高危患者以及指导药物治疗。
3.2 APS的治疗进展
aPL反应阳性患者血栓一级预防的推荐方法为:(1)存在创伤、感染、外科手术、长期制动等血栓形成高危因素时强烈推荐低分子肝素(low-molecular-weight heparin,LMWH);(2)aPL检测“三阳”患者推荐小剂量阿司匹林(low-dose aspirin,LDA);(3)并发自身免疫性疾病的患者推荐 LDA和羟氯喹(hydroxychloroquine,HCQ),与阿司匹林相比,HCQ 是一种有效的一级预防药物[18]。
血栓的二级预防:在一项真实世界的多中心观察性研究中,APS患者初次血栓形成后的5年再发率为每年7.5/100人,口服抗凝剂的停用、糖尿病和遗传性血小板增多症是血栓再发的独立危险因素[19]。预防血栓再发生的推荐措施是长期口服抗凝剂[20-21]。抗凝治疗过程中血清学检测指标改善(滴度降低或转阴)并不是停药的指征,有文献报道停用抗凝药后1~3周内aPL会迅速回升,停药后的最初6个月血栓复发风险显著升高[22],但有学者指出部分特定(aPL持续阴性低血栓风险)的原发性APS患者可以停用抗凝剂或抗血小板药[23]。然而,最近的一项回顾性研究显示,停用抗凝剂后血栓再发率为25%,3例停药2周内发生灾难性APS(catastrophic APS,CAPS),无论aPL检测结果是否转阴性,APS患者停止抗凝治疗都有血栓再发的风险[24]。因此,APS患者停止抗凝治疗应非常慎重。
APS患者血栓再发时可选择的治疗方案有:抗凝剂联合抗血小板疗法(LDA/氯吡格雷),加用免疫抑制剂、他汀类药物、羟氯喹、治疗剂量的低分子肝素、利妥昔单抗以及造血干细胞移植[25-30]。
口服维生素K拮抗剂(vitamin K antagonists,VKA)进行长期抗凝治疗虽是APS的治疗的基础疗法,但最近几年开发的直接口服抗凝剂(direct oral anticoagulants,DOACs),包括直接抑制Xa因子的利伐沙班(rivaroxaban)、阿哌沙班(apixaban)和依度沙班(edoxaban)以及直接凝血酶抑制剂达比加群酯(dabigatran),与华法林相比具有不经细胞色素P450代谢、与食物和药物相互作用少、无需监测国际标准化比值(international normalized ratio,INR)、改善生活质量等独特优势。一项前瞻性研究对56例应用DOACs的APS患者进行平均22个月的随诊,显示2例(3.6%)发生出血事件,6例(10.7%)再发血栓,静脉血栓栓塞(venous thromboembolism,VTE)的再发率为每年5.8/100病人,说明DOACs治疗APS较为安全[31],但需大规模研究证实。此外,在111例既往有VTE史的APS患者中,与华法林组相比,利伐沙班具有降低补体活性的作用,使这类患者在抗凝的同时额外获益[32]。
3.3 aPL相关性血小板减少的治疗推荐
APS患者血小板减少的发生率为29.6%[33],aPL相关性血小板减少通常是轻中度且无临床表现,大多数患者血小板计数>50×109/L,除了偶尔出现血栓性微血管病变(比如CAPS)外,出血现象并不常见,因此APS的血小板减少很少需要治疗[34],密切监测即可。
无血栓的aPL阳性患者以及有血小板减少表现的APS患者具有血栓形成的高风险,血小板减少的aPL阳性患者主要是在具有血管危险因素或LA阳性的情况下应用阿司匹林或羟基氯喹进行一级血栓预防[21]。aPL检测阳性、出现血小板减少但缺乏APS临床症状的患者可诊断为免疫性血小板减少症(immune thrombocytopenia,ITP),与ITP相似,因此APS相关的血小板减少症的治疗策略可借鉴ITP治疗指南[35],同样在有出血症状的APS患者中也应考虑ITP治疗方案[21],具体方案如下:(1)糖皮质激素是APS相关性ITP的一线治疗药物,口服剂量为1~2 mg/(kg·d),出现糖皮质激素抵抗或者不耐受者可选用免疫抑制剂,如硫唑嘌呤和环磷酰胺。此外,静脉丙种球蛋白(intravenous immunoglobulin,IVIG)用于危及生命的大出血或需要快速升高血小板计数患者的治疗。B细胞靶向药物在APS治疗中疗效明确,研究发现,利妥昔单抗治疗APS后期临床表现(包括血小板减少)及血清学指标均有改善。脾切除术只用于出现严重出血症状以及对糖皮质激素和免疫抑制剂抵抗的难治性患者。CAPS患者出现严重血小板减少时可采用血浆置换疗法。促血小板生成素受体激动剂可能会增加APS患者血栓风险,应谨慎使用。血栓形成与血小板减少相关的出血事件共存时,若血小板计数达安全水平(>50×109/μl),则推荐糖皮质激素联合抗凝疗法。
3.4 APS患者妊娠期的治疗策略
Espinosa等[21]推荐对于无血栓史的APS女性患者采用以下措施:(1)初次妊娠或正常生育史者可密切监测,无需特殊处理,但由于LDA对子痫前期的有保护作用,也推荐应用LDA;(2)早期流产史(妊娠10周内)者可采用LDA单药或LDA联合预防剂量的低分子肝素(low molecular weight heparin,LMWH);(3)有妊娠10周以上胎儿丢失史、子痫前期或胎盘功能不全史者采用LDA联合预防剂量的LMWH。对于有血栓史的APS患者,妊娠期应用LDA联合治疗剂量的LMWH。其中,产科型APS(Obs-APS)应将预防剂量的LMWH使用至产后6周,未接受过产前血栓预防(仅LDA)并且无其他血栓危险因素者可以考虑LMWH使用至产后7 d, 如果有其他血栓风险,LMWH应延用至产后6周。Merashli等[36]进一步总结了Obs-APS治疗方案:(1)反复早期流产(妊娠10周内)者可采用LDA(75~100 mg/d)联合预防剂量的普通肝素或LMWH,部分患者LDA可单独应用;(2)妊娠晚期并发症(妊娠10周以上)者采用LDA联合预防剂量的普通肝素或LMWH;(3)有血栓史的妊娠期APS患者可采用LDA联合治疗剂量的普通肝素或LMWH。最近,EULA就APS女性的健康问题和计划生育问题制定了相关建议R[37],并以证据水平(1~3级)和推荐等级(A~D级)两项指标来定性每项建议的权重和效力,其中关于APS患者妊娠期治疗方案,EULAR推荐采用LDA和肝素联合治疗,以减少不良妊娠结局的风险(表2)。
有关妊娠期LDA剂量限制问题,2012年美国胸科医师学会第9版抗血栓治疗及预防指南建议中推荐[38],对于满足APS血清学诊断标准以及在≥3次妊娠失败的基础上符合Obs-APS临床标准的患者建议产前使用普通肝素(预防剂量或中等剂量)或LMWH(预防剂量)联合LDA(75~100 mg/d)(Grade 1B)。此外,一项纳入5例随机对照临床试验(randomized-controlled trail,RCT)研究的Meta分析显示[39],与单用LDA相比,Obs-APS患者使用肝素-LDA联合疗法的活产率更高,研究中LDA剂量为75 mg/d或81 mg/d。
LDA-LMWH治疗失败的难治性Obs-APS患者可以再次尝试LDA-LMWH,或加用小剂量糖皮质激素、IVIG、HCQ、血浆置换或他汀类药物[40-44]。最近一项回顾性多中心开放性研究显示,难治性Obs-APS患者中LA和IgG-aCL是最常见的aPL表型,45%的患者出现aPL“三阳”征,在LDA-LMWH基础上加用HCQ可降低妊娠失败率和子痫前期发生率,并可改善新生儿的出生体重和Apgar评分[45]。
4 总结与展望
APS的临床表现谱不仅局限于血栓形成和病理性妊娠,还包括一些易栓状态不能完全解释的其他症状,同时aPL也是一组抗磷脂结合蛋白的异质性抗体,因此ASP的诊断标准仍需改进。近年来,APS的研究进展主要是提出了“诊断标准外”的临床表现和抗体,并建立了血栓风险评估体系,有利于识别高危人群并早期予以干预。在APS治疗方面,越来越多的具有高循证医学级别的临床研究证实,抗血栓疗法是治疗APS的主要方法,可显著改善患者的治疗结局,但疗效仍不够满意。血栓栓塞的APS患者需要长期接受抗凝治疗,停药需慎重。随着APS新的致病因子及分子机制研究的进展,潜在的治疗靶点逐渐被发现,可能会给APS的治疗带来更多的选择。

表2 EULAR关于APS女性健康、计划生育、辅助生殖、妊娠和绝经期管理的建议[37]Table 2 Recommendations for women health and the management of family planning, assisted reproduction,pregnancy and menopause in patients with antiphospholipid syndrome (APS)[37]

