乳酸菌发酵转化人参皂苷
夏晚霞,张尚微,葛亚中,任杰,余庆涛,杨继国,,宁正祥
(1.华南协同创新研究院,广东东莞 523808)(2.华南理工大学食品科学与工程学院,广东广州 510640)(3.无限极(中国)有限公司,广东广州 510640)
人参(PanaxginsengC. A. Mey)为五加科多年生植物人参的根,是传统名贵中药,人参皂苷(ginsenoside,GS)是人参生理活性的主要物质基础,也是人参成分中最有效的药用成分,其中含量较少的稀有人参皂苷(rare ginsenosides)具有极高的药用价值和应用前景[1,2]。例如,稀有人参皂苷Compound K (CK)在抗肿瘤、抗炎、抗糖尿病、抗血栓形成、抗老化和保肝等方面具有很好的作用[3,4];Rg3最初从红参中分离得到[5],它主要作用于细胞增殖周期的G2/M 期,具有诱导肿瘤细胞凋亡,选择性抑制肿瘤细胞黏附和浸润,抑制肿瘤新生血管的形成,增强机体免疫力等作用。但这些稀有皂苷天然含量极低,如Rg3在白参中的含量仅为0.0003%,在红参中的含量约为0.03%,因此从人参中直接提取这些稀有皂苷较为困难[6]。为了获得大量人参皂苷,尤其是生理活性较强的稀有皂苷,国内外学者展开了一系列的研究和探索,稀有人参皂苷能够从人参中含量较高的Rb1、Rb2、Rc和Rd等主皂苷(major ginsenosides)转化得到[7]。
乳酸菌是公认的人体益生菌,具有安全性高,生长速度快,代谢机制较明确,副产物少等特点,常用于制造酸奶、乳酪、啤酒、泡菜和其他发酵食品;在生物工程、工农业和食品加工等领域具有广泛的应用前景[8]。大量研究表明,乳酸菌能够调节胃肠道正常菌群,从而改善胃肠道功能;控制肠道内腐败菌生长;提高食物消化率和生物效价;降低血液中的胆固醇含量,对冠心病和脑血管疾病具有很好的疗效[9]。并且,另有研究表明,乳酸菌能够产胞外β-葡萄糖苷酶,该酶能够水解多种β-葡萄糖苷[10]。对比人参皂苷分子结构,由于所连接的糖苷配基不同,会有多种单体人参皂苷。利用β-葡萄糖苷酶水解人参皂苷的葡萄糖苷,从而产生活性更高、药效更强的稀有皂苷已成为人参研究的热点问题。研究表明,发酵方法可以改变人参皂苷的糖链结构,促使其向稀有皂苷转化,从而改变人参中皂苷和稀有皂苷的含量,增强人参的药理活性,促进肠道吸收[11~13]。
因此,本研究选取5种乳酸菌对人参提取物进行发酵,通过定向生物转化将部分人参皂苷转化成稀有皂苷,使发酵后的人参提取物中稀有皂苷的含量提高,同时研究发酵条件对转化生成稀有皂苷含量的影响,并确定最适宜的发酵条件,为开发各种人参深加工产品提供参考。
1 材料与方法
1.1 材料与仪器
人参提取物(粉),无限极有限公司提供;浓缩苹果汁,秦安长城果汁饮料有限公司;干酪乳杆菌、副干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌和发酵乳杆菌,广东省微生物菌种保藏中心;色谱纯乙腈、磷酸、甲酸、分析纯正丁醇购自天津科密欧化学试剂有限公司;人参皂苷标准品,上海源叶生物科技有限公司;Thermo U3000高效液相色谱仪;Agilent HPLC-6500 Q-TOF飞行时间质谱联用仪。
1.2 实验方法
1.2.1 人参提取物的乳酸菌发酵
利用5种乳酸菌分别对人参提取物进行发酵,以浓缩苹果汁为糖源,初始发酵液中含人参提取物和浓缩苹果汁分别为 15%和 10%(m/m),初始总糖量为5%(m/m)。于60 ℃下,消毒45 min,冷却后以1%的接种量加入培养好的植物乳杆菌、嗜酸乳杆菌、干酪乳杆菌、副干酪乳杆菌和发酵乳杆菌,混合均匀后封口于35 ℃培养箱中静置发酵10 d。
1.2.2 人参皂苷LC-MS定性分析
样品制备:取等量5种乳酸菌发酵液混合后冷冻干燥,得粉末状样品,精密称取粉末1.0022 g,以料液比为1:20 mL,加入超纯水20 mL于50 mL锥形瓶。以超声频率100 Hz,室温超声30 min,并补足损失水的体积。静置滤纸过滤,滤液用水饱和正丁醇萃取 3次,合并上层液,在45 ℃旋转蒸发仪减压浓缩至近干,加甲醇5 mL溶解。以备分析用。
样品分析:色谱分离采用岛津Intestinal ODS-SP C18 column (4.6×250 mm,5 µm),梯度洗脱条件如下:流动相A为0.1%甲酸水,B为乙腈,梯度洗脱条件如下:0~25 min,19%~20% B;25~60 min,20%~40% B;60~70 min,40%~100% B。流速:1 mL/min,波长:203 nm,柱温:35 ℃,进样量:10 μL。质谱条件:MS-Q-TOF检测器;干燥气(N2)流速,8 L/min;干燥气温度,320 ℃;雾化器压力,35 psig;毛细管电压,3500 V;OCT RFV,750 V;碎片电压,100 V。用负离子模式采集数据,离子扫描范围为m/z60~1500。数据采集及处理分别采用 Agilent Mass Hunter Acquisition Software Version B.05.00和Mass Hunter Workstation Software Version B.05.00软件(Agilent科技有限公司)。
1.2.3 人参皂苷HPLC定量分析
样品制备:取10 mL发酵液置于分液漏斗中,向其中加入100 mL的乙醚脱脂,分三次进行。然后取100 mL水饱和正丁醇萃取发酵液中的皂苷,分三次进行。最后,将三次萃取液收集,45 ℃减压蒸发至干,用3 mL甲醇溶解,备用。
样品分析:Agilent Zorbax SB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈(A)和0.1%磷酸水(B),按表1梯度洗脱,柱温为30 ℃,检测波长为203 nm,流速为1.0 mL/min,进样量10 μL。

表1 梯度洗脱方法Table 1 Gradient elution method
标准曲线的确定:分别精密称取人参皂苷Rg1、Re、Rb1、Rb2、Rd、Rg3、F2、CK、Rh1 标准品,甲醇配制成各单体皂苷浓度为1 mg/mL的混合溶液,将该混合液稀释成 50、100、200、400、800、1000 μg/mL六个浓度,以峰面积和标准品浓度做标准曲线。
精密度和稳定性实验:取200 μg/mL对照品混合溶液重复进样6次,计算各峰面积RSD。取200 μg/mL对照品混合溶液在0、2、4、8、16、24 h分别进样,计算各峰面积RSD。
1.2.4 发酵工艺优化
通过单因素实验探究发酵时间、初始pH、接种量和底物浓度对乳酸菌发酵人参提取物生成稀有皂苷的影响。发酵时间为28 d,取样时间0 d、1 d、4 d、8 d、12 d、16 d、20 d、24 d和28 d;接种量采用1%、5%、10%和15% 4个水平,初始pH按4.0、5.0、6.0、7.0和8.0设置,底物浓度采用5%、10%、15%和20% 4个水平。其他发酵条件同1.2.1,以发酵液中生成稀有皂苷的含量为筛选指标。
1.2.5 数据分析
采用Origin 8.5和SPSS 19.0对本文数据进行处理和分析,每组重复 3次,实验数据表示为平均值±标准偏差。采用单因素分析和Tukey’s HSD法进行多重比较,显著水平为p<0.05。
2 结果与分析
2.1 人参皂苷的LC-MS检测
人参提取物发酵液中皂苷 LC-MS检测的离子流图如图 1。根据保留时间、质谱峰、精确的分子离子峰的质荷比等信息解析得出A和B各自峰形对应的物质,见表2。
由图1和表2分析表明,发酵液中检测到38个人参皂苷的峰,其中有6个同分异构体,同时,在发酵液中检测到稀有皂苷F2、Rg3、和CK。结果表明人参提取物经乳酸菌发酵后含有多种人参皂苷和稀有皂苷,确定了发酵后人参提取物中有效活性成分的存在。

图1 人参提取物发酵液中皂苷LC-MS检测离子流图Fig.1 LC-MS extracted ion chromatogram ofginsenosides from ginseng extracts fermentation broth

表2 人参提取物发酵液中皂苷LC-MS检测图谱解析Table 2 The analysis results of the mass spectraofginsenosides from ginseng extracts fermentation broth

15 Rb2 57.072 C53H90O22 1123.5892 16 Ma-Rb2 57.254 C56H92O25 1163.5829[M-H]-17 Rb3 57.568 C53H90O22 1123.5886 18 ChikusetsusaponinIVa 59.957 C42H66O14 793.4368[M-H]-19 Rd 60.050 C48H82O18 991.5461 20 Ma-Rd 60.294 C51H84O21 1031.541[M-H]-21 Zingibroside R1 65.650 C42H66O14 793.4369[M-H]-22 Notoginsenoside Ft1 63.608 C47H80O17 961.5365 23 unknown 64.237 C47H80O17 961.5355 24 Rg6 64.459 C42H70O12 811.4835 25 F4 64.922 C42H70O12 811.4838 26 RK1 68.066 C42H70O12 811.4841 27 Rg5 68.231 C42H70O12 811.4836 28 RK3 64.971 C36H60O8 665.4256 29 Rh4 65.005 C36H60O8 665.4256 30 S-PPT 66.841 C47H80O17 521.3836 31 20(S)-Rs3 66.256 C44H74O14 825.499 32 20(R)-Rs3 66.421 C44H74O14 829.4925 33 20(S)-F1 55.986 C36H62O9 683.4392 34 20(S)-F2 65.302 C42H72O13 829.4947 35 20(R)-F2 65.451 C42H72O13 829.4944 36 20(S)-Rg3 66.312 C42H72O13 829.4948 37 20(R)-Rg3 66.477 C42H72O13 829.4943 38 20(S)-CK 68.546 C36H62O8 667.4415
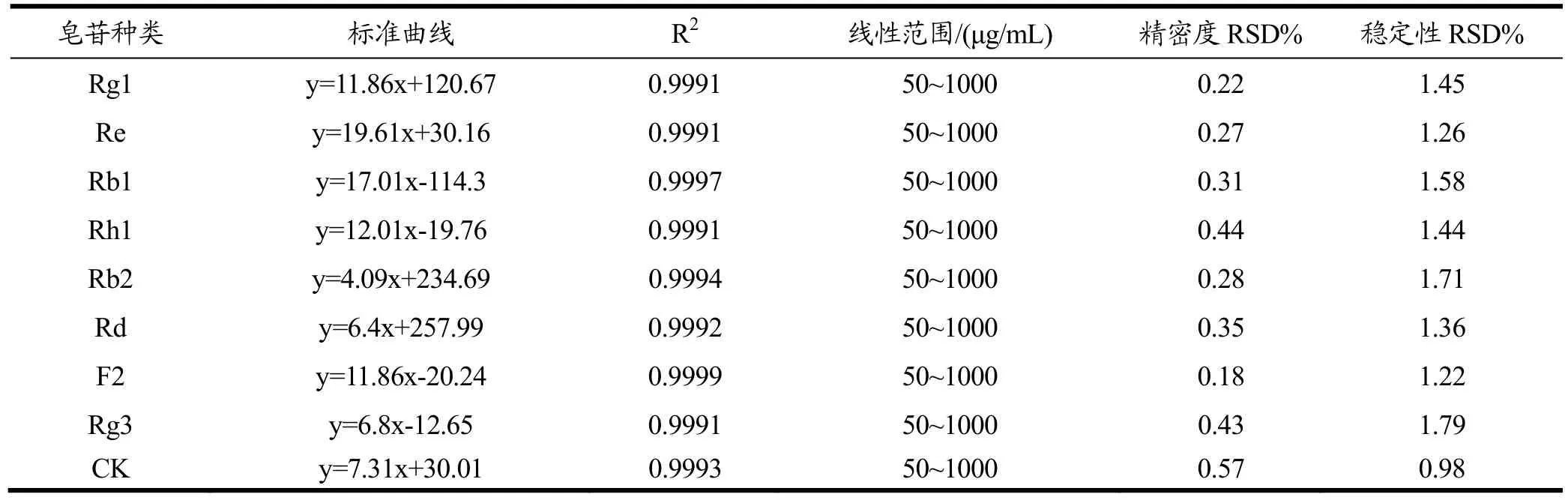
表3 人参皂苷标准曲线、稳定性和精密度Table 3 The working curve, stability and accuracy experiments (RSD) of standard samples of ginsenosides(n=6)
2.2 线性关系和方法学考察
以峰面积和标准品浓度做标准曲线。各单体人参皂苷标准曲线及线性范围见表3所示。精密度和稳定性实验表明该方法精密度良好且在 24 h内保持稳定(表 3)。
2.3 乳酸菌的筛选
本研究选取了5种乳酸菌,植物乳杆菌、嗜酸乳杆菌、干酪乳杆菌、副干酪乳杆菌和发酵乳杆菌对人参提取物进行发酵,通过比较5种乳酸菌发酵人参提取物后,发酵液中生成的 3种稀有皂苷 F2,Rg3和CK的水平,来筛选适合人参提取物发酵的乳酸菌。检测结果表明,5种乳酸菌均能转化人参提取物中的皂苷生成稀有皂苷,稀有皂苷含量比较结果如图2所示。结果显示,植物乳杆菌发酵产生的稀有皂苷 F2和Rg3含量相对较高,生成的CK含量无明显差异。因此植物乳杆菌为最适人参提取物发酵生成稀有皂苷的菌种。
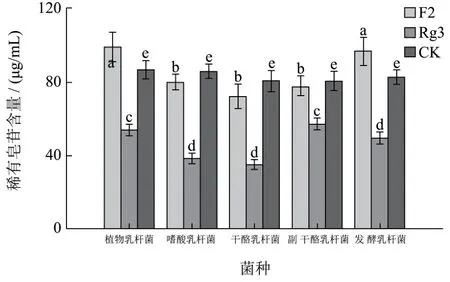
图2 不同乳酸菌发酵对稀有皂苷含量的影响Fig.2 Lactic acid bacteria fermentation on the influence of rare ginsenoside contents
2.4 植物乳杆菌发酵工艺的优化
2.4.1 发酵时间的优化
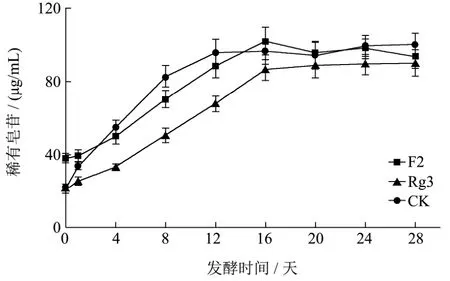
图3 发酵时间对稀有皂苷含量的影响Fig.3 Fermentation time on the influence of rare ginsenoside contents
比较植物乳杆菌发酵不同时间发酵液中F2、Rg3和CK含量的变化,见图3。
结果表明,在发酵前期,随着发酵时间的延长,3种稀有皂苷的含量均逐渐增加,发酵16 d后,稀有皂苷的升降趋势已经不是很明显,趋于稳定,因此确定最优发酵时间为16 d。
2.4.2 发酵初始pH的优化
发酵前,调发酵液初始pH至不同的值,考察初始pH对发酵生成稀有皂苷的影响。比较发酵完成后发酵液中F2,Rg3和CK的含量,由图4可知,当发酵液初始pH为6时,植物乳杆菌发酵完成后各稀有皂苷含量达到最大。因此确定植物乳杆菌发酵人参的最优初始pH为6。
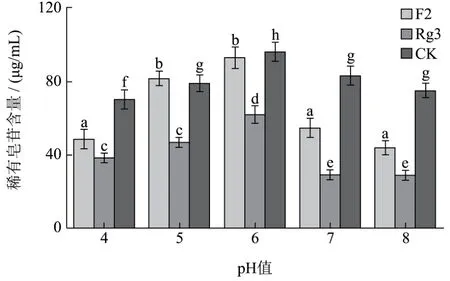
图4 发酵初始PH对稀有皂苷含量的影响Fig.4 Fermentation PH on the influence of rare ginsenoside contents
2.4.3 接种量的优化
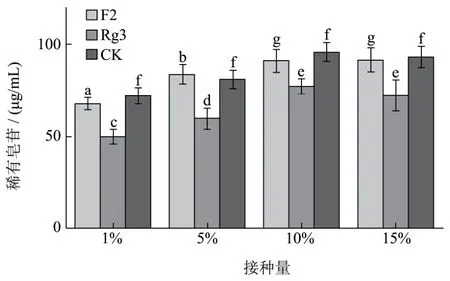
图5 接种量对稀有皂苷含量的影响Fig.5 Inoculation quantity on the influence of rare ginsenoside contents
2.4.4 底物浓度的优化
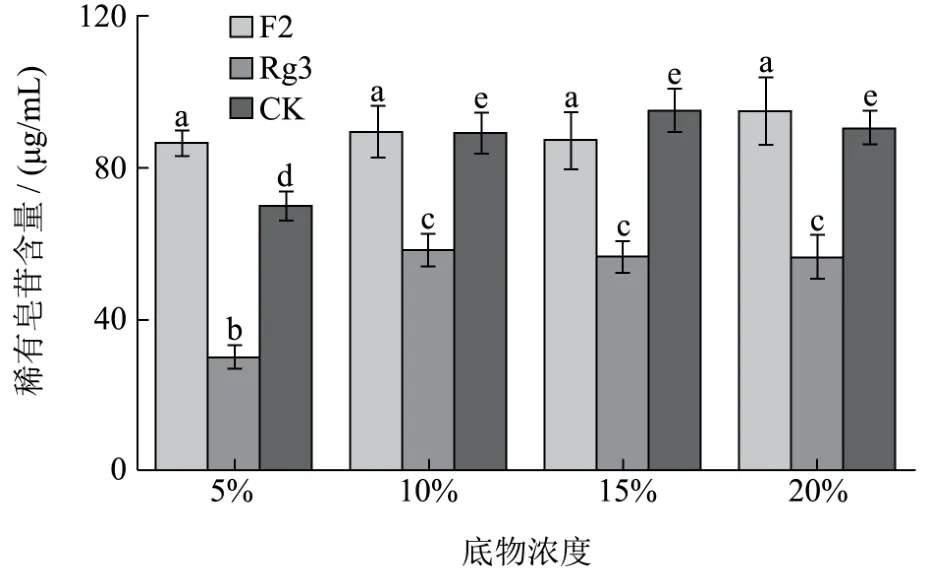
图6 底物浓度对稀有皂苷含量的影响Fig.6 Substrate concentration on the influence of rare ginsenoside contents
通过比较最终发酵液中稀有皂苷的含量来确定最适底物浓度,由图6可知,综合考虑3种稀有皂苷的含量,F2含量无明显差异,Rg3和CK含量在底物浓度为10%时相对较高,随着底物浓度的增加,稀有皂苷的含量基本不变,故选择10%作为最佳发酵底物浓度。
2.5 最佳发酵工艺验证实验
根据工艺优化实验结果,可确定植物乳杆菌发酵人参提取物生成稀有皂苷的工艺条件为:发酵时间16 d、初始pH 6、初始底物浓度10%、接种量10%。依据此发酵条件对人参进行发酵,人参提取物经植物乳杆菌发酵后,其发酵产物中3种稀有人参皂苷的含量分别可达到106.52 μg/mL(F2)、74.62 μg/mL(Rg3)和100.56 μg/mL(CK)。根据文献报道,植物乳杆菌、副干酪乳杆菌、发酵乳杆菌对人参皂苷皆有转化作用,但不同亚种转化的种类与含量皆不相同[14~16]。大部分文献报道都是对单一普通皂苷如Rb1等的转化效率进行研究[7]。付建国等[17]研究了人参固态微生物发酵转化人参皂苷,其研究表明发酵后烘干人参中CK含量有0.2%;陈贺等[18]研究人参固体发酵,最终CK含量为0.11 mg/g。这两位研究者对人参进行固态发酵,考察发酵后的人参中CK的含量。杨艳文等[19]报道了人参饮料生脉饮和人参健脾丸中F2、Rg3、CK,的含量,其中生脉饮中F2、Rg3、CK,的含量分别为0.056%、0、0;人参健脾丸中F2、Rg3、CK,含量分别为0、0.18%、0.26%。对比现有人参产品中的稀有皂苷含量,人参提取物经植物乳杆菌发酵后,发酵液中F2(0.106 mg/g)虽然没有人参饮料中的含量高,但发酵液中含有稀有皂苷Rg3和CK,含量可达到0.074 mg/g和0.100 5 mg/g。发酵液还能够进行进一步浓缩,使得F2含量能够进一步提高而达到现有人参饮料的水平。人参健脾丸中Rg3和CK含量较发酵液中两种稀有皂苷含量高,一方面人参健脾丸为固态产品;另一方面本研究发酵液含有人参健脾丸不含有的稀有皂苷F2,因此本研究的人参发酵液用于人参产品的开发具有一定的优势。
2.6 植物乳杆菌发酵过程中人参皂苷生物转化途经分析
本研究中HPLC方法检测了人参提取物发酵前后9种人参皂苷含量的变化,结果见表4。由表4可以得出,发酵后Rg1、Re、Rb1和Rb2含量分别降低18.27%、47.3%、23.21%、和18.2%,Rd含量则基本保持不变。Rh1、F2、Rg3和CK分别增加58.12%、188.13%、203.21%和395.86%。常见皂苷向稀有皂苷的转化是通过糖苷键的断裂进而去糖基化发生的,从结构上分析,涉及本实验中检测到的6种常见人参皂苷的可能转化途径有以下5种:Rb1→CK;Re→CK;Rb1→Rh1;Re→Rh1;Rb1→Rd→F2→Rg3→CK。这几种转化路径与发酵过程种这几种皂苷含量的变化是一致的。Re和Rb1可通过去糖基化转化为Rh1和F2、Rg3和CK,因此前者含量降低,后者含量升高,而Rd是Rb1向稀有皂苷转化的中间产物,因此其含量基本保持不变。通过转化途径的分析,再次证实发酵过程中常见皂苷向稀有皂苷的转化,因此表明微生物发酵是人参皂苷转化的一种重要途径。
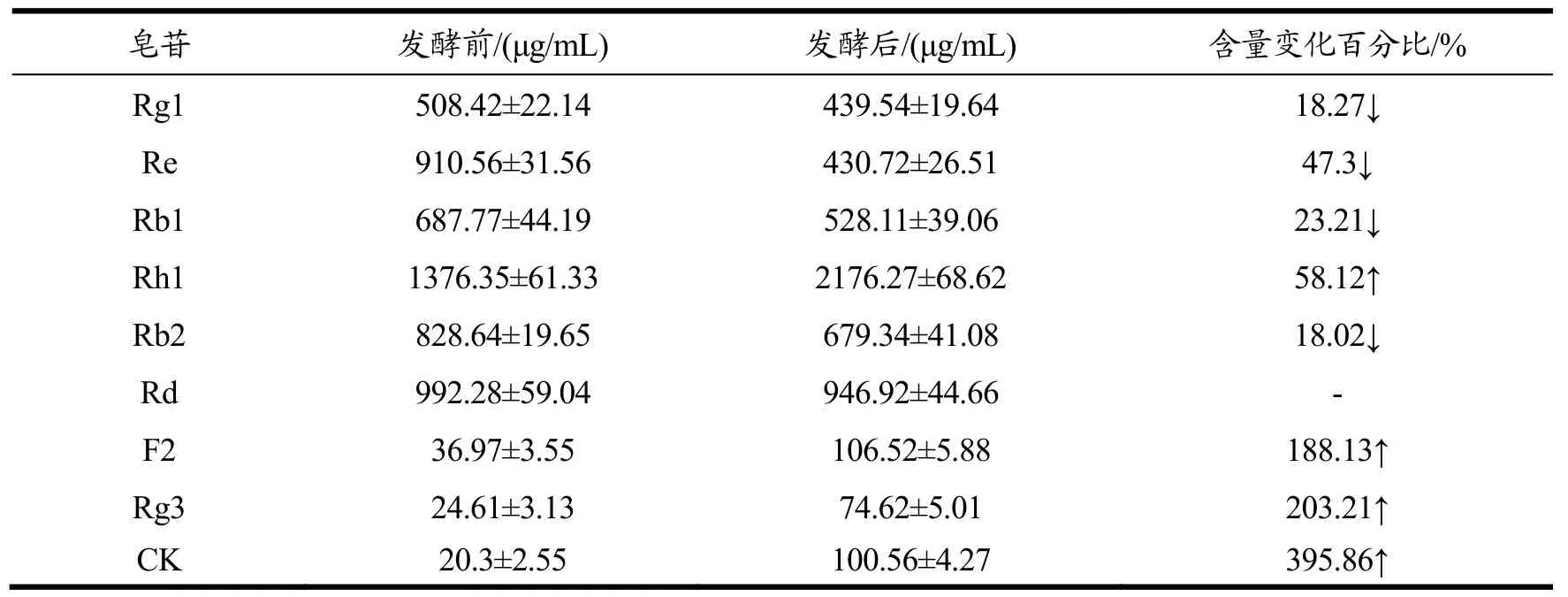
表4 发酵后各皂苷含量(μg/mL)Table 4 Contents of each ginsenosideafter fermentation with Lactobacillus (μg/mL)
3 结论
本研究用乳酸菌对人参提取物进行发酵,得到的发酵液中含有稀有皂苷F2、Rg3和CK,通过菌种筛选和工艺优化,从植物乳杆菌、嗜酸乳杆菌、干酪乳杆菌、副干酪乳杆菌和发酵乳杆菌中确定植物乳杆菌为最适发酵菌种,确定最适发酵条件为发酵时间16 d、初始pH 6、初始底物浓度10%、接种量10%。用该发酵条件进行人参提取物的转化,得到稀有皂苷含量为106.52 μg/mL(F2)、74.62 μg/mL(Rg3)和 100.56 μg/mL(CK)。植物乳杆菌为人体益生菌,人参是名贵中药,植物乳杆菌发酵后的人参提取物同时兼具发酵菌株与发酵底物的生理活性与功效,用于人参产品的开发具有一定的优势,为人参品的深加工奠定基础。

