IL-33在肿瘤中的研究进展
亓 璐, 苗玉辉, 肖卫华, 方 芳
(中国科学技术大学 生命科学院 免疫学研究所, 合肥 230027; 中科院天然免疫与慢性疾病重点实验室, 合肥 230027; 合肥微尺度国家实验室, 合肥 230027)
1 IL-33概况
IL-33属于IL-1细胞因子超家族。它的编码基因由8个外显子组成[1],其中1到3号外显子编码了IL-33的N端结构域,包含一个核定位所必须的螺旋转角螺旋序列。5到8号外显子编码了一个IL-1样的细胞因子结构域——β-三叶折叠,这一区域可以与IL-33的特异性受体ST2结合[2]。
作为一个双功能因子,IL-33既具有转录因子活性也具有细胞因子活性。作为转录因子,全长的IL-33(pro-IL-33)依赖其N端的核定位序列转运到细胞核,发挥转录抑制的作用,例如,IL-33通过结合NF-κB的p65亚基的启动子区域,抑制其转录表达,从而抑制NF-κB通路的活化[3]。而作为细胞因子时,不同于IL-1家族的其他成员,全长的IL-33(pro-IL-33)也具有细胞因子活性。炎症发生时,包括中性粒细胞组织蛋白酶G、中性粒细胞弹性蛋白酶和肥大细胞丝氨酸蛋白酶等在内的炎性蛋白酶,可剪切IL-33核定位区,产生成熟的IL-33(Mature IL-33, Mtr-IL-33),提高其生物活性10~30倍[4]。但是细胞凋亡时,细胞释放的caspase-3和caspase-7剪切会使IL-33失活[2]。
IL-33的受体ST2也具有多种形式,主要包括膜受体ST2L和可溶性的sST2,另外还有ST2的变形体ST2V和ST2LV。其中ST2L是全长的蛋白,包含胞外免疫球蛋白样结构域、跨膜结构域和胞内TIR结构域。IL-33与ST2L结合可以诱导含有TIR结构域的IL-1RAcP与ST2L的TIR结构域二聚化,并招募信号转导蛋白MyD88,进而活化IRAK-1、IRAK-4、TRAF6等IL-1R相关激酶,活化下游MAPK和NF-κB等信号通路。sST2为ST2L的胞外段,仅包含与IL-33结合的结构域,不具有跨膜和TIR结构域,可以作为诱饵受体结合游离的IL-33,抑制IL-33/ST2信号的活化。而对于ST2V和ST2LV的功能目前仍所知甚少[5]。
IL-33主要由内皮细胞和上皮细胞产生,在组织损伤时释放,活化的巨噬细胞和树突状细胞也可以产生一定水平的IL-33[5]。IL-33的受体ST2广泛表达在多种免疫细胞上,如嗜酸性粒细胞、NK细胞、Th2细胞、B细胞、肥大细胞等。IL-33在II型免疫反应、维持稳态、组织损伤修复、炎症和感染以及肿瘤免疫中都发挥着重要的作用[1-2,6]。目前IL-33在肿瘤免疫中的作用仍存在争议,本文通过进一步的整理和分析已有的研究结果,对IL-33在肿瘤中发挥不同的原因进行了总结。
2 IL-33对不同肿瘤的作用
对目前Pubmed可检索到的相关文章整理发现,不同类型肿瘤中,IL-33表达水平对肿瘤进程的影响表现出明显的不一致性(表1)。多数肿瘤中IL-33表达水平升高(包括血清和肿瘤组织),并与肿瘤进程呈正相关。
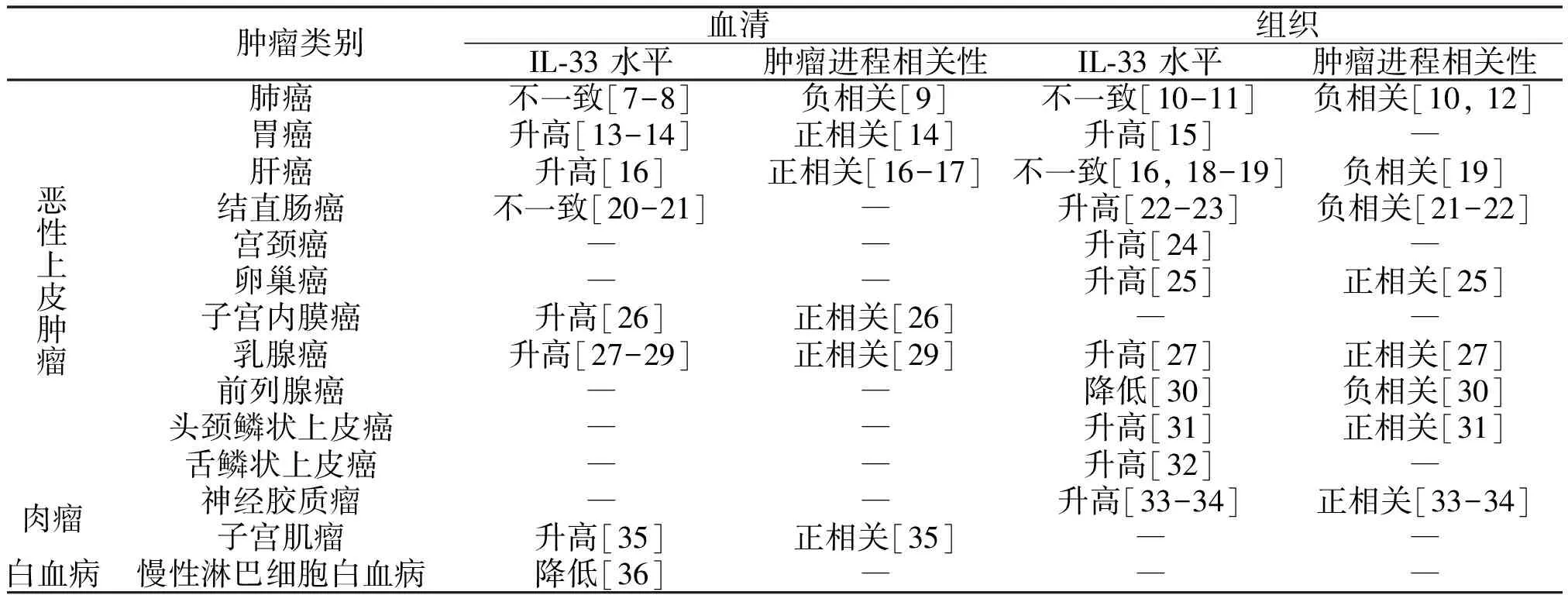
表1 不同肿瘤病人中IL-33表达及与疾病进展的相关性
注:“―”为暂时没有研究报道;“不一致”为报道结果不一致;括号内标注参考文献编号
2.1 恶性上皮肿瘤
美国国家癌症研究所公布数据显示,上皮组织来源的恶性上皮肿瘤占所有癌症病例的80%至90%[37],目前IL-33在肿瘤中作用的研究大部分都集中在这类肿瘤上。IL-33的水平与多种恶性上皮肿瘤的疾病进展之间存在明显的相关性,但在不同组织起源的肿瘤中,IL-33发挥了截然不同的作用。
2.1.1 肺癌
目前的研究关于肺癌病人体内IL-33水平与正常人相比是否有差异,仍然没有定论[7-8],同样的,肺癌组织中,IL-33表达水平是否有别于正常组织也存在争议[10-11]。但在肺癌病人中,随着肿瘤发展,IL-33水平会逐渐下降。Kim等人报道TNM分级I期的肺癌病人血清中IL-33的表达水平高于正常人,但III/IV期病人血清IL-33的表达水平显著低于正常人[9];一致地,Akimoto等人发现肺癌病人肿瘤组织中IL-33的基因表达水平随着患者癌症临床分级的升高而逐渐下降[12];另外,最新的研究也表明,肺癌组织中IL-33的mRNA水平与肿瘤的分化程度正相关,也提示着其与肺癌临床进展之间存在一定的相关性[10]。Yang[10]、Akimoto[12]等人通过对TCGA数据库和PrognoScan数据库分析,发现IL-33高表达的肺癌病人具有更长的总生存期和无复发生存期,这也与肺癌晚期患者体内IL-33水平更低是一致的。这些研究共同提示着IL-33可能发挥了抑制肺癌发展的作用。
2.1.2 胃癌
胃癌病人血清中IL-33的水平明显高于正常人[13-14],肿瘤组织局部IL-33的表达水平也明显高于正常组织[15]。并且,胃癌病人血清中IL-33水平会随肿瘤临床分级的升高而增加[14]。病人血清中的IL-33水平,也与其总生存期存在明显的负相关性[14]。化疗后的胃癌病人血清中IL-33水平会出现不同程度的下降,该下降程度大小也与病人无进展生存期正相关[13]。这些结果提示IL-33可能会促进胃癌的进展。
2.1.3 肝癌
肝癌病人血清中IL-33水平高于正常人[16],但肝癌组织局部IL-33表达水平是否与正常组织有差异,仍然存在争议[16, 18-19]。晚期肝癌病人[17]和转移性肝癌病人血清IL-33水平明显高于早期肝癌病人或肺转移性肝癌[16-17],提示着系统性分布的IL-33与疾病进展之间存在明显的正相关性,也有报道表明肝癌组织局部IL-33水平与肿瘤组织学分级存在负相关[19]。肝癌组织中IL-33表达水平的升高似乎与病人延长的生存期具有一定的联系[18],同时,血清sST2水平的升高也会导致病人生存期下降[17],sST2被认为能阻碍IL-33发挥细胞因子的功能,这些结果提示着IL-33可能发挥了抑制肝癌发展的作用。只有收集和分析更多的患者样品,才有可能解决肝癌病人中IL-33表达水平以及随疾病进展的变化趋势的争议。
2.1.4 结直肠癌
结直肠癌病人血清中IL-33水平与正常人是否有差异仍存在争议[20-21],但肿瘤部位IL-33的表达水平显著高于正常组织[22-23],利用自发结直肠癌的ApcMin/+小鼠模型也证明小鼠结直肠癌组织局部IL-33水平升高[22]。并且,肿瘤组织局部的IL-33水平似乎随疾病进展而逐渐降低[21-22],但血清中IL-33水平进展的相关性仍需更多的研究。虽然部分研究认为结直肠癌病人总生存期与IL-33水平之间并没有明显的相关性[20],但是在转移性结直肠癌中,高水平的IL-33与病人累积生存期的缩短存在明显的联系[23]。在小鼠结直肠癌模型中,IL-33通过增加巨噬细胞的瘤内浸润、促进其向M2极化以及促进血管生成,发挥促进肿瘤发生发展的作用[22-23],但也有研究认为IL-33缺失会影响B细胞对肠道共生菌的调节,从而导致结直肠癌发生增加[38]。IL-33在结直肠癌发生发展以及不同发展阶段中发挥怎样的作用,仍然需要更多的研究。
2.1.5 宫颈癌、卵巢癌、子宫内膜癌及乳腺癌
在宫颈癌病人、卵巢癌病人、子宫内膜癌病人和乳腺癌病人中,IL-33水平显著高于正常人或正常组织[24, 26-29]。并且,在卵巢癌病人和乳腺癌病人中,IL-33的水平与肿瘤发展进程及转移正相关[25,29];在子宫内膜癌病人中,IL-33水平与肿瘤等级、入侵深度、淋巴结转移以及远端转移正相关[26]。IL-33水平与宫颈癌病人、卵巢癌病人和乳腺癌病人的生存期均存在明显的负相关性[24-25],这些结果共同提示着,IL-33可能发挥着促进宫颈癌、卵巢癌、子宫内膜癌及乳腺癌发展的作用。
2.1.6 前列腺癌
原发性前列腺癌组织中IL-33水平明显低于正常前列腺组织,并且随着疾病进展而降低。在小鼠的前列腺癌模型以及病人体内,强转移性的前列腺癌中IL-33水平均显著低于非转移性前列腺癌[30]。IL-33表达水平与前列腺癌病人的无复发生存期正相关[30],提示IL-33发挥了抑制前列腺癌发展的作用。
2.1.7 鳞状上皮癌
IL-33在鳞状上皮癌,包括头颈鳞状上皮癌[31]和舌鳞状上皮癌[32]病人的肿瘤组织中表达明显高于正常水平。而IL-33的高表达预示着更差的预后,与更短的生存期有关[16, 32]。提示IL-33可以促进鳞状上皮癌的发展。
2.2 肉瘤
胶质瘤病人肿瘤组织中IL-33水平明显高于正常的脑组织,并且IL-33水平与胶质瘤的疾病等级正相关[33-34]。在胶质瘤中,IL-33的表达水平与病人的总生存期和无进展生存期负相关[34],并且IL-33可以在体外直接促进胶质瘤细胞表达MMP2和MMP9,提高细胞的侵袭和迁移能力[33],发挥促进其生长和转移的作用。另一种常见的肉瘤子宫肌瘤中,病人血清中IL-33水平也显著高于正常人,血清IL-33的浓度与肌瘤的大小、重量和数量均存在明显的正相关性[35],提示着IL-33可能发挥了促进子宫肌瘤发展的作用。已有的这些报道共同表明,IL-33对肉瘤的发展发挥着明显的促进作用。
2.3 白血病
慢性淋巴细胞白血病病人血清中IL-33的水平低于正常人,并且IL-33水平与慢性B淋巴细胞白血病的典型标志CD20的表达负相关[39],提示IL-33可能对肿瘤的发展发挥抑制作用。在利用C1498细胞系构建的小鼠急性髓系白血病模型中,重组IL-33给药会促进小鼠体内树突状细胞的活化,并增加白血病反应性的CD8+T细胞的扩增和IFN-γ的产生,从而抑制肿瘤的进展,延长小鼠寿命[40]。这些结果提示IL-33可能发挥了抑制白血病发展的作用。
3 IL-33对肿瘤发展不同阶段的作用
IL-33在多种肿瘤中表达水平会随着肿瘤病人的疾病进展发生变化[9, 12, 14, 19-20, 22, 25-26, 28, 33-34, 39, 41],提示IL-33的作用可能随疾病的进展发生改变。在小鼠乳腺癌模型中,肿瘤直径在4 mm左右时,IL-33表现出促进肿瘤发展的作用[42],但是在直径达到20 mm时,IL-33却表现出明显地抑制肿瘤生长的作用[43],提示IL-33在肿瘤发展的不同阶段可能通过不同的机制发挥了迥异的作用。揭示IL-33在肿瘤进程不同阶段发挥不同作用的机制有助于推动IL-33在临床诊断和治疗中的应用,因此,我们对肿瘤发展的不同阶段中IL-33发挥作用的机制进行了归纳。
3.1 IL-33与慢性炎症的相关性
慢性炎症与癌症发生之间存在着密切的联系[44],IL-33在多种炎症中都有较高水平的表达[28, 38, 45],参与了炎症发生和维持。在特发性肉芽肿性乳腺炎[28]、溃疡性结肠炎[38]和胰腺炎[45]病人血清中存在明显高于正常水平的IL-33,并且IL-33促进了这些炎症的发展,这些炎症与相关肿瘤的发展存在密切的联系,提示着IL-33可能在癌症发生的起始阶段发挥重要的促进作用。一致地,最近的研究表明,在小鼠结肠炎模型和胆管炎模型中,IL-33促进了IL-6的产生和释放,加剧炎症的发展,进而促进结直肠癌[22]和胆管癌[46]的发生。另外,在小鼠胆管癌模型中,IL-33还可以通过活化ILC2细胞促进炎症相关的组织损伤修复,诱发胆管癌[47]。这些研究提示,IL-33在慢性炎症的发生和发展中扮演了促进炎症相关肿瘤发生的重要作用。
3.2 IL-33在肿瘤发生发展早期的作用
在肺癌[9, 12]、肝癌[19]、结直肠癌[20, 22]、宫颈癌[39]、乳腺癌[28]和唾液腺瘤[41]等多种肿瘤发展的早期阶段,IL-33可以通过直接[15, 22-23, 31, 33]或间接[22-23, 38, 48]的方式促进肿瘤的发展。
肿瘤发展早期,IL-33可以直接作用于肿瘤细胞促进肿瘤的发展。多种肿瘤细胞,包括一些肺癌[12]、胃癌[15]、结肠癌[22-23]和神经胶质瘤细胞[33]上都有IL-33受体ST2的表达,IL-33激活ST2受体,能诱导上皮间质转化[31],促进肿瘤发生;同时,IL-33作用能促进肿瘤细胞NAND6、NOTCH3、OCT316等基因的表达[23],增加肿瘤细胞干性;IL-33同样能提高肿瘤细胞膜上葡萄糖转运蛋白(GLUT1)的水平,增加肿瘤对葡萄糖的摄取[12],促进肿瘤细胞的生长;IL-33介导的ST2激活还会进一步活化细胞内MAPK/Erk信号通路和NF-κB信号通路,增加MMP3、MMP2和MMP9的表达[15, 33],促进肿瘤细胞的转移。
另一方面,IL-33还参与早期肿瘤微环境的构建,调节肿瘤的发展。在小鼠结肠癌和鳞状上皮癌模型中,肿瘤局部的IL-33通过招募和活化巨噬细胞[22-23]、MDSC[22]、Treg[48]等免疫抑制细胞,抑制CD8+T细胞功能[48],从而构建了抑制性的早期肿瘤微环境,促进肿瘤免疫逃逸;另外,IL-33作用于肿瘤基质细胞,促进血管生成[22],从而维持肿瘤更好地发展。
最近的研究表明,IL-33通过调节肠道共生菌影响了肿瘤的发生发展。在DSS/AOM诱导的小鼠结肠癌模型中,小鼠体内IL-33缺失会造成B细胞产生lgA减少,影响肠道共生菌的稳态,肠道共生菌群的失衡会进一步导致肠道局部IL-1α水平升高,从而促进结直肠癌的发生[38]。
这些研究共同提示着,IL-33在肿瘤发生发展的早期阶段,通过直接影响肿瘤细胞特性、塑造早期免疫抑制性肿瘤微环境以及调节肠道共生菌稳态,发挥了关键地促进肿瘤发生发展的作用。
3.3 IL-33在肿瘤发展后期的作用
病理晚期的肿瘤表现为分化程度降低、缺乏免疫原性、难以被免疫系统识别、以及转移增多。IL-33通过多种机制影响了肿瘤晚期的发展和转移。
在小鼠肿瘤模型中,与高转移性肿瘤相比,低转移性的肺癌[12, 30]、前列腺癌细胞[12]能产生更高水平的IL-33,高水平的IL-33能促进肿瘤细胞上MHC I分子和肿瘤抗原的表达,提高肿瘤的免疫原性,从而增加CD8+T细胞对肿瘤的杀伤[30];另外,IL-33也可以促进ILC2、CD4+T细胞、嗜中性粒细胞以及嗜酸性粒细胞在肿瘤部位的浸润,逆转肿瘤局部的免疫抑制性微环境[30, 49],从而促进肿瘤的免疫原性死亡;在肿瘤生长后期,局部营养缺乏的情况下,IL-33通过活化MAPK/p38和MAPK/JUK信号通路,促进肿瘤细胞的凋亡[12];在临床样品中,转移性的肝癌病人体内IL-33水平与IFN-γ水平存在更为显著的正相关性[16]。这些结果提示在肿瘤发展的后期阶段,IL-33会增加肿瘤的免疫原性,促进免疫细胞对肿瘤的杀伤,发挥肿瘤抑制作用。
4 IL-33在肿瘤微环境和系统性免疫调节中发挥不同的作用
肿瘤微环境的特殊条件,使得肿瘤免疫与系统性免疫之间存在诸多差异[50]。在临床研究中,肺癌、肝癌、唾液腺癌和结直肠癌等病人肿瘤组织局部的IL-33水平与血清中IL-33水平存在明显的差异[7, 10, 16, 19-21,41,51],提示着IL-33在肿瘤微环境和循环系统中的分布存在差异。肝癌、唾液腺癌和非小细胞肺癌病人血清中较高的IL-33水平与不良预后有关[7, 17,51],提示系统性的IL-33可能会促进肿瘤的发展。然而肿瘤组织中IL-33高表达与病人生存期的延长相关[10, 12, 16,41,52]。最近的研究表明,在软组织肉瘤中,肿瘤组织中的IL-33水平与趋化因子CCL5、CD8+T细胞特征基因以及IFN-γ的表达正相关,与趋化因子CCL20和CXCL5以及Tregs和MDSC的特征基因以及TGF-β的表达负相关,提示肿瘤微环境中的IL-33能够抑制肿瘤的发展[52]。这些结果共同提示肿瘤微环境中IL-33与系统性分布的IL-33可能对肿瘤的发展发挥相反的调节作用。
在小鼠4T1乳腺癌模型中,ST2缺陷小鼠体内肿瘤发展明显受到抑制[27],但是在4T1中过表达IL-33反而抑制了肿瘤的发展[43]。这种差异可能是ST2缺陷导致小鼠系统性的IL-33作用丧失,从而影响了IL-33对免疫抑制性细胞(G-MDSC)招募和分化[27],提示着系统性分布的IL-33发挥了肿瘤促进的作用,此外在其他小鼠肿瘤模型中也发现系统性的IL-33可以招募活化Treg以及M2型巨噬细胞促进肿瘤的发展[11,53];过表达IL-33的4T1细胞,会引起小鼠肿瘤局部IL-33水平升高,从而促进肿瘤微环境中杀伤性的CD8+T细胞和NK细胞的招募及活化,抑制肿瘤的生长[43]。同样地,肿瘤过表达产生的IL-33也可以通过招募活化ILC2[49,54]、中性粒细胞[30]、树突状细胞[49]等方式抑制肿瘤的发展。
这些结果提示,肿瘤微环境中的IL-33和系统性的IL-33对肿瘤的影响可能存在不同的机制。但是想要阐明IL-33作用存在这种区域特异性的原因,还需要更为详尽地分类研究,才能揭示特定环境下IL-33作用机制的差异。充分地理解IL-33作用机制的差异是发挥其临床指导和治疗价值的前提。
5 总结
近年来,IL-33在肿瘤发生发展中的作用越来越多地被关注,但IL-33对肿瘤进展的影响及作用机制仍然存在较大的争议。通过总结已有的研究,我们发现,IL-33的作用与肿瘤起源类型、肿瘤临床进展阶段以及IL-33在机体中的分布均有密切的联系。
感染及慢性炎症是IL-33释放的主要因素[1],同样,多种肿瘤发生发展的早期,病人体内的IL-33水平均有升高[9,21-22]。而肿瘤的发生与慢性炎症有着密切的联系[55],IL-33作为IL-1家族的典型炎症因子,可能通过增加炎症促进了肿瘤的发生发展;在肿瘤发展的中后期,会形成免疫抑制性的肿瘤微环境,这种微环境使得其中的大量免疫细胞丧失了原有的免疫活性[56]。而近年来的研究表明,IL-33除了作为炎症因子,还能够恢复肿瘤微环境中多种免疫细胞的功能[30,57],从而抑制肿瘤的发展。一致的,在一些免疫原性较低,对于免疫疗法响应性较差的肿瘤,如乳腺癌,胶质瘤,卵巢癌病人中[58-59],IL-33与较差的预后相关,提示着它主要发挥着促进炎症的作用;而在一些免疫原性较高,对于免疫疗法响应性较好的肿瘤,如肺癌,结肠癌,黑色素瘤病人中[59],IL-33与良好的预后有关,说明IL-33此时主要发挥了免疫刺激作用。IL-33促进炎症发展的功能与其免疫刺激功能之间的平衡,可能决定了在不同环境下IL-33对肿瘤发生发展的最终影响(图1)。要充分地阐释其中的机理,还需要开展更为详尽、细致以及精准的研究。
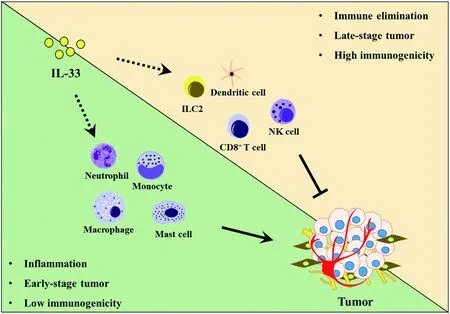
图1 IL-33介导的炎症与免疫清除的平衡对肿瘤发生发展的影响Fig 1 A balancing act between inflammation and immune elimination elicited by IL-33 dictates tumor progression
注:肿瘤发生的早期阶段或者低免疫原性的肿瘤中,IL-33主要通过增加炎症促进肿瘤的发生发展;肿瘤发展的晚期阶段或者高免疫原性的肿瘤中IL-33主要刺激免疫细胞活化,抑制了肿瘤的发展。IL-33发挥的这两种不同作用之间的平衡最终决定了肿瘤发展的命运
IL-33对于肿瘤发生发展影响的广泛性决定了它成为多数肿瘤诊断和治疗中不可忽视的因素。详细地阐述IL-33在不同肿瘤起源类型、肿瘤临床进展阶段和不同体内分布的条件下的作用及其机制,有助于推进IL-33在临床诊断及治疗中的应用,并且对其他肿瘤相关因子的研究具有重要的启发意义。

