巴里坤卤虫不同发育时期肠道菌群结构分析
茹文红,郑晓婷,段亚飞,董宏标,刘青松,张家松
(1.中国水产科学研究院南海水产研究所,农业部南海渔业资源开发利用重点实验室,广州 510300;2.上海海洋大学水产与生命学院,上海 201306)
卤虫(Artemia),又称盐水丰年虫,隶属于节肢动物门(Arthropoda),有鳃亚门(Branchiata),甲壳纲(Crustacea),鳃足亚纲(Branchiopoda),盐水丰年虫科(Branchinectidae)。卤虫分布范围极其广泛,在世界许多碳酸盐和硫酸盐的自然湖泊和人工盐池中均有分布[1]。卤虫的发育一般经历5个阶段:卵(egg)、无节幼虫期(nauplius stage)、后无节幼虫期(metanauplius stage)、拟成虫期(pseudo adult stage)和成虫期(adult stage)。无节幼虫期是指蜕皮0~1次的幼虫,其身体不分节且经历一次蜕皮后消化道明显可见,呈筒状;后无节幼虫期是指蜕皮2~5次的幼虫,其胸部开始分节,消化道开始具备生理功能;拟成虫期是指蜕皮6~10次的幼虫,其外形与成体相似[2]。
卤虫具有营养丰富、个体小、生长周期短、繁殖速度快和易于在实验室培养等优点,被广泛用于水产饵料[3]、生物载体[4]、发育生物学[5-6]、免疫学[7-9]和毒理学[10-11]等领域研究。目前,国内外对卤虫的研究主要集中在卤虫基础生物学方面,如分类、卵特性、生长发育、繁殖习性以及在水产饵料中的应用等,而有关卤虫不同发育时期肠道菌群结构的研究报道较少。
动物肠道是消化吸收的主要场所,其中栖息着数量庞大的微生物,形成了一个复杂和相对稳定的微生态系统。肠道微生物能够影响动物生长、消化吸收及健康[12]。研究表明,凡纳滨对虾(Litopenaeus vannamei)肠道内分离出的枯草芽孢杆菌(Bacillus subtilis)能分泌多种胞外消化酶[13];鮸鱼(Miichthysmiiuy)肠道内分离出的不动杆菌属(Acinetobacter)对有机质有较强分解能力[14];草鱼(Ctenopharyngodon idellus)肠道内检测到的拟杆菌属(Bacteroides)能够为肠黏膜提供能量,可以促进肠黏膜的修复和生长[15]。因此,本研究以室内养殖的巴里坤卤虫(Artemia parthenogenetica)为研究对象,采用Illumina MiSep高通量测序技术研究无节幼虫期、后无节幼虫期、拟成虫期和成虫期4个时期肠道菌群结构,旨在为初步探究肠道菌群对卤虫不同发育时期个体生长、蜕皮、免疫等影响提供理论参考。
1 材料与方法
1.1 供试材料
卤虫的休眠卵采自于西藏巴里坤湖(购于天津丰年水产养殖有限公司)。螺旋藻为科晶牌螺旋藻粉(购于天津丰年水产养殖有限公司),用之前高温灭菌半小时[16],再以灭过菌的人工海水制成悬浊液,现配现用。养殖期间所用的人工海水为海水晶(广州市海神水族科技服务公司)与蒸馏水以3∶100比例混合配制,经100目筛绢网过滤后,高压灭菌的人工海水(盐度30,pH值8.3)。
1.2 卤虫的孵化与培养
卤虫卵的消毒参照BARUAH[17]的方法并稍加修改进行。取卤虫卵400 mg,用蒸馏水浸泡并曝气1 h。加入32%氢氧化钠660μL和50%次氯酸钠50 mL进行消毒100 s,然后加入10 g·L-1硫代硫酸钠14 mL,孵育2 min。最后用人工海水洗涤至无色。将消毒脱壳的卤虫卵放入盛有60 mL人工海水的培养瓶中孵化24 h。孵化期间温度30℃,盐度30,pH 8.3,光照强度2 000 lx,使用0.22μm空气过滤器过滤曝气。整个孵化过程置于超净工作台中进行,孵化设置3个平行组。
将每个平行组孵化出来的卤虫无节幼虫分别放于盛有800 mL人工海水的培养瓶中进行养殖,密度为4尾·mL-1(养殖与孵化条件一致)。每2 d换水一次,每次换水1/2。每天投喂饵料一次,投喂量为 8 mg·L-1[18-19]。整个培养过程置于超净工作台中进行。
1.3 样品采集与处理
1.3.1 样品的采集
分别在无节幼虫期(S1,24 h)、后无节幼虫期(S2,48 h)、拟成虫期(S3,144 h)、成虫期(S4,264 h)采集卤虫个体300、300、200、100尾。采集的样品经过处理后可用于肠道菌群测定,参照VERNER-JEFFREYS[20]和 NIU[21]的方法并稍加改进,具体操作为:无菌的条件下,利用卤虫的趋光性,用灭菌的吸管吸取卤虫个体,置于150目的网筛中,用灭菌海水冲洗3次;然后,在无菌的2 mL EP管中均质化,用于提取卤虫肠道菌群DNA。
1.3.2 DNA提取和16S rDNA宏基因组测序
利用EZNA®Stool DNA Kit试剂盒提取卤虫肠道菌群DNA。然后用1%的琼脂糖凝胶电泳进行检测,检测到清晰的 DNA条带。用 Thermo Scientific微量核酸检测仪NC2000检测DNA的质量,得到 OD260/280=1.99~2.00,符合 Illumina Misep测序要求。使用带有测序条形码标签的引物 515F(GTGCCAGCMGCCGCGGTAA)和 806R(CCGTCAATTCMTTTRAGTTT)对细菌的 16S rDNA的V4-V5区进行扩增。
利用Q5®High-Fidelity DNA Polymerase试剂盒进行PCR扩增,反应体系为25μL,包括5×Reaction Buffer 4μL,5×GC Buffer 5μL,2.5 mM dNTP 2μL,10μM(正反引物各 1μL),DNA Template 2μL,ddH2O 8.75μL,Q5High-Fidelity DNA Polymerase 0.25μL。反应程序为:98℃,2 min;(98℃,15 s;55℃,30 s;72℃,30 s)×30个循环;72℃,5 min。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并利用凝胶回收试剂盒(AXYGEN)对目标片段进行切胶回收。利用Quant-iT PicoGreen dsDNA Assay Kit对PCR扩增回收产物进行荧光定量,定量仪器为Microplate reader(BioTek,FLx 800)。根据荧光定量结果,按照各样本的测序量需求进行相应比例混合。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。制备好的文库经过Agilent Bioanalyzer质检和Promega QuantiFluor荧光定量,确定文库合格后,用Illumina MiSeq测序(北京微生太科技有限公司)。
1.4 测序结果处理与分析
1)将Illumina MiSeq高通量测序的原始下机数据根据碱基平均测序准确率进行初步筛查,利用 FLASH(V1.2.7,http://ccb.jhu.edu/software/FLASH/)对每个样品Reads进行配对连接,去除嵌合体等疑问序列;2)使用QIIME软件(Version 1.7.0),调用 UCLUST序列比对工具对获得序列按97%序列相似度进行OTU归并和划分,将丰度值低于全体样本测序总量0.001%(十万分之一)OTU去除,选取每个OTU中丰度最高序列作为该OTU代表序列,然后将每个OTU代表序列与 Greengenes数据库 (Release 13.8,http://greengenes.secondgenome.com/)进行比对,得到OTU各分类等级水平的注释比例和物种相对丰度,为避免由于测序深度不同造成偏差,对各样品数据以数据量最少样品为标准进行均一化处理,根据各样本 OTU数,使用 R软件(Version 2.15.3)绘制 Venn图;3)根据 OTU划分和分类地位鉴定结果,使用 R软件(Version 2.15.3)绘制各分类水平的微生物类群数统计图,使用QIIME软件(Version 1.7.0),获取各样本在门、纲、目、科、属五个分类水平上的组成和丰度分布表,使用SIGMAPLOT 12.5绘制特定样本在特定分类水平组成的柱状图;4)使用 QIIME软件(Version 1.7.0)分别计算每个样本 Simpson多样性指数、Chao1丰富度估计指数、Shannon多样性指数、ACE丰富度估计指数及两种Beta多样性距离(Weighted Unifrac和 Unweighted Unifrac),使用R软件(Version 2.15.3)绘制 Rarefaction稀释曲线和PCoA图;5)所得数据使用SPSS 17.0软件中Duncan多重比较法进行单因素方差分析,以平均值±标准差(X±SD)表示,P<0.05表示差异显著。
2 结果与分析
2.1 Illum ina M iSeq测序结果
12个肠道细菌样品采用Illumina MiSeq测序并优化质控后共得到672 826条有效序列,每个样品平均56 068条,长度主要为392~394 bp,平均为393 bp。卤虫4个不同发育时期的实验组分别获得339~647个不同的OTU。基于97%相似性水平划分OTUs的稀释曲线结果显示,各个样品的序列均达到40 000条以上时,曲线趋于平缓,表明样品的序列测序数量可以有效覆盖文库(图1)。
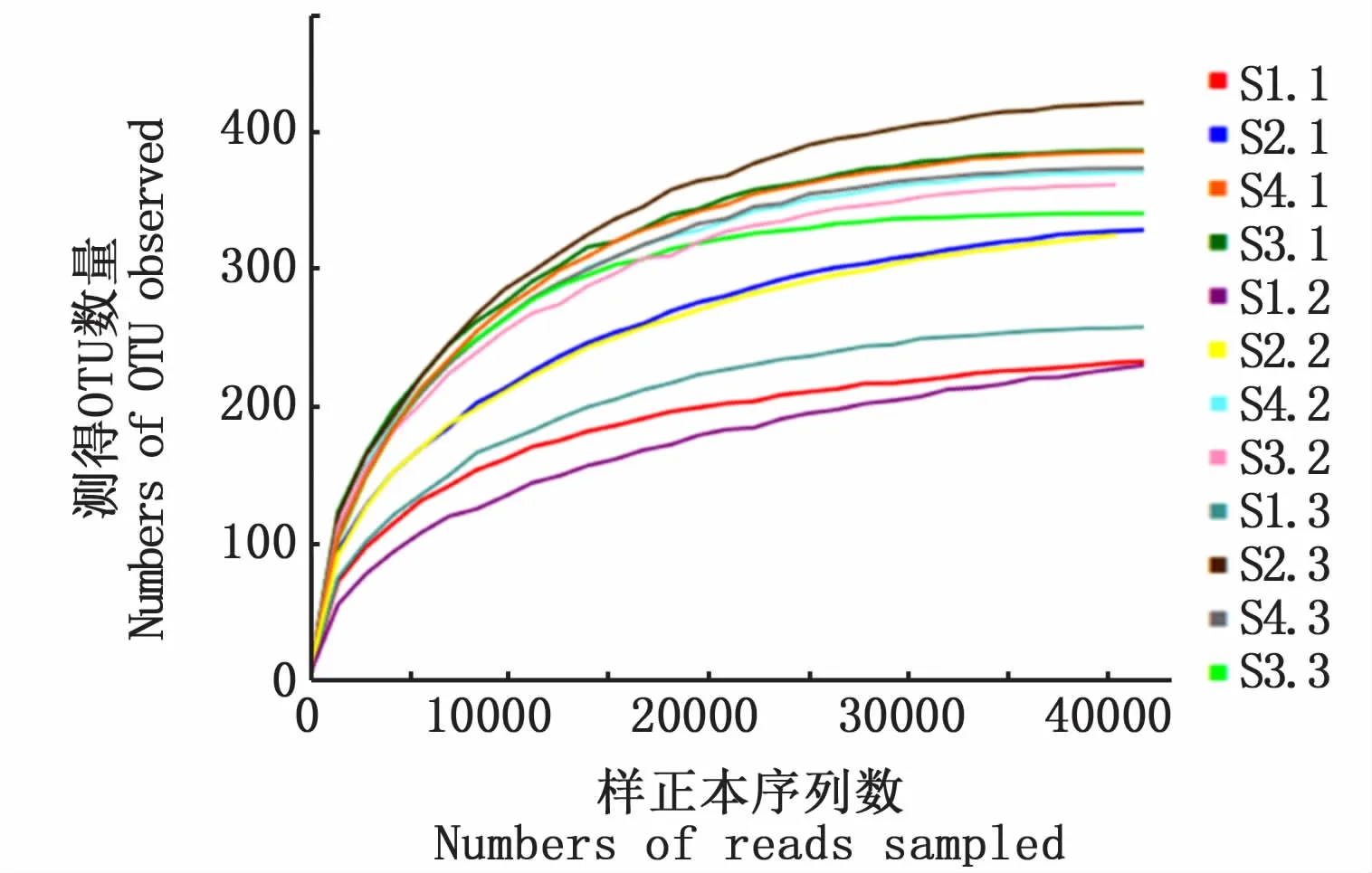
图1 肠道菌群单个样品中OTUs稀释曲线Fig.1 Rarefaction curves for OTUs in each sam ple
2.2 肠道菌群多样性
利用Chao1、ACE、Shannon和Simpson指标评估卤虫不同发育时期肠道菌群的α多样性。结果显示,与S1组相比,S2、S3和S4组的α多样性指数均显著升高(P<0.05),但3组之间不存在显著性差异(P>0.05)(表1)。
基于4组卤虫肠道菌群全部有效OTU数绘制的Venn图(图2)显示,有效OTU共2105个,4组共有OTU169个。其中,S3组特有OTU最多,为83个;其次为S4组、S1组和S2组,分别为82、35和30个。基于weighted和unweighted UniFrac距离的PCoA分析显示,4组卤虫肠道菌群结构存在一定的差异(图3)。
2.3 肠道菌群结构组成变化
在门分类水平上变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)在4组卤虫肠道菌群的相对丰度均达到94%以上,为优势菌群。其中,4组间变形菌门的相对丰度无显著性差异(P>0.05);S1、S2和S3组间厚壁菌门的相对丰度无显著性差异(P>0.05),与 S3组相比,S4组厚壁菌门的相对丰度显著减少(P<0.05)。此外,4组拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)的相对丰度呈显著增加趋势(P<0.05)(图4)。

表1 巴里坤卤虫肠道菌群α多样性指数Tab.1 α-diversity of intestinem icrobiota in Artem ia parthenogenetica

图2 巴里坤卤虫肠道共有OTU分析图Fig.2 Shared OTU analysis of intestinem icrobiota in Artem ia parthenogenetica
在纲分类水平上共有8个菌纲的相对丰度≥ 0. 50% (图 5)。 γ-变 形 菌 纲(Gammaproteobacteria)、 α-变 形 菌 纲(Alphaproteobacteria)及芽孢杆菌纲(Bacilli)为优势菌群。α-变形菌纲在S1组中占绝对优势,相对丰度为51.1%;与S1组对比,其相对丰度在S2、S3和S4组中显著减少(P<0.05)。与 S1组相比,γ-变形菌纲(Gammaproteobacteria)在 S2、S3和S4组中的相对丰度显著增加(P<0.05)。
在属分类水平上共有19个菌属的相对丰度≥0.10% (图 6)。结 果 显 示,副 球 菌 属(Paracoccus)在S1组中的相对丰度占绝对优势,其在S2、S3和 S4组中显著减少(P<0.05)。假单胞杆菌属(Pseudomonas)和交替赤杆菌属(Altererythrobacter)的相对丰度在4组中逐渐增加,而微小杆菌属(Exiguobacterium)的相对丰度呈现先减少后增加再减少的趋势。盐单胞杆菌属(Halomonas)的相对丰度在S1和S2组中无变化(P>0.05),而在 S3组中显著减少(P<0.05)。嗜冷杆菌属(Psychrobacter)的相对丰度在S2和S3组中显著增加(P<0.05),而在S4组中显著减少(P<0.05)。短波单胞菌属(Brevundimonas)的相对丰度在4组间存在显著差异(P<0.05)。对于稀有菌属(Limnobacter)、微杆菌属(Microbacterium)、小红卵菌属(Rhodovulum)和普氏菌属 9(Prevotella9)的相对丰度在4组中逐渐增加,而赤杆菌属(Erythrobacter)和鞘脂菌属(Sphingobium)的相对丰度在4组中逐渐减少。
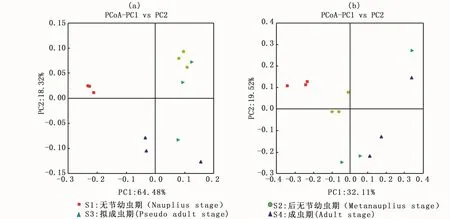
图3 巴里坤卤虫肠道菌群PCoA分析Fig.3 Principal coordinates analysis(PCoA)of the intestinem icrobial communities in different samp les

图4 肠道菌群门水平相对丰度Fig.4 Relative abundance of intestinem icrobiota at the phylum level
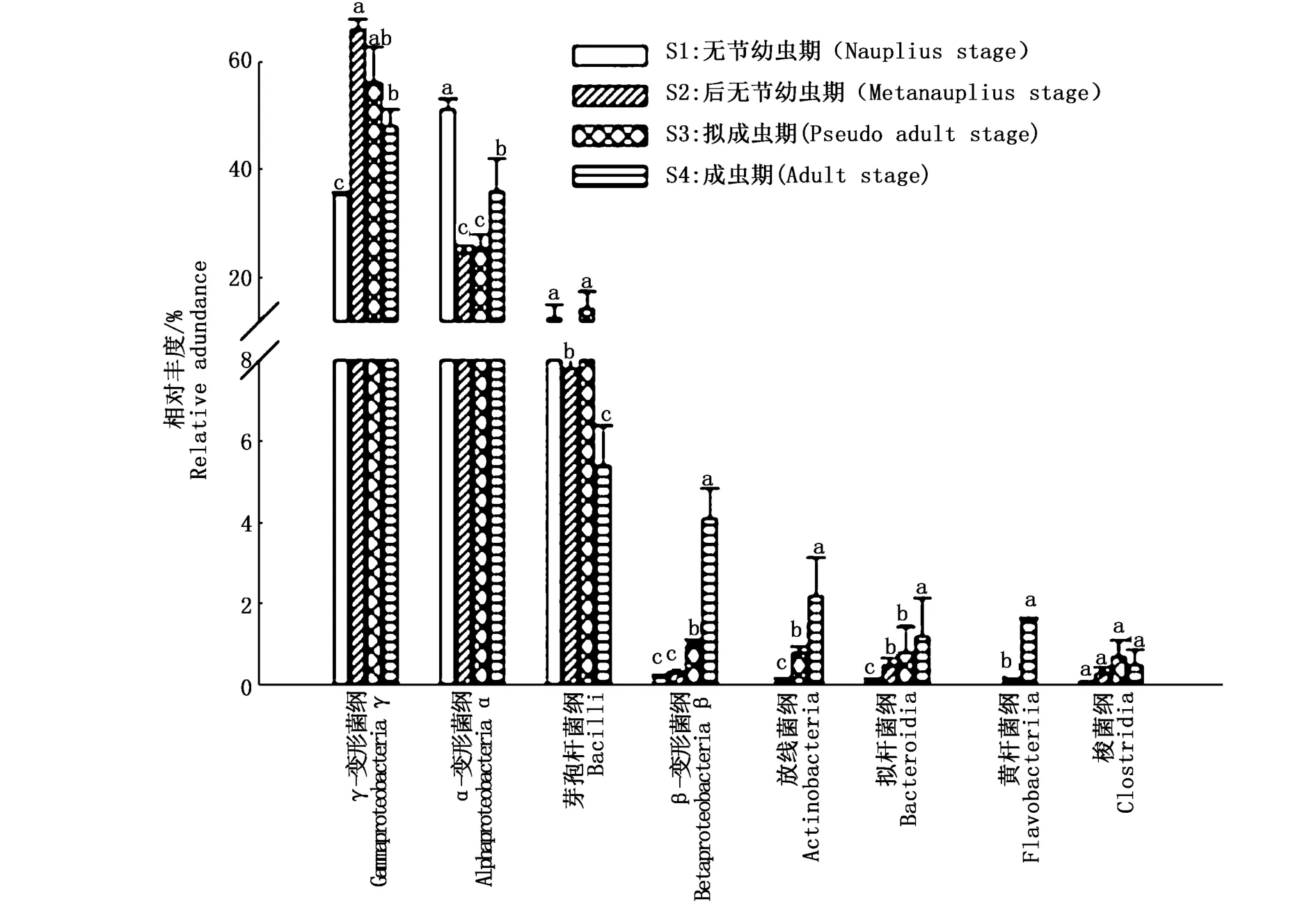
图5 肠道菌群纲水平相对丰度Fig.5 Relative abundance of intestinem icrobiota at the class level

图6 肠道菌群属水平相对丰度Fig.6 Relative abundance of intestinem icrobiota at the genus level
3 讨论
本研究利用Illumina MiSep高通量测序技术,在不同分类水平上对巴里坤卤虫不同发育阶段的肠道菌群组成及变化规律进行了分析。结果表明,卤虫在不同发育时期的肠道菌群组成不断发生变化。从α多样性指数和PCoA图可以看出,随着卤虫的正常发育,其各生长时期的肠道菌群多样性增加,群落结构复杂化,与多佛比目鱼(Solea solea)[22]研究结果一致。CAMPBELL等[22]研究了多佛比目鱼不同发育时期的肠道菌群变化,结果表明,其成鱼期肠道菌群组成比仔鱼期丰富。相关研究表明,动物自身的生长时期及健康状况能够影响其肠道菌群组成[23],其可能是造成卤虫不同发育时期肠道菌群存在差异的主要原因。
随着卤虫的生长发育,拟杆菌门和放线菌门细菌逐渐增加。研究表明,拟杆菌门细菌能够吸收和降解有机物质,降解多种生物聚合物如纤维素和几丁质[24-25]。此外,拟杆菌门细菌还能利用肠道内植物来源的底物发酵产生短链脂肪酸,为宿主肠道提供能量,促进不可消化组分的能量摄入最大化[26]。因此,本研究中拟杆菌门细菌的增加可能与其促进卤虫消化植物性食物有关。放线菌门细菌能够产生次级代谢产物,其中许多是有效的抗生素,能够提高动物的抗病能力[27]。在纲分类水平上,α-变形菌纲细菌为无节幼虫期卤虫肠道优势菌群,其后γ-变形菌纲细菌的相对丰度升高,变为优势菌群,表明卤虫的生长发育期间,其肠道内的优势菌群发生了更替。究其原因,在属分类水平上α-变形菌纲中的副球菌属细菌相对丰度显著减少(P<0.05),而γ-变形菌纲中的假单胞杆菌相对丰度显著增加(P<0.05)。
在属分类水平上,假单胞菌属细菌随卤虫的生长发育进程其相对丰度从0.7%显著增加到24.3%(P<0.05)。研究表明,假单胞菌属为水产动物肠道中常见的菌属[28],其中部分细菌能够有效抑制致病菌。例如,荧光假单胞菌AH2能够抑制鳗弧菌(Vibrio anguillarum)以降低虹鳟(Oncorynchus mykiss)的 死亡 率[29];假 单 胞 菌MCCB102、MCCB103[30]及假单胞菌属 W3[31]能产生抑制性化合物,从而抑制哈维氏弧菌(V.harveyi)及副溶血弧菌(V.parahaemolyticus)等致病菌。此外,部分假单胞菌可以分泌一些酶,促进动物生长。例如,分离于斑节对虾(Penaeus monodon)肠道内的假单胞菌属PM11,可以通过分泌胞外消化酶促进动物消化[32];铜绿假单胞菌K-187可以分泌几丁质酶和蛋白酶,促进甲壳动物蜕皮[33]。本研究中,随着卤虫生长发育的进行,卤虫生长性能较好,推测可能与其肠道假单胞杆菌的增加有关。
微小杆菌CFR26M能分泌胞外蛋白酶利于虾的脱壳及降解[34],且微小杆菌 mexicanum 8N能产生利于消化的蛋白酶,促进卤虫在恶劣的条件下存活和发育[35]。本研究中,随卤虫的生长发育,微小杆菌属的相对丰度呈现先减少后增加再减少的趋势,与卤虫生长发育时期变化一致,推测与卤虫所处发育时期的蜕皮行为有关。生长第1天卤虫样品(S2组)为后无节幼虫期,生长第5天卤虫样品(S3组)为拟成虫期,生长第10天卤虫样品(S4组)为成虫期。卤虫从后无节幼虫期变态发育至拟成虫期,蜕皮间隔时间短,卤虫所受的刺激大;而从拟成虫期变态发育至成虫期,蜕皮间隔时间长,卤虫所受的刺激小。
本研究测定的是室内小规模养的卤虫样品,其肠道菌群与自然条件生长的或大规模培养的卤虫肠道菌群结构可能不同。因为对饵料和培养条件的微生物控制,限制了环境的变化,减少了环境对动物肠道菌群结构的影响[36],放大了遗传对肠道菌群结构的影响,为未来深入研究卤虫遗传特性与其肠道菌群的相关性提供一定的理论依据。
4 小结
综上,卤虫在无节幼虫期、后无节幼虫期、拟成虫期、成虫期4个发育时期的肠道菌群组成发生显著变化,表明卤虫自身的生长发育能够影响其肠道菌群组成,未来将针对卤虫遗传特性与其肠道菌群的相关性进行深入研究,以期解析肠道菌群在卤虫生长、蜕皮和免疫等方面的潜在影响作用。

