基于CdSe@ZnS量子点水溶性纳米粒子的制备及荧光性能
庄庆一, 由芳田, 彭洪尚
(1. 北京交通大学光电子技术研究所 发光与光信息教育部重点实验室, 北京 100044;
1 引 言
量子点,又可称为半导体纳米晶体,自上世纪70年代末起就引起了包括物理学家、材料科学家、化学家和电子工程学家等科研人员的广泛关注。与传统的有机染料相比,量子点具有窄的半峰宽、覆盖可见光-近红外区域的可调发射波长、高的荧光效率和稳定性[1-2],因此在生物医学领域具有重要的意义,如可用于荧光标记、细胞追踪、癌症治疗等[3-6]。
量子点的合成方法主要分为水相合成法与油相合成法。1996年,Meller首次在水相中合成了硫醇稳定的CdTe量子点[7]。水相合成的量子点表面通常含有巯基配体[8-9],因此有利于后续的生物功能化。虽然水相合成的方法简单、毒性小、成本低,量子点具有良好的亲水性和生物兼容性,但其量子效率较低且半峰宽较宽,这极大地限制了其在荧光检测与成像中的应用[10]。相比较而言,在有机溶剂中利用金属有机化学法可制备高发光质量的量子点,这也是迄今为止最成功的方法[11-14]。该方法的机理是利用金属有机化合物前驱体在高温下迅速成核,通过控制体系的反应温度和前驱体的反应量来控制量子点的生长,同时利用油溶性配体对量子点表面的吸附来阻止量子点长大,并稳定量子点。令人遗憾的是,油相合成的量子点无法直接应用于生物标记,需采用配体交换[15-16]或者表面包覆(采用二氧化硅[17-19]、高分子[20]等材料)等方案来提高其水溶性和生物兼容性。配体交换法或者表面包覆法不仅大大增加了制备过程的复杂程度,而且在转到水相后量子点的发光效率会明显降低[21]。因此,发展一种量子点由油溶转水溶、且保持发光性能不发生改变的简易方法,对于推进量子点在生物医学领域中的应用具有重要的意义。
在之前的研究工作中,我们发展了一种基于疏水相互作用及硅氧烷水解缩聚反应来制备水溶性纳米粒子的方法,即再沉淀-包覆法[22]。考虑到量子点为油溶性的特点,这启发我们利用上述方法或许可容易实现对油溶性量子点的溶解性转变。在本文中,我们首先制备了油溶性、核壳结构的CdSe@ZnS量子点,然后利用再沉淀-包覆法将其包覆到水溶性纳米粒子中。所制备的CdSe@ZnS掺杂纳米粒子具有小的粒径(~45 nm)、良好的生物兼容性(表面为多聚赖氨酸壳层,PLL)和高的荧光强度(单个颗粒内包覆数十个量子点)。将其与肿瘤细胞培育,可实现对细胞的多色荧光标记。考虑到所发展的纳米粒子制备方法无需复杂的配体交换和表面修饰步骤,一步即可实现量子点由油相到水相的转变,因此对于量子点的生物医学应用具有积极的推动作用。
2 实 验
2.1 材料与仪器
材料:硬脂酸镉(CdSt2)、硒粉(Se)、三丁基磷(TBP)、正辛胺、己烷、甲醇、十二烷、油胺、硬脂酸锌(ZnSt2)、二乙基二硫代氨基甲酸锌(Zn-(DDTC)2)均购自阿拉丁试剂(上海)有限公司,聚苯乙烯(PS)、多聚赖氨酸(PLL)、十二烷基三甲氧基硅烷(DTS)、四氢呋喃(THF)均购自Sigma-Aldrich。
仪器:采用日立公司型号为JEM 1400EX透射电子显微镜对纳米颗粒进行形貌表征;利用马尔文公司生产的型号为Nano ZS90的激光粒度仪测试纳米颗粒的动态光散射粒径(DLS);荧光分析使用的是日立公司生产的型号为F-4600的荧光光谱仪;荧光衰减采用法国HORIBA Jobin Yvon公司的TCSPC荧光寿命光谱仪测试。
2.2 油溶性CdSe@ZnS量子点的合成
核壳结构CdSe@ZnS量子点的制备采用晶种生长法[23]。以合成红光量子点为例,在50 mL四口瓶中,CdSt2溶液加热到250 ℃,将1.2 mL硒悬浊液快速注入到四口瓶中,控制注入硒悬浊液的量和反应时间使量子点的尺寸达到3 nm(绿光1.2 nm)。在50 ℃的温度条件下,将三丁基磷和正辛胺分别注入到CdSe量子点的反应溶液中搅拌,再将己烷和甲醇混合溶液注入搅拌,完成原位萃取提纯,获得CdSe种子。包覆采用连续离子吸附生长法,取3 mL十二烷、3 mL油胺和提纯过的CdSe溶液混合加入到50 mL四口瓶中,150 ℃下反应。Zn(DDTC)2作为包覆1~6层的前驱体加入,ZnSt2和Zn(DDTC)2作为包覆7~8层的前驱体加入,整个实验过程一直处于氮气保护状态。反应结束后对产物沉淀离心,再分散到THF中。
2.3 CdSe@ZnS掺杂水溶性纳米粒子的制备
分别配置PS(2×10-3)、DTS(2×10-3)和CdSe@ZnS量子点(4×10-4)的THF溶液,然后按照50∶46∶4的质量比取适量体积混合成总浓度为1×10-3的溶液。用移液枪取200L上述混合溶液,在超声条件下迅速注入8 mL去离子水中(pH=9,氨水调节;含有160g PLL)。静置2 h后,通入N2以移除THF,即得到CdSe@ZnS掺杂的水溶性荧光纳米粒子。
2.4 MTT实验
将肝癌细胞(HepG2)均匀接种到96孔板中,每孔5 000个细胞,培养24 h。细胞分为实验组和对照组,在实验组加入不同浓度梯度的荧光纳米粒子溶液,对照组只需加入等量的完全培养基。24 h后,每孔中加入20L的MTT溶液(5 mg/mL溶于PBS中),放入细胞培养箱中培养4 h后,吸走废液,每孔加入0.15 mL的DMSO溶液。避光条件下,将96孔板放入酶联免疫监测仪中振荡10 min,选择490 nm波长,检测每孔中的吸光值。利用公式计算细胞存活率:细胞存活率(100%)=(实验组OD平均值/对照组OD平均值)×100%。
2.5 共聚焦显微镜成像实验
HepG2细胞在35 mm共焦培养皿中培养1天,细胞密度为1×105个,再加入荧光纳米粒子溶液培养24 h,之后用PBS洗涤细胞3次,在激光共聚焦扫描显微镜(Nikon Ti-E 全电动倒置显微镜)下进行荧光成像。G-NPs和R-NPs在405 nm波长下激发,收集波段分别为500~550 nm和580~630 nm。
3 结果与讨论
3.1 CdSe@ZnS量子点的制备与表征
油溶性CdSe@ZnS量子点的制备采用晶种生长法[23],其合成机制是先制备CdSe量子点内核,然后通过调整ZnS包覆层的厚度来调节量子点的发射波长。本论文以发射绿光(G-QDs)和红光的CdSe@ZnS量子点(R-QDs)为例,包覆的ZnS壳层层数分别为6层和8层。所制备绿光G-QDs量子点的发射波长峰值位于529 nm,如图1(a)右下插图所示,红光R-QDs量子点发射波长为610 nm,如图1(b)右下插图所示。 CdSe@ZnS量子点的透射电镜(TEM)照片如图1所示。由图中可以看出,G-QDs量子点的形状基本为球形,粒径约为2.5 nm;而随着包覆层数的增加,R-QDs量子点增大至~4 nm,且形状逐渐偏离圆形。量子点形貌变化是外延生长的一个必然结果,因为随着ZnS层数的增加,壳层的体积占整个量子点体积比逐渐增大,量子点的晶格常数会慢慢趋近体相ZnS水平。

图1 核壳结构CdSe@ZnS量子点的透射电镜照片。(a)G-QDs;(b)R-QDs。量子点的粒径统计见右上插图,THF中的荧光发射光谱见右下插图。
3.2 CdSe@ZnS掺杂水溶性纳米粒子的制备与表征
利用再沉淀-包覆法将CdSe@ZnS掺杂到水溶性纳米粒子中,实现CdSe@ZnS量子点由油溶到水溶的转相[22]。其制备原理是:(1)疏水性物质因为局域环境由非极性到极性的剧变而发生聚集,进而形成纳米粒子;(2)纳米粒子中有机硅氧化在碱性环境中的快速水解和缩聚而在粒子表面形成SiO2壳层;(3)水溶液中带正电的PLL分子与纳米粒子表面负电SiO2壳层的吸引而形成PLL外包覆层。图2(a)为制备的掺杂G-QDs量子点绿光纳米粒子(G-NPs)的TEM照片,经统计得到G-NPs的粒径为50 nm左右,这与动态光散射(DLS)得到的水力学粒径也基本相符(图2(b))。另外,在纳米粒子上可以观察到数目众多的黑色小点。由于纳米粒子的基质主要成分为有机物(PS,DTS和PLL),量子点具有更高的电子密度,因此可以断定其上的黑点即为所掺杂的CdSe@ZnS量子点,即量子点的确掺杂到了水溶性纳米粒子内。纳米基质的保护作用可以大大降低CdSe@ZnS量子点的外泄几率,因此可减小其生物毒性;同时,PLL壳层的包覆使得纳米粒子具有良好的水溶性和生物兼容性,且表面荷正电的氨基有利于纳米粒子通过胞吞作用进入细胞[22]。掺杂R-QDs量子点的红光纳米粒子(R-NPs)具有相同的实验结果,在此不再赘述。

图2 掺杂绿光CdSe@ZnS量子点的纳米粒子(G-NPs)。(a)透射电镜照片,左上插图为粒径统计分布;(b)动态光散射粒径分布。
图3为CdSe@ZnS量子点掺杂到纳米粒子前后的发射光谱。由图中可以看出,量子点在纳米粒子中的发射波长相比于在THF中均发生了红移,移动距离分别为5 nm(G-QDs)和3 nm(R-QDs)。考虑到量子点表面原本吸附有机配体(三丁基膦和油胺),掺杂到PS-DTS为基质的纳米粒子后其周围微环境的介电常数变化较小,因此可以忽略介电限域效应的影响。我们注意到,在纳米粒子内CdSe@ZnS量子点是随机分布的,如图2(a)所示,因此当相互之间距离足够近时则会通过电偶极-电偶极相互作用而产生能量传递。由于量子点本身存在尺寸差异,能量传递的结果是小尺寸量子点(具有短发射波长)将激发能传递给大尺寸的量子点(具有长发射波长),从而使得掺杂纳米粒子的整体发射波长向长波侧移动,即发生红移[24-25]。此外,由图3可以看到CdSe@ZnS量子点在掺杂到水溶性纳米粒子前后的半峰宽保持不变,表明量子点在纳米粒子内以单分散的形式存在,没有发生聚集。这与通过TEM照片观察到的结果也一致。
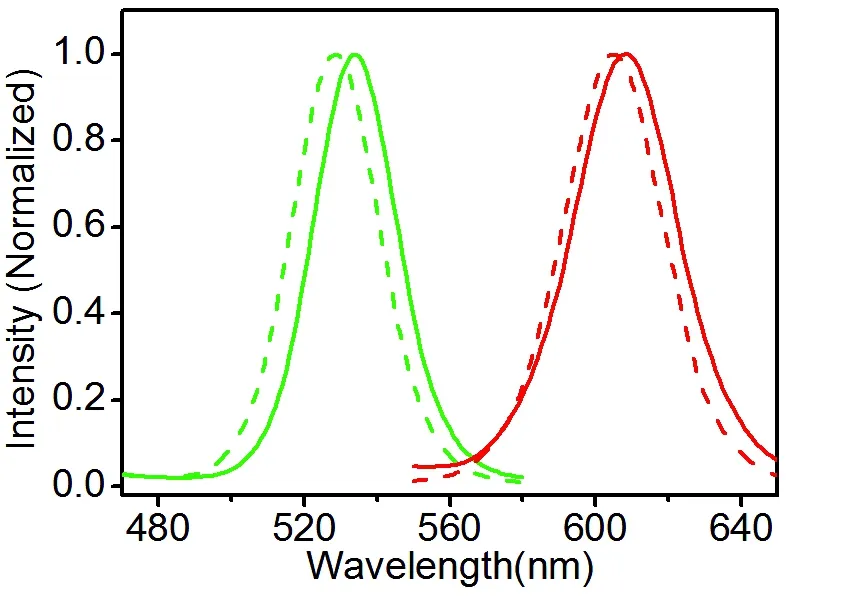
图3 CdSe@ZnS量子点在THF(虚线)和纳米粒子中(实线)的荧光发射光谱。左侧为绿光量子点,右侧为红光量子点,激发波长为365 nm。
为进一步研究CdSe@ZnS量子点在纳米粒子内的发光特性,对绿光和红光量子点掺杂到纳米粒子前后的荧光强度衰减进行了测量,结果如图4所示。可以清楚地看到,量子点在掺杂到纳米粒子后荧光强度的衰减速率均加快。对于THF溶液中量子点的荧光衰减采用双指数函数可得到较好的拟合结果:
I(t)=A1exp(-t/τ1)+A2exp(-t/τ2),
(1)
其中,τ1和τ2分别代表量子点中与本征激发态和表面缺陷态相关的荧光寿命,A1和A2代表不同衰减成分在t=0时的幅度[26]。而对于纳米粒子中量子点的荧光强度衰减,双指数函数无法得到合理的拟合结果,须采用三指数函数进行拟合:
I(t)=A1exp(-t/τ1)+
A2exp(-t/τ2)+A3exp(-t/τ3),
(2)
其中,τ1和τ2具有与公式(1)中相同的物理意义,τ3则认为是与能量传递(量子点浓度)相关的荧光寿命[27],A1、A2和A3分别代表不同衰减成分在t=0时的幅度。荧光强度衰减拟合得到的参数如表1所列,平均寿命τav依据下列公式计算得到:
(3)
分析表中拟合数据可以得到如下结论:量子点在掺杂到纳米粒子后本征态短荧光寿命τ1变化不大,然而表面缺陷态的长寿命τ2却显著变短,并且与能量传递相关的荧光寿命τ3具有最长的寿命。显然,在纳米粒子内的掺杂并没有改变量子点内激子的本征跃迁速率,因此τ1变化较小;纳米粒子内固体基质对量子点表面有机配体的影响则比较明显,可能导致与表面态相关的无辐射弛豫速率增加,从而引起τ2寿命变短;纳米粒子内量子点之间相互能量传递的结果,最终使得激发能或通过本征态或通过表面态辐射(或无辐射)弛豫掉,因此寿命τ3显著慢于τ1和τ2。后两者共同作用的结果使得纳米粒子的荧光强度的衰减要快于量子点的衰减,即τav(NPs)<τav(QDs)。这也与表1中的实验结果相一致。

图4 CdSe@ZnS量子点掺杂到纳米粒子前后的荧光强度衰减。(a)绿光量子点;(b)红光量子点。激发波长为453 nm,监测波长分别为520 nm和609 nm。散点为实验数据,实线为对应的拟合函数。
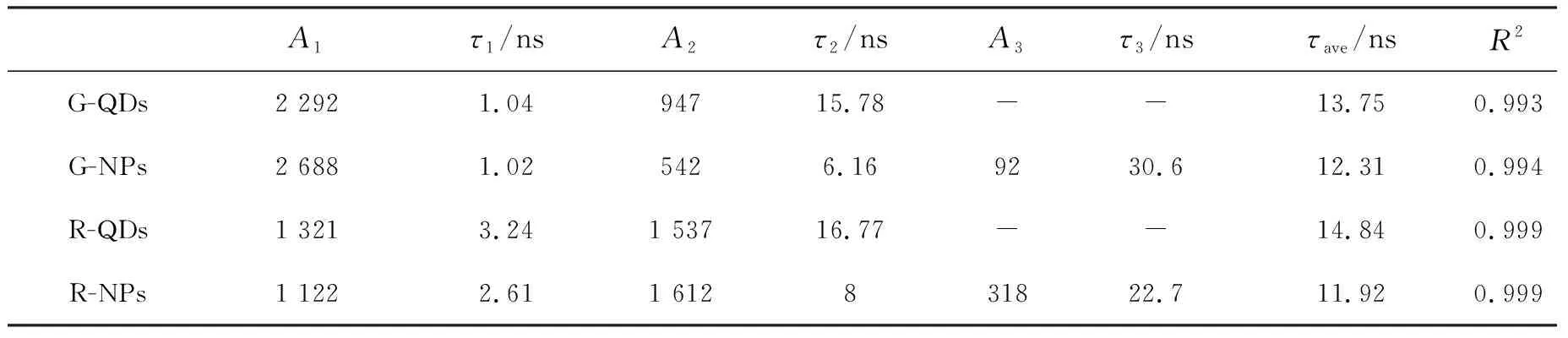
表1 CdSe@ZnS量子点在THF和纳米粒子中荧光衰减的双指数和三指数函数拟合数据结果
3.3 CdSe@ZnS掺杂纳米粒子的细胞毒性与荧光标记
由于CdSe@ZnS掺杂纳米粒子在保持量子点原有光学特性的同时,具有良好的水溶性、稳定性、高的荧光强度(单个粒子内掺杂数目众多的量子点),因此非常有利于进行生物荧光标记。在进行生物标记前首先利用MTT法对纳米粒子的生物毒性进行了测试。MTT测试的原理是利用活细胞线粒体中产生的琥珀酸脱氢酶将MTT还原成不溶于水的甲臜,而死细胞没有该功能。利用DMSO将甲臜溶解,测定它在490 nm波长下的吸光度,通过吸光度来评估细胞的存活率。以红色纳米粒子(R-NPs)为例,由图5(a)所示的MTT测试结果可知,当R-NPs的浓度小于30g/mL时,细胞活性基本不被抑制。这说明PLL包覆的纳米粒子具有良好的生物兼容性,对细胞增殖影响小,从而可以忽略掺杂于其中的量子点的细胞毒性。在后续实验中均采用30g/mL的剂量进行细胞实验。

图5 (a)与不同浓度CdSe@ZnS掺杂纳米粒子(R-NPs)孵育后HepG2细胞的活性,R-NPs的浓度分别为0,10,20,30,40 g/mL;(b)吞噬G-NPs(上)与R-NPs(下)细胞激光共聚焦显微镜照片。共聚焦成像的激发波长405 nm,绿光和红光的成像通道分别为500~550 nm和580~630 nm。
随后对吞噬了纳米粒子的HepG2细胞进行了激光共聚焦扫描成像的研究。分别利用绿光和红光通道成像,可以清楚地观察到细胞内G-NPs和R-NPs纳米粒子的发光,如图5(b)所示。显然,CdSe@ZnS掺杂纳米粒子可以有效地被细胞吞噬。从图中可以看出,纳米粒子随机分布于细胞质以及其他除细胞核之外的细胞器中。这主要是由于纳米粒子带正电的PLL壳层与其他生物分子的非特异性吸附所致。此外,由于纳米粒子尺寸相对较大,在细胞核中观察不到纳米粒子的存在。
4 结 论
本文报道了一种用于生物荧光标记的CdSe@ZnS量子点掺杂水溶性纳米粒子。首先通过高温注入的方法合成了具有优良光学特性的CdSe@ZnS量子点,其在油相中具有高的荧光强度与稳定性。然后采用再沉淀包覆的方法使量子点成功转移到水相中,无需配体交换等繁琐步骤,且能保持量子点原有的光学性能。对量子点掺杂纳米粒子的发光特性进行了研究,发现其发射光谱较掺杂前发生少量红移,且荧光寿命缩短。究其原因,认为主要是量子点之间能量传递的结果。最后对其生物毒性和荧光标记性能进行了研究,证明其具有良好的生物相容性和生物标记能力。该工作提供了一种将油溶性量子点转到水相的简易方法,为拓展量子点在生物标记方面的应用提供了有益的参考。

