近红外到近红外Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子的制备及其生物成像
罗 阳, 廖正芳, 张 伟, 左 芳
(西南民族大学 化学与环境保护工程学院, 四川 成都 610041)
1 引 言
近些年,随着生物医学的不断发展,可视化的生物成像技术在生命医学领域受到了越来越多的关注。对比其他生物成像技术,荧光成像具有价格低廉、快速成像等优点[1]。但是传统的荧光探针材料(如荧光染料、量子点)由于其吸收和发射较宽,Stokes位移小,光稳定性差,化学性质不稳定等,限制了其在生物领域的应用[2-3]。
另一方面,稀土离子上转换荧光纳米材料由于其独特的性质在生物成像领域受到了研究者的关注。该材料可以吸收两个或两个以上的低能量光子而辐射一个高能量光子。此外由于近红外光(700~1 100 nm)处在“生物窗口”范围内,可以避免对生物组织的损伤,减少生物组织的自发荧光,并提高其组织穿透力[4]。而Yb3+/Tm3+掺杂的NaYF4纳米材料可将近红外光(980 nm)转变为近红外光((800±10) nm),具有强的组织穿透力,因而受到了广泛的关注[5-6]。另有相关报道指出,通过掺杂过渡金属Mn2+来调节NaYF4∶Yb3+/Er3+纳米粒子从六方晶相,转变为纯立方晶相,实现相的转变[7]。
此外,可用于生物成像的上转换荧光纳米材料要满足以下几个条件:具有水溶性,并具有一定的生物兼容性。在本工作中,我们首先采用水热法合成了油酸修饰的Mn2+掺杂NaYF∶Yb3+/Tm3+纳米粒子,并将两亲性配体(C18PMH-mPEG)修饰到纳米粒子表面从而得到具有水溶性的纳米粒子[8-9]。最后,通过细胞毒性实验评价了水性修饰后Mn2+掺杂NaYF∶Yb3+/Tm3+纳米粒子的生物相容性,并在小鼠体内进行了近红外生物成像。
2 实 验
2.1 试剂与仪器
实验中使用的试剂主要有:油酸(OA,质量分数98%),分析纯(AR),天津市致远化学试剂厂;氢氧化钠(NaOH),分析纯(AR),天津市北方天医化学试剂厂;无水乙醇(CH3CH2OH,质量分数99.7%),分析纯(AR),成都海兴化工试剂厂;硝酸镱(Yb(NO3)3·5H2O),硝酸钇(Y(NO3)3·6H2O),硝酸铥(Tm(NO3)3),均为分析纯(AR),成都贝斯特试剂有限公司;氟化钠(NaF),分析纯(AR),成都市科龙化工试剂厂;氯仿(质量分数99%),分析纯(AR),成都市科龙化工试剂厂;二氯甲烷(CH2Cl2,质量分数99.5%),分析纯(AR),天津市富宇精细化工有限公司;三乙胺(TEA),分析纯(AR),成都市科龙化工试剂厂;聚(马来酸酐-alt-1-十八碳烯)(C18PMH),Sigma-Aldrich Co.LLC.(USA);甲氧基聚乙醇胺(mPEG-NH2),上海阿拉丁生化科技有限公司;1-乙基-(3-(二甲基氨基)丙基)碳二亚胺盐酸盐(EDC·HCl),成都贝斯特试剂有限公司;透析袋MD36(MW:8 000~14 000),Biosharp公司;实验用水为二次蒸馏水。
实验中使用的仪器主要有:TECNAI F20 透射电子显微镜(TEM); ZETASIZERNANO ZS90动态光散射(DLS)仪,英国MALVERN公司;XD-6型X射线衍射仪(XRD),北京普析通用仪器有限公司;FLUOROLOG-3型荧光分光光度计;PERKIN-ELMER1700傅里叶变换红外光谱仪(FTIR)。
2.2 实验方法
2.2.1 油酸修饰的Mn2+掺杂NaYF4∶Yb3+/ Tm3+纳米粒子的合成
采用水热法合成油酸修饰的Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子[7,10]。称取0.99 g NaOH溶于33.3 mL无水乙醇中,将溶液倒入架好装置的三口烧瓶中,再加入16.65 mL OA和5 mL H2O进行搅拌。搅拌均匀后,分别量取3.32 mL Y(NO3)3·6H2O溶液(0.5 mol/L)、3 mL Yb(NO3)3·5H2O溶液(0.2 mol/L)、0.33 mL Tm(NO3)3溶液(0.2 mol/L)、2 mL MnCl2·4H2O溶液(0.5 mol/L),混合后加入上述三口烧瓶中。再将2.41 mol/L NaF溶液缓慢加到三口烧瓶中,之后搅拌30 min。最后将反应液移入聚四氟乙烯反应釜中,将反应釜放入烘箱中200 ℃下反应8 h。反应结束后冷却至室温,离心分离,将底部固体产物用无水乙醇和水(V(乙醇)∶V(水)=1∶1)洗涤几遍,干燥后即得油酸修饰的Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子样品(OA-UCNPs)。
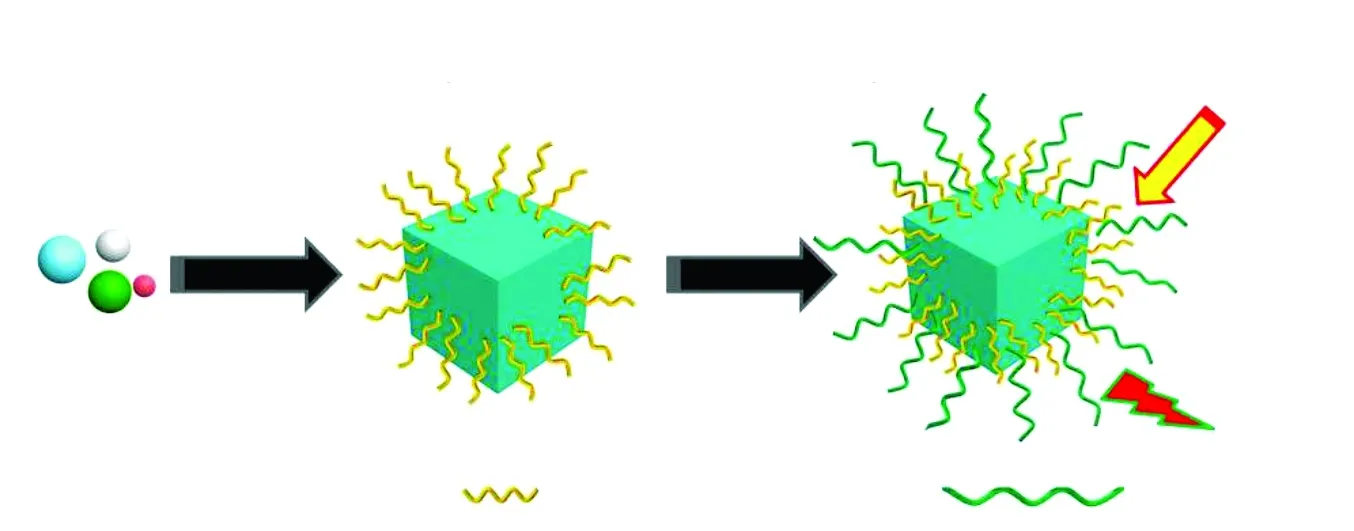
图1 C18PMH-mPEG修饰的Mn2+掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子的制备流程图
2.2.2 Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子的表面改性
本文参照此前的工作合成两亲性聚合物C18PMH-mPEG[8]。称取 50 mg C18PMH- mPEG和50 mg OA-UCNPs溶于25 mL 氯仿中室温下搅拌2 h。之后旋转蒸发掉氯仿,将所得到的白色固体产物分散于15 mL去离子水中,0.22 μm 膜过滤器过滤,然后将获得水溶性C18PMH-mPEG修饰的Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子(mPEG-UCNPs),并室温储存。
2.2.3 MTT实验
细胞存活率用典型的MTT法增值实验检测[11-12]。收集对数期生长的HeLa细胞,离心洗涤。稀释HeLa细胞至106/mL接种96孔细胞培养板,每孔含细胞约5×104个,继续培养10 h。加入含有不同浓度的mPEG-UCNPs培养基溶液,与HeLa细胞共同孵育培养24 h后,酶标仪器测定490 nm波长的吸光度,MTT法确定各个孔的细胞存活率。
2.2.4 生物成像实验
首先,100 μL mPEG-UCNPs(0.5 mg/mL)水溶液皮内注射到裸鼠皮下组织。用两个外部可调的连续980 nm激光器(0~5 W)(Shanghai Connet Fiber Optics Co., China)作为激发光源,然后用一个Andor DU897 EMCCD相机作为信号采集器。最后利用柯达分子成像软件对荧光信号的图像进行分析。
3 结果与讨论
3.1 Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子的透射电镜及粒径分布表征
Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子在水性修饰前后的透射电镜照片(TEM)如图2所示。图2(a)为油酸修饰的Mn2+掺杂 NaYF4∶Yb3+/Tm3+纳米粒子分散于氯仿中的TEM图,从图中可以看出OA-UCNPs具有较好的分散性,形貌为立方形。从粒径分布图2(c)中可以看出OA-UCNPs粒径分布较窄,水合力学粒径约为39.35 nm。图2(b)为水溶性mPEG-UCNPs的TEM图,图中可以看出纳米粒子经过修饰后仍然保持了原有的形貌及较好的分散性,说明C18PMH-mPEG包覆的纳米粒子具有较高的稳定性。从粒径分布图2(d)中可以看出它们的水合力学粒径约为41.54 nm。
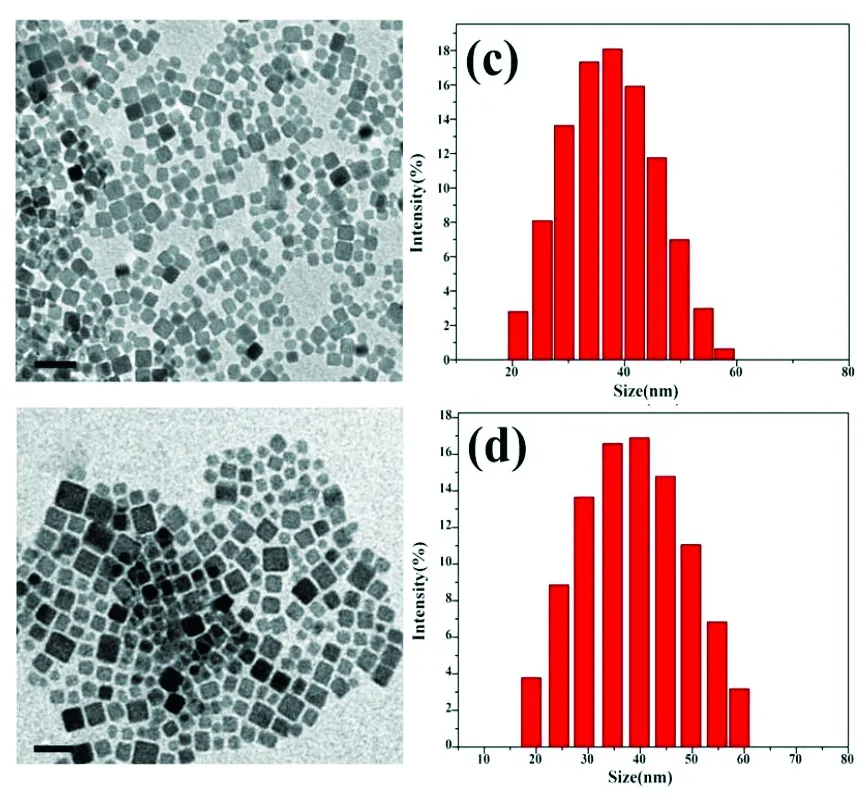
图2 油酸修饰(a)及C18PMH-mPEG修饰(b)的Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子TEM图和DLS图
3.2 Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子的XRD衍射图谱分析
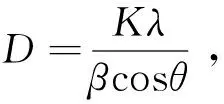
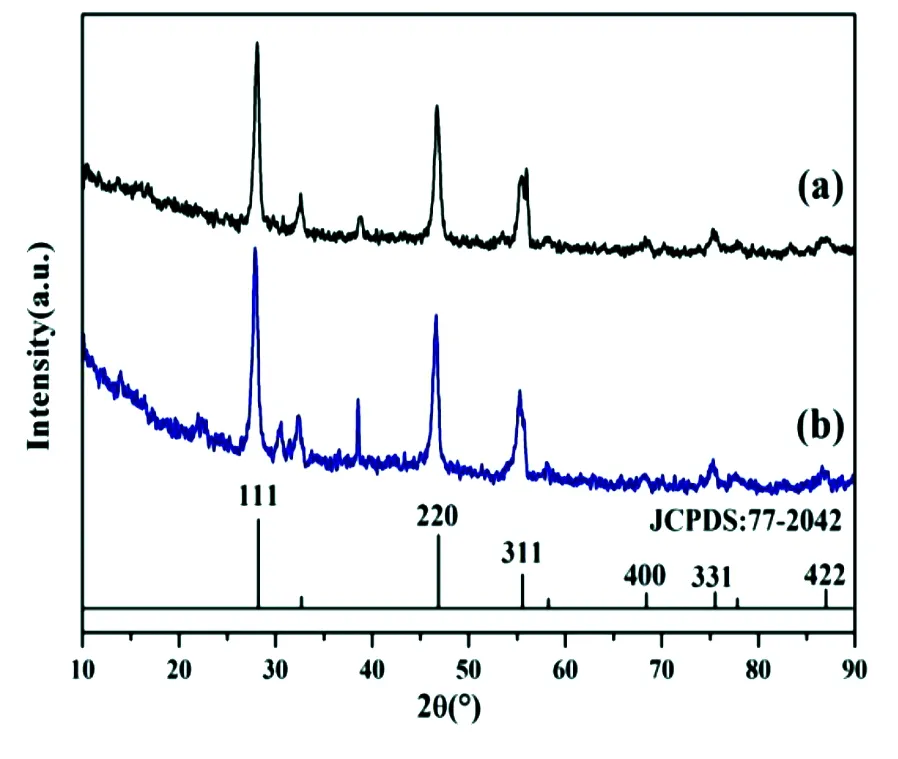
图3 油酸修饰(a)及C18PMH-mPEG修饰(b)的 Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子的XRD图
3.3 Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子的FTIR光谱分析

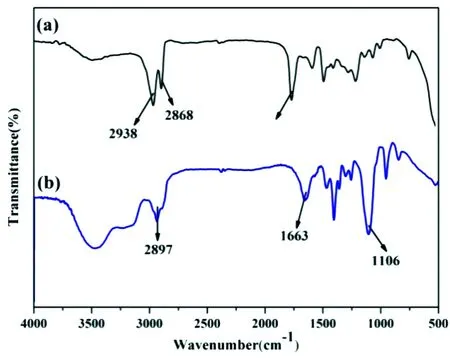
图4 油酸修饰(a)及C18PMH-mPEG修饰(b)的Mn2+ 掺杂 NaYF4 ∶Yb3+/Tm3+ 纳米粒子的红外光谱图
3.4 Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子的荧光光谱分析
Mn2+掺杂 NaYF4∶Yb3+/Tm3+纳米粒子由于其发光性质稳定,在生物医学领域可以用于生物荧光分析和生物成像,因此必须要保证其水性化后发光性质不受mPEG影响。图5为Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子在980 nm近红外光激发下所得的荧光光谱图。从图5(a)中可以看出,油酸修饰的Mn2+掺杂 NaYF4∶Yb3+/Tm3+纳米粒子在(800±10) nm处发出很强的近红外光波长(3H4→3H6),与没有掺杂Mn2+的NaYF4∶Yb3+/Tm3+纳米粒子(图5(c))相比较,其荧光强度明显增加,表明掺杂Mn2+可以明显增强NaYF4∶Yb3+/Tm3+纳米粒子的荧光强度,这与相关文献所报道的结果一致[15]。而经过两亲性聚合物修饰后,从图5(b)可以看到mPEG-UCNPs仍保持着原有的发光位置,发射峰没有移动,但是整体荧光强度比水性修饰前要低,荧光强度降低了1/2左右,可能的原因是由于水分子存在所导致的猝灭效应[16]。
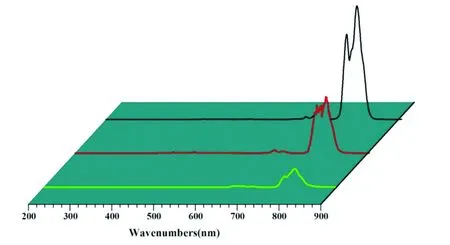
图5 油酸修饰(a)、C18PMH-mPEG修饰(b)的Mn2+ 掺杂 NaYF4 ∶Yb3+/Tm3+ 纳米粒子及油酸修饰NaYF4∶Yb3+/Tm3+ 纳米粒子(c)的荧光光谱图。
图6为Mn2+掺杂 NaYF4∶Yb3+/Tm3+纳米粒子在980 nm 激发下的能量传递过程。Yb3+离子吸收980 nm 激发能并通过能量传递使邻近的Tm3+离子跃迁到激发态3H5、3F2、1G4和1D2能级上,而Tm3+的激发态1G4和1D2和处于激发态(4T1)的Mn2+之间发生无辐射能量转移, 随后Mn2+又将能量传递给Tm3+的激发态3F2,激发态3F2先返回到低能级的激发态1H4,随后无辐射弛豫返回基态3H6从而使得纳米粒子的荧光强度增大。

图6 Mn2+掺杂NaYF4 ∶Yb3+/Tm3+ 纳米粒子的980 nm 激发上转换发光过程能级图
3.5 C18PMH-mPEG修饰的Mn2+掺杂NaYF4 ∶Yb3+/Tm3+纳米粒子的细胞毒性
两亲性聚合物C18PMH-mPEG除了用来改善Mn2+掺杂 NaYF4∶Yb3+/Tm3+纳米粒子的水溶性外,还进一步赋予了纳米粒子在生物领域方面的应用潜力。本文中我们调查了mPEG-UCNPs的生物相容性。从图7中可以看到,我们将不同浓度的mPEG-UCNPs(0.062 5~0.5 mg/mL)与Hela细胞共同培养24 h后,mPEG-UCNPs展现了良好的生物相容性,即使在最高浓度为0.5 mg/mL时,细胞的存活率也达到了89%左右。这使得mPEG-UCNPs在应用于生物领域方面具备了一定的前提条件。
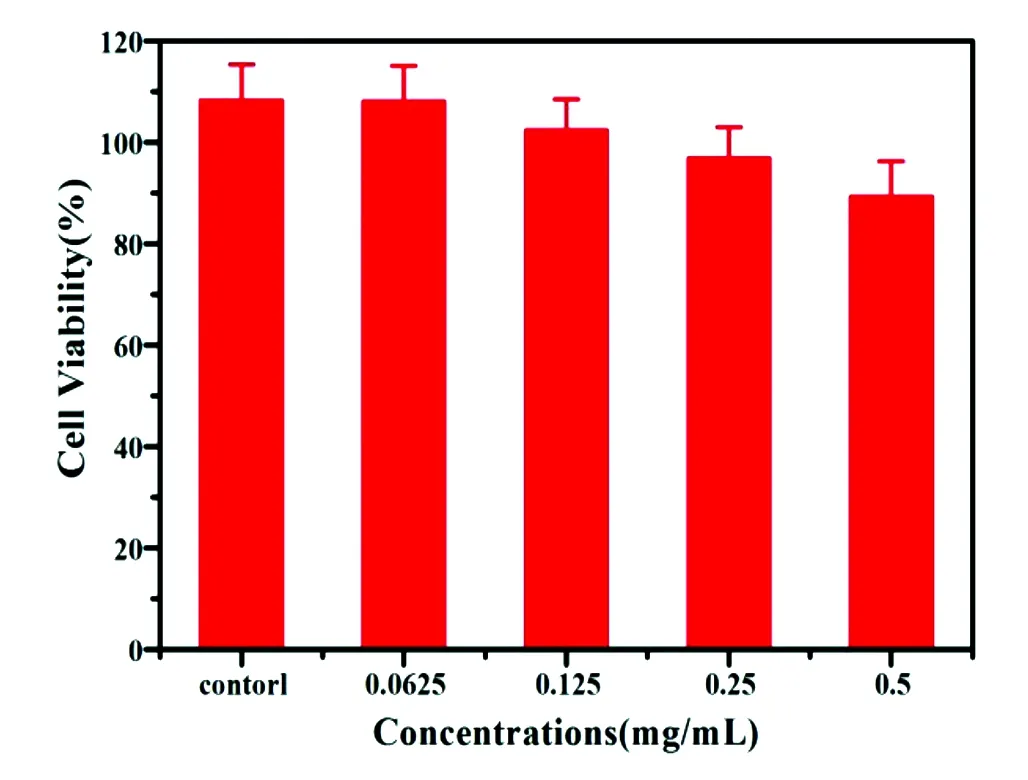
图7 C18PMH-mPEG修饰的Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+ 纳米粒子的细胞毒性
3.6 C18PMH-mPEG修饰的Mn2+ 掺杂 NaYF4 ∶Yb3+/Tm3+纳米粒子的生物成像
接下来,我们考察mPEG-UCNPs在近红外光下的生物荧光成像能力,首先将100 μL 0.5 mg/mL mPEG-UCNPs皮下注射到一个被麻醉的5周龄老鼠(雄) 腹部进行生物成像。如图8所示,生物荧光成像照片用EMCCD相机在注射部位采集(800±10) nm近红外发射信号得到,此外,近红外成像信号的信噪比达到了~38,在同等强度的荧光条件下,相比于(660±10) nm波长的红光,(800±10) nm 波长的近红外光对于生物组织具有更强的穿透力,其抗干扰能力更强[17-18],所以在生物体内进行荧光成像更具有优势。
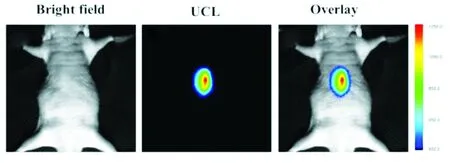
图8 C18PMH-mPEG修饰的Mn2+ 掺杂NaYF4 ∶Yb3+/Tm3+ 纳米粒子的生物成像
4 结 论
本文采用水热法合成近红外到近红外的Mn2+掺杂NaYF4∶Yb3+/Tm3+上转换荧光纳米粒子,XRD结果表明样品为立方相(α-NaYF4)结构。 TEM照片显示水性化前后的纳米粒子都具有较好的分散性。然后在980 nm近红外光源激发下,在(800±10) nm附近得到了强的近红外光发射(3H4→3H6)。并对水性修饰后的Mn2+掺杂NaYF4∶Yb3+/Tm3+纳米粒子进行了实验,结果表明所制得的纳米粒子具有良好的生物相容性。然后进一步在小鼠体内进行了近红外荧光成像,较高的信噪比表明其在生物成像领域将具有一定的应用前景。

