1-氯-3-丁烯-2-醇对人胚肝L02细胞中内源性H2S的抑制效应
张 芳,张新宇
(上海大学环境与化学工程学院环境污染与健康研究所,上海200444)
1-氯-3-丁烯-2-醇(1-chloro-2-hydroxy-3-butene,CHB)是1,3-丁二烯的代谢产物[1].1,3-丁二烯是一种主要来源于汽车尾气和生物质不完全燃烧(如香烟烟雾)的环境污染物,在2008年被国际癌研究局(International Agency for Research on Cancer,IARC)分级为人类致癌物(Group 1)[2].已有多项研究结果显示,1,3-丁二烯属于致癌风险最高的环境污染物之一,其致癌风险在某些情形下甚至超过了苯[3-5].因此,对1,3-丁二烯毒性机理进行研究具有重要的现实意义.
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,剧毒,也是一种环境污染物.H2S在低百万分浓度(10×10−6∼100×10−6)时会对呼吸道及眼睛产生刺激作用,在高百万分浓度(530×10−6∼1 000×10−6)时会对中枢神经系统产生强烈刺激作用,引起呼吸停止甚至死亡[6].同时,H2S是继NO和CO后被识别出的第3种气体第二信使分子,具有极其广泛的生理功能,几乎涉及到了哺乳动物体内所有的生理过程,并对心血管系统、神经系统、内分泌系统、免疫系统、呼吸系统和生殖系统等的生理功能具有重要影响.反常的H2S代谢与很多疾病密切相关,如哮喘、动脉粥样硬化、糖尿病、高血压、神经退化性疾病以及癌症等[6].对H2S生理功能和相关分子机理的研究已成为生物学领域的主要热点之一.
作为一种第二信使分子,H2S在细胞内存在内源性产生途径,主要是以半胱氨酸为底物,通过酶的作用而形成.目前已知的能产生H2S的3种酶是胱硫醚-β-合成酶(cystathionine β-synthase,CBS)、胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)和 3-巯基丙酮酸盐硫转硫酶(3-mercaptopyruvate sulfurtransferase,MST).由于H2S涉及到多种生理功能,因此抑制H2S的内源性产生可能会诱发各种疾病.例如,饲以炔丙基甘氨酸(一种CSE抑制剂)的大鼠血压上升[7],CSE基因敲除的小鼠表现出了明显的高血压[8].显然,如果外源性化合物能够抑制体内H2S的产生,则很可能同样诱发高血压或者其他疾病.因此,研究外源性化合物对体内H2S产生的影响对于理解这些化合物生理效应的分子机理非常有意义.
本工作研究了CHB对人胚肝L02细胞内源性H2S浓度的影响.用不同浓度的CHB孵育L02细胞1 h,收集并进行超声裂解后检测细胞裂解液中H2S的浓度.为了验证结果的可靠性,使用O-(羧甲基)羟胺(O-(carboxymethyl)hydroxyl-amine,CMHA)孵育细胞进行平行实验.CMHA是一种CSE的强抑制剂,也可抑制CBS[9].
有多种方法可检测生物样品中的H2S浓度,如亚甲基蓝比色法、硫离子电极法、3-溴甲基-2,5,6-三甲基-1H,7H-吡咯并[1,2-a]吡咯-1,7-二酮(3-bromomethyl-2,5,6-trimethyl-1H,7H-pyrazolo[1,2-a]pyrazole-1,7-dione,MBB)法、荧光染料法、气相色谱法和安培传感器法等[10].本工作选择了MBB法,其原理是H2S用荧光标记试剂MBB进行衍生化反应, 形成产物 3,3’-(硫双亚甲基)双(2,5,6-三甲基-1H,7H-吡咯并[1,2-a]吡咯-1,7-二酮)(3,3’-[thiobis(methylene)]bis[2,5,6-trimethyl-1H,7H-pyrazolo[1,2-a]pyrazole-1,7-dione],SDB,见图1).MBB自身不会发出荧光,而产物SDB会发出很强的荧光.反应后的样品在高效液相色谱(high performance liquid chromatography,HPLC)仪上进行分离,用荧光检测器进行定量,从而获得样品中的H2S浓度[11].
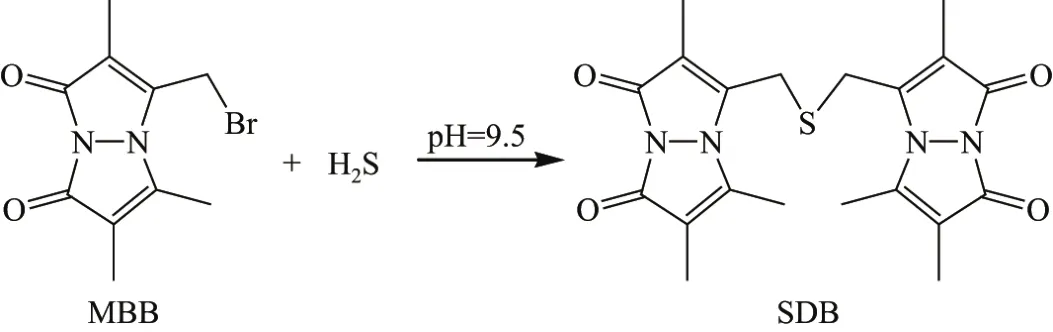
图1 H2S用MBB进行衍生化反应Fig.1 Derivatization of H2S with MBB
1 材料与仪器
1.1 主要材料与试剂
MBB,CMHA,硫化钠(Na2S·9H2O),5-磺基水杨酸(sulfosalicylic acid,SSA)购于Sigma-Aldrich(USA).三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris,BR试剂)、二乙三胺五乙酸(diethylenetriaminepentaacetic acid,DTPA)、三氟乙酸(trifluoroacetic acid,TFA)以及其他未一一列出的化合物购于国药集团化学试剂公司(上海)(如未特别指明,试剂纯度均为分析纯).牛血清白蛋白(bovine serum albumin,BSA)购于上海前尘生物科技有限公司(上海). 改良的 Eagle培养基(Dulbecco’s modified Eagle’s medium,DMEM)和胎牛血清(fetalbovine serum,FBS)购自Invitrogen(USA).青霉素和链霉素购于北京鼎国昌盛生物技术有限公司(北京).人胚肝L02细胞购自中国科学院细胞库(上海).CHB按照文献[12]的方法合成.
1.2 仪器设备
本工作所使用的主要仪器设备如下:Waters Alliance 2695 HPLC系统,配置Waters 2475多通道荧光检测器(Milford,MA,USA);Agilent ZORBAX 80˚A StableBond SB-C18色谱柱(4.6 mm×250 mm,5µm)(Palo Alto,CA,USA);Bio-Rad iMark酶标仪(Hercules,CA,USA);Eppendorf Centrifugal 5804R高速离心机(Hamburg,Germany).
1.3 HPLC方法
HPLC流动相:A相为水,用TFA调节pH值为2.5;B相为含0.02%TFA的乙腈;温度为30◦C,流速为1 mL/min.梯度洗脱程序如表1所示.在这些条件下,SDB的保留时间为15.0 min.
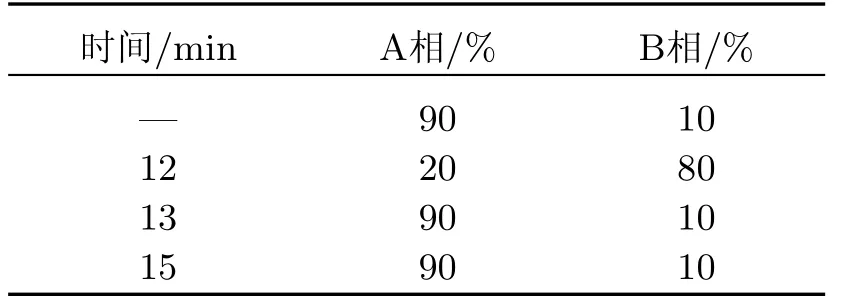
表1 梯度洗脱程序Table 1 Gradient elution program of HPLC
2 实验方法
2.1 细胞实验
L02细胞在含10%FBS,100 U/mL青霉素和100µg/mL链霉素的DMEM培养基中,于37◦C在含有5%CO2的培养箱中培养.待细胞处于对数生长期,生长至80%左右时,加入含有不同浓度CHB或CMHA的无FBS的DMEM培养基中,37◦C孵育1 h.用冰冷的磷酸盐(phosphate-buff ered saline,PBS)缓冲液洗两次,刮下.在D-Hank’s缓冲液中吹散成细胞悬液(每5百万个细胞用500µL缓冲液),超声破碎,4◦C,16 000 g离心10 min.离心后的上清液立即用MBB法检测.
2.2 Bradford方法测定蛋白质
在200µL考马斯亮蓝溶液中加入10µL BSA或待测溶液,混合均匀后放置5 min.取180µL混合液置于96孔板中,用酶标仪在波长595 nm处测量吸光度.用0.1,0.2,0.3,0.4和0.5 mg/mL BSA溶液制备工作曲线.
2.3 MBB法测量样品中H2S的浓度[11]
步骤 1 70µL pH=9.5 Tris缓冲液 (100 mmol/L,含 0.1 mmol/L DTPA)和 50µL 10 mmol/L MBB乙腈溶液混合,加入30µL样品,暗处放置30 min.
步骤2 加入50µL 200 mmol/L SSA溶液,置于冰上10 min.
步骤3 4◦C,11 000 r/min离心10 min.
步骤4 HPLC分析,荧光检测(λex=390 nm,λem=475 nm).
2.4 统计分析
每个实验中的待测样品至少设置3个平行样.用t-test检验数据的差异,p<0.05表明差异是统计显著的.
3 结果与讨论
3.1 MBB法的改进
Shen等[11]建立的MBB法,假定H2S容易被氧气氧化,需要在无氧条件下进行反应,因此需要在手套箱中进行操作.然而根据化学反应原理,虽然H2S确实能够被氧气氧化,但该反应是动力学不利的.因为氧分子处于三重态,而该反应涉及到两个电子的转移.实际上,已有多篇文献研究过H2S与氧气在水中氧化反应的动力学.例如,Millero等[13]发现,在空气饱和的海水(pH=8)中,H2S在25◦C条件下被氧化的半衰期为26 h.Luther等[14]发现,在空气饱和的不含微量金属离子的水中,在pH=12和25◦C条件下,H2S被氧化的半衰期长达55 d.Olson等[10]也进行了相似的实验,证明在通常实验条件下H2S被氧化的速率非常慢.本工作也进行了一些简单的检验,同样表明H2S的氧化反应完全不影响实验结果(数据略).因此,本工作中的所有实验操作均未在手套箱中进行.
3.2 CMHA对细胞内源性H2S产生的抑制效应
为了检验改进后的MBB法是否能正确测量细胞裂解液中的H2S浓度,使用不同浓度(1,50,100和150µmol/L)的CMHA孵育L02细胞1 h,然后进行检测.结果表明:CMHA确实会大大降低细胞内源性H2S的产生(见图2和表2),测得的H2S浓度随CMHA浓度的增加而降低,显示了良好的浓度-效应关系.在不同浓度CMHA下获得的数据都明显低于对照组(即未使用CMHA的情况),且差异是统计显著的(p<0.01,见图2).
根据相关文献报道,CMHA对CSE的抑制效应很强(其半抑制浓度IC50=1.09µmol/L),而对CBS的抑制效应稍弱(IC50=8.52µmol/L)[9],且肝脏中主要的内源性H2S产生途径是通过CSE[6].本实验结果与这些文献报道吻合.由于CMHA的IC50为1.09µmol/L,因此1µmol/L CMHA就产生了明显的抑制效应(与对照组相比,1µmol/L CMHA处理后的H2S浓度降低了27%,见表2),说明改进后的MBB法能够很好地检测细胞裂解液中的H2S浓度.

表2 不同浓度CMHA孵育L02细胞1 h后,用MBB法测得的H2S浓度Table 2 Concentrations of H2S obtained in L02 cells with the MBB assay after incubation with different concentrations of CMHA for 1 h

图2 CMHA对L02细胞内源性H2S产生的抑制效应Fig.2 Inhibition of endogenous H2S production in L02 cells caused by CMHA
3.3 CHB对细胞内源性H2S产生的影响
用10,50和200µmol/L CHB孵育L02细胞1 h后,发现CHB也导致了细胞内源性H2S浓度的明显降低,而且存在浓度-效应关系(见图3和表3).与对照组相比,10µmol/L的CHB可使细胞内源性产生的H2S浓度降低一半(见表3).经过统计分析,差异是统计显著的(p<0.01,见图3).50和200µmol/L CHB可使H2S的浓度进一步降低,但降低的幅度变得较为缓慢(见图3).
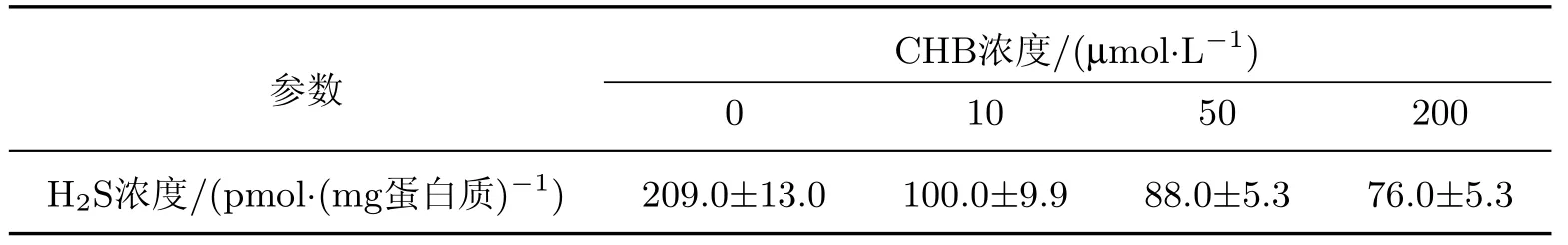
表3 不同浓度CHB孵育L02细胞1 h后,用MBB法测得的H2S浓度Table 3 Concentrations of H2S obtained in L02 cells with the MBB assay after incubation with different concentrations of CHB for 1 h

图3 CHB对L02细胞内源性H2S产生的影响Fig.3 Eff ect of CHB on endogenous H2S production in L02 cells
在本实验中,细胞毒性是一个很重要的因素.如果外源性化合物的浓度过高,引起细胞死亡(凋亡或坏死),则观察到的H2S浓度降低可能是细胞死亡的结果.然而,Liu等[15]已经发现,对于L02细胞,即使CHB的浓度增加到1 000µmol/L都没有显示细胞毒性,因此本实验中观察到的现象表明CHB对细胞内源性H2S产生具有明显的抑制效应.这一发现对CHB及其前体1,3-丁二烯的毒理学研究具有重要意义.由于H2S是细胞内生理活动的一个枢纽,涉及到无数生理功能,因此抑制内源性H2S的产生可能涉及多种疾病,也可能是CHB和1,3-丁二烯毒性效应机理的一个重要方面.当然,CHB抑制效应的分子机制尚不清楚,需要进一步的研究.
4 结束语
由于1,3-丁二烯的主要环境来源是机动车尾气和香烟烟雾,因此它是一种广泛存在的环境污染物,几乎每个人都暴露于1,3-丁二烯的污染中.已知1,3-丁二烯本身并不是致癌物,其致癌性必须通过代谢活化,即1,3-丁二烯的致癌性源于其代谢产物.在气体第二信使分子中,H2S是最新的一个信号分子,关于H2S的研究也呈指数增长趋势,已经成为生物学研究的一个热点领域.本工作将1,3-丁二烯代谢产物与细胞内源性H2S的产生相关联,发现CHB能够明显抑制细胞内源性H2S的产生,具有重要意义.实验结果有助于更深地理解1,3-丁二烯在分子水平上的毒性机理,并且形成进一步深入研究的起点.

