间隙连接蛋白37在腰椎椎间盘突出症炎性反应中的意义
张琛琳,陈 思,陈剑峰,*
1.南京中医药大学研究生院,江苏 210046
2.无锡市中医医院骨科,江苏 214000
腰椎椎间盘突出症是临床上常见的腰部疾患,腰椎椎间盘纤维环在退行性变或外力的作用下出现裂隙,使得其包绕的髓核组织向后方突出,刺激、压迫脊髓神经根,进而导致神经根出现炎症、营养障碍,引起腰臀部及下肢的的酸麻疼痛,严重时还会影响患者日常活动,甚至出现二便失禁等马尾神经症状。腰椎椎间盘突出症的发生机制尚未明确,目前公认的机制主要有机械压迫、化学性神经根炎、椎间盘自身免疫3种观点[1]。近年来,随着分子生物学的快速发展,基因多态性和基因突变与疾病发生的关联受到关注。间隙性连接蛋白37(CX37)是一种可在细胞膜上形成间隙连接通道供细胞间直接信息交流的连接蛋白,它的异常与炎性反应介导的疾病相关[2]。本研究对10例腰椎椎间盘突出症患者及8例腰椎爆裂骨折患者(椎间盘部分损坏,无明显退变)的椎间盘进行影像学观察、CX37和炎症因子检测,探讨CX37在腰椎椎间盘突出症炎性反应中的意义。
1 资料与方法
1.1 研究对象
选择2014—2016年本院收治的10例腰椎椎间盘突出症手术患者作为观察组。纳入标准:①年龄20 ~ 75岁;②符合腰椎椎间盘突出症的诊断标准[3];③CT、MRI显示腰椎椎间盘突出。排除标准:①合并其他严重的器质性病变,包括恶性肿瘤、骨折、腰椎滑脱等;②合并有心血管、肝、肾等系统严重原发性疾病;③精神疾病患者、治疗不合作或同时进行其他治疗者。选择腰椎爆裂骨折且MRI显示椎间盘无明显退行性变的8例患者作为对照组。所有研究对象均知情同意并签署知情同意书。记录患者的性别、年龄、体质量指数(BMI)、双侧大腿围差值等基本信息。
1.2 影像学检查
CT扫描层厚为3 mm,间距为1 mm,观察患者椎间盘突出部位,分析是否有神经根受压。患者仰卧位进行腰椎MRI检查,摄横断面和矢状面图像,层厚为5 mm,评估患者脊髓是否存在变性。根据患者MRI T2加权像进行Pfirrmann分级[4]:Ⅰ级,椎间盘高度正常,组织信号均匀,髓核与纤维环分界清楚;Ⅱ级,椎间盘高度正常,椎间盘内稍有不均匀结构,髓核与纤维环分界清楚;Ⅲ级,椎间盘的高度与正常椎间盘相比轻度降低,椎间盘内有不均匀结构,信号欠均匀,纤维环与髓核分界不清;Ⅳ级,椎间盘的高度与正常椎间盘相比中度降低,椎间盘内有不均匀结构,椎间盘内有低信号,髓核与纤维环界限基本消失;Ⅴ级,椎间盘高度重度降低,椎间盘内有低信号与不均匀结构,髓核与纤维环界限消失,椎间盘塌陷。Pfirrmann分级由2名医师独立完成,将2名医师的分析结果行Kappa一致性检验,意见不一致时由第3名医师确定最终结果。
1.3 标本采集与检测
观察组患者通过椎间盘摘除术取出椎间盘组织,对照组患者通过减压手术取出少量损伤椎间盘。将取出的髓核组织用生理盐水冲洗后置于液氮集中保存。采用PCR方法检测髓核组织中CX37、IL-6与TNF-α的mRNA表达水平。提取髓核组织中的RNA,反转录为cDNA,进行PCR扩增。引物序列:β-actin上游引物为5′-CACTGTGCCCATCTACGA-3′,下游引物为5′-GTAGTCTGTCAGGTCCCG-3′;CX37上游引物为5′-CCTCCTCAGACCCTTACACGG-3′,下游引物为5′-CATCCCAGGCAGCCAGACT-3′;IL-6上游引物为5′-AAATCCCTCCTCGCCAATCT-3′,下游引物为5′-CCCTCACGGTCTTCTCCATAAA-3′;TNF-α上游引物为5′-ATCCGCGACGTGGAACTG-3′,下游引物为5′-ACCGCCTGGAGTTCTGGAA-3′。PCR 反应程序 :94℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,共35个循环;最后72℃延伸7 min。反应产物进行聚丙烯酰胺凝胶电泳,以β-actin为内参计算各目的基因在mRNA水平的相对表达量。
1.4 统计学处理
采用SPSS 19.0软件对数据进行统计学分析。实验数据以x±s表示,采用两样本均数比较的t检验比较组间差异,以P < 0.05认为差异有统计学意义。采用Pearson法分析CX37与IL-6、TNF-α表达的相关性。
2 结果
2组患者一般资料见表1。2组患者年龄、性别、BMI比较差异无统计学意义(P > 0.05,表1);观察组双下肢大腿围差值明显高于对照组,差异有统计学意义(P < 0.05,表1)。
2.2 影像学特征分析
CT显示8例腰椎爆裂骨折患者均有不同程度的椎间盘损伤(图1a);10例腰椎椎间盘突出症患者中,有4例出现髓核脱垂,5例出现髓核突出压迫硬膜囊(图1b),1例出现后缘锐角。MRI显示8例腰椎爆裂骨折患者中,6例椎间盘损伤、硬膜囊完整,2例出现椎间盘向后突出、硬膜囊稍有受压(图1c);10例腰椎椎间盘突出症患者均可见椎间盘明显突出(图1d),有4例出现髓核脱垂,4例边缘不规则,2例椎间盘有变性。经Pfirrmann分级,对照组Ⅰ级6例,Ⅱ级2例;观察组Ⅲ级3例,Ⅳ级3例,Ⅴ级4例。
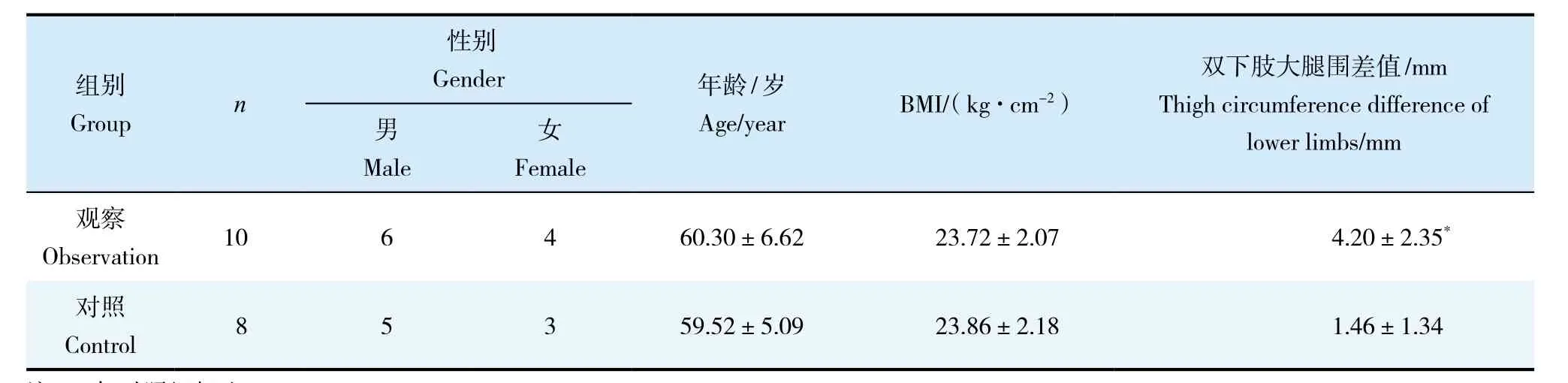
表1 一般资料Tab.1 General data
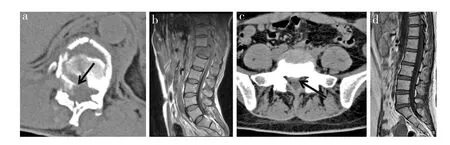
图1 2组患者CT和MRIFig.1 CT and MRI imaging in 2 groups
2.3 髓核组织中CX37、IL-6和TNF-α mRNA的表达
PCR结果显示观察组CX37、IL-6和TNF-α的mRNA表达水平均高于对照组,差异有统计学意义(P < 0.05,图2)。
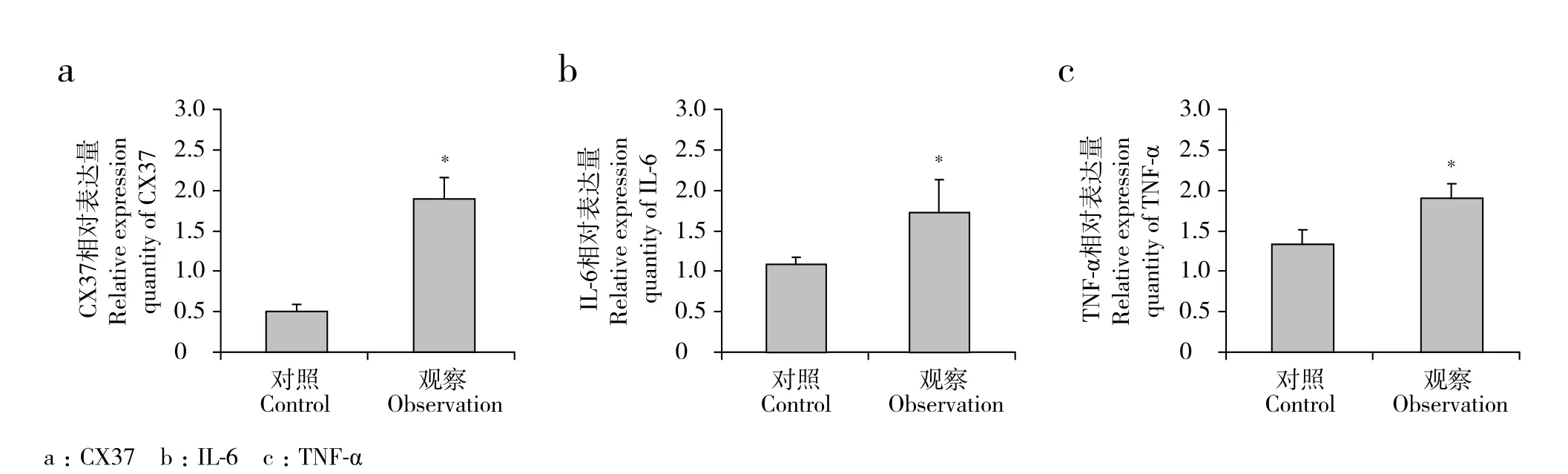
图2 髓核组织中CX37、IL-6和TNF-α mRNA相对表达量Fig.2 Relative expression quantity of CX37,IL-6 and TNF-α mRNA in nucleus pulposus
2.4 Pearson相关性分析
Pearson相关性分析显示,炎症因子IL-6,TNF-α与CX37均呈正相关(表2)。
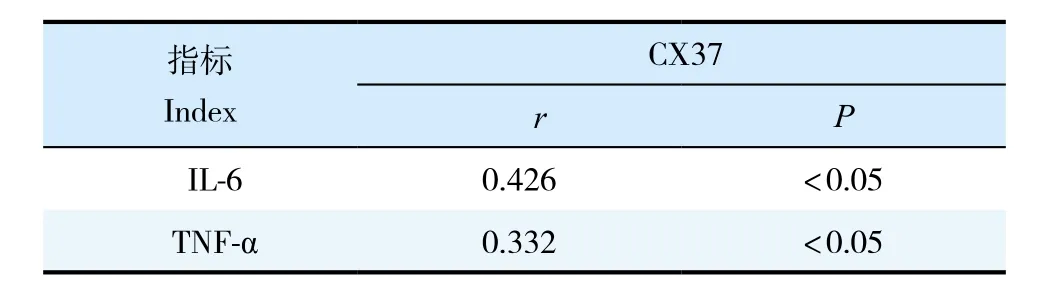
表2 炎症因子IL-6,TNF-α与CX37相关性Tab.2 Correlation between inflammatory factors IL-6,TNF-α and CX37
3 讨 论
间隙连接蛋白(CX)是指相邻细胞间的跨膜离子及低分子通道中组成连接子的功能一致的亚单位,其通过细胞间隙连接通讯(GJIC),将细胞质膜上的环状连接子横向移动到相邻细胞的边缘,并与相邻细胞中的对应物对接,形成细胞间通道[5-7]。CX37是目前发现的20余种CX中的一种,通常在内皮细胞与巨噬细胞中表达[8],前期在动脉粥样硬化的研究中发现,CX37通过GJIC使得腺苷与内皮细胞和某些炎性细胞表面的受体结合而具有抗炎和细胞保护作用;CX37缺陷的单核细胞可减少腺苷的产生,促进小鼠的动脉粥样硬化发生,有利于促炎性环境的形成[9-12]。Chanson等[2]认为CX37是炎性疾病的潜在修饰基因,巨噬细胞之间的间隙连接主要是基于电耦联,通过染料转移实验验证巨噬细胞与其他细胞的间隙连接时发现,CX37在单核细胞与巨噬细胞中存在染料转移。至于CX37与腰椎椎间盘突出症引起的炎性反应是否有关,本研究组前期的研究发现腰椎椎间盘突出症的发生与CX37基因的CC基因型和C等位基因频率(CC+CT)增高有关,提示CC+CT增高可能与突出的髓核物质中所含的内源性化学炎性介质有关[13]。
腰椎椎间盘突出症中,发生退行性变的椎间盘往后突出,压迫神经根与硬膜囊,局部产生神经根炎,从而导致局部炎性反应的发生。一方面,腰部炎性反应的产生将会不同程度地限制患侧下肢活动,造成腰部及患侧下肢肌肉退化,出现下肢肌肉控制能力的减退,长此以往会形成恶性循环,导致患侧下肢肌肉进行性萎缩[14];本研究发现观察组患者的双下肢大腿围差值明显大于对照组,证实了腰椎椎间盘突出症患者会出现不同程度的患侧下肢肌肉萎缩。另一方面,McCarron等[15]研究发现,突出物边缘区域是以新生血管形成和巨噬细胞浸润为主的肉芽组织,病灶附近常存在充血、炎性反应,突出的髓核中所含的内源性化学物质会引起炎性反应,并且存在以巨噬细胞为主的炎性细胞浸润。本研究发现,CT、MRI影像结果显示2组患者椎间盘及脊髓的形态存在差异,部分椎间盘突出症患者的髓核突出,压迫硬膜囊,且对照组患者椎间盘Pfirrmann分级为Ⅰ或Ⅱ级,观察组患者椎间盘Pfirrmann分级为Ⅲ~Ⅴ级,说明腰椎椎间盘突出症患者椎间盘均发生明显的退行性变,压迫硬膜囊导致炎性反应的产生。
Mochida等[16]研究认为,正常椎间盘中不存在巨噬细胞,当椎间盘组织突出暴露于硬膜外后,可将血管撕破,刺激新生血管中的单核细胞转变为巨噬细胞长入突出组织内进行吞噬。巨噬细胞分泌某些生物活性物质,如IL-1、IL-6、TNF等也参与调节免疫应答,并且有着明显的致痛觉过敏作用。张威林等[17]亦认为炎性成分可导致椎间盘发生退行性变,其中IL-6、TNF等炎症因子的表达在椎间盘退行性变过程中显著增高。
TNF-α是最早出现且最重要的炎性因子,能激活中性粒细胞及淋巴细胞从而参与炎性反应;IL-6主要由T细胞、血管内皮细胞及单核/巨噬细胞等产生,其通过影响细胞外基质蛋白多糖、胶原及机体免疫应答促进炎性反应的发生[18]。本研究发现观察组髓核组织中IL-6与TNF-α水平明显高于对照组,表明确有炎性反应的发生。同时CX37水平也明显高于对照组,且与炎症因子IL-6,TNF-α呈正相关。分析其原因可能是,在炎性反应过程中随着巨噬细胞的释放,CX37的表达明显增高[2],而巨噬细胞同时会分泌IL-6、TNF-α等炎性因子共同参与炎性反应;CX37可能通过GJIC使得巨噬细胞与某些炎性细胞表面的受体结合而使炎性反应加剧。
综上所述,CX37可能通过GJIC调控炎性因子参与腰椎椎间盘突出症炎性反应的发生、发展。但本研究样本量较小,本课题组正在进一步收集资料,将扩大样本量进行后续研究,探索CX37与腰椎椎间盘突出症炎性反应之间的具体机制,为腰椎椎间盘突出症的机制研究及临床诊治提供依据。

