氮添加对杉木林土壤有机碳矿化速率及酶动力学参数温度敏感性的影响
董清馨,张心昱,*,王辉民,付晓莉,郭志明,陈伏生
1 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室,北京 100101 2 中国科学院大学资源与环境学院,北京 100190 3 江西农业大学江西省竹子种质资源与利用重点实验室,南昌 330045
由于世界范围内化石燃料燃烧、工业发展以及人造氮肥的生产和使用,全球氮循环大规模加速,氮沉降显著增加[1]。在我国南方热带、亚热带森林中,大气氮沉降量已经达到了30—73 kg N hm-2a-1[2]。生态系统的大气氮沉降增加可以加速土壤有机碳矿化、增加养分有效性、促进植物对养分的吸收,但系统中的氮一旦超过植物及土壤微生物对氮的蓄积能力,生态系统将出现氮饱和的情况,导致土壤硝酸盐淋溶、土壤的酸化等问题[3]。
土壤碳库是生态系统中最大并且最活跃的有机碳库[4],土壤有机碳矿化是土壤有机碳在微生物作用下被分解变为简单无机化合物并释放二氧化碳(CO2)的过程[5],其强弱可用其矿化速率表示(Cmin),可指示土壤有效养分含量的高低。土壤Cmin的温度敏感性(Q10)是指土壤温度每升高10℃,土壤有机碳矿化速率增加的倍数,Q10数值越大表示温度敏感性越高[6]。IPCC报告指出,1880年以来陆地和海洋表面温度平均每年增加0.85℃,预计到2100年全球温度将增加4—7℃[7]。在未来全球气候变暖的背景下,温度升高可能会促进碳矿化速率的增加,因此准确理解土壤碳矿化对增温的响应具有重要意义[8]。过量的氮输入极大地影响了陆地生态系统的碳循环过程[9]。目前关于氮添加对土壤有机碳矿化速率温度敏感性研究较多,但结果有促进[10-11],抑制[2, 12-13]。有机碳矿化速率及温度敏感性受底物质量[14]、微生物群落组成和养分有效性[15]等多种因素的影响,相关研究结果尚无统一定论。
土壤有机碳矿化过程是由土壤微生物驱动,土壤酶介导完成的[16]。土壤微生物是参与土壤有机碳矿化和养分循环的关键要素[17]。土壤中β-1,4-葡萄糖苷酶(βG)催化纤维素和半纤维素的分解为葡萄糖。水解酶促反应遵循米氏方程:V=Vmax[S]/(Km+[S]),其中,Vmax是酶促反应的最大潜在反应速率,表示底物浓度充足时,土壤酶的最大潜在活性;Km是半饱和常数,即1/2Vmax时的底物浓度,表示酶与底物结合的亲和性的强弱[18];Vmax/Km是催化效率[19]。关于酶动力学参数及其温度敏感性的研究,是近年来土壤酶学领域的热点问题[19-22]。目前,氮添加如何影响水解酶动力学参数温度敏感性还不清楚。
我国杉木(Cunninghamialanceolata)林种植面积已达911万hm2,分别占中国和世界的18%和5%[23]。本研究分析氮添加对杉木林土壤有机碳矿化及βG动力学参数温度敏感性的影响,为氮沉降背景下土壤碳素循环的生物化学过程对增温响应的模型提供重要参数。
1 材料和方法
1.1 样地概况
研究样地位于江西省泰和县石溪林场(26o52′44″N,115o13′04″E,海拔102 m),该站点属典型的中亚热带季风气候[24],年平均气温和降水量分别为17.9℃和1471.2 mm[25]。样地杉木(Cunninghamialanceolata)建于2000年[26]。土壤类型为典型低盐基湿润弱育土,土壤母质为红色砂岩和泥石风化物[27]。样地未施氮前的土壤容重为1.31 g/cm,pH为4.6,土壤有机碳(SOC)含量为17.68 g/kg,全氮(TN)含量为1.12 g/kg,全磷(TP)含量为0.1 g/kg[28]。
1.2 试验设计
1.2.1 长期氮添加控制试验
在2011年11月设置杉木林样方,选择9个400 m2(20 m × 20 m)的样方,并且每个样方间有10 m的缓冲地带。按氮添加量的高低设置3个处理:对照(N0),低氮(N1:50 kg N hm-2a-1),高氮(N2:100 kg N hm-2a-1),每种处理3次重复,施用氮肥为NH4NO3。自2012年开始施肥,每年4次,其中生长季(6月、9月)施肥量为全年的30%,非生长季(3月、12月)施肥量为全年的20%。本研究在2017年9月采用5点混合法采样。除去地表凋落物层后,用直径2 cm的土钻采集0—10 cm土壤样品,过2 mm筛,剔除根系残体,自封袋密封后用冷藏箱运回实验室,4℃冰箱保存。
1.2.2 室内控温培养实验
对杉木林3个处理、3个重复共9个样品进行室内温度梯度培养,分别设置10℃、15℃、20℃、25 ℃、30 ℃、35℃、40℃共7个培养温度,总计63个样品。
具体步骤为:称取相当于40 g干土重的鲜土,装入100 mL圆口塑料瓶中,土壤样品含水量调节至60%的田间持水量[29],放入恒温(20℃)、恒湿(80%)培养箱内预培养4 d,然后放入上述温度梯度的培养箱,在恒湿条件下培养7 d。在培养过程中,采用称重法给土壤样品补水,每隔2—3 d补水1次。
1.3 样品分析
1.3.1 土壤理化性质
1.3.2 土壤碳矿化速率及温度敏感性
在室内控温培养的第1、3、5、7 d,采用实验室自主研发的室内土壤微生物呼吸自动连续测定装置[31],测定Cmin,计算4次Cmin平均值,Cmin的计算公式为:
Cmin=C×V×α×β/m
式中,Cmin为土壤有机碳矿化速率(μg C d-1g-1);C为在测试时间内CO2浓度变化的直线斜率;V为管线和培养瓶的总体积(ml);α为CO2气体体积转化为质量的系数;β为时间(s) 转化为天数(d)的系数;m为培养瓶内干土质量(g)。
土壤有机碳矿化速率温度敏感性的计算公式为:
Cmin=a×ebT
Q10(Cmin)=e10b
式中,T为自记式纽扣温度计记录的土壤温度(℃);a表示0℃时土壤有机碳矿化速率(μg C d-1g-1);b为温度反应系数,a和b由土壤有机碳矿化速率与温度拟合获得;Q10(Cmin)为土壤有机碳矿化的温度敏感性,即温度每升高10℃土壤有机碳矿化速率增加的倍数[32]。
1.3.3 土壤β-1,4-葡萄糖苷酶动力学参数及温度敏感性
分别取培养后63个土壤样品的1 g鲜土于烧杯中,加入125 ml pH=4.5—5的醋酸缓冲液(50 mmol/L),用玻璃棒搅拌,及旋涡振荡器混匀,制成土壤悬浮液;吸取土壤悬浮液200 μL于96孔微孔板,再加入50 μL的4-甲基伞形酮酰-β-D-吡喃葡萄糖苷(4-MUB-β-D-glucopyranoside)作底物,底物浓度梯度设置为5、10、20、30、40、60、100和200 μmol/L,在标准物质孔中加入50 μL浓度为10 μmol/L的标准物质4-甲基伞形酮(4-MUB,4-methylumbelliferyl)和200 μL的醋酸缓冲液,样品分析设置8个重复,同时设置空白。所有微孔板在相应温度培养箱黑暗条件下培养4 h。
停止培养后,每个孔加入10 μL 1mol/L NaOH溶液,过1 min后,采用微孔板荧光法在360 nm激发、460 nm下进行测定(SynergyH4, BioTek)[33-34]。
在SigmaPlot 10.0软件中对酶活性和底物浓度进行米氏方程双曲线拟合,计算土壤酶动力学参数(Vmax和Km),计算公式为:
V=Vmax[S]/(Km+[S])
式中,V为酶促反应速率(nmol g-1h-1);S为底物浓度(μmol/L);Vmax为酶促反应的潜在最大速率(nmol g-1h-1);Km为半饱和常数(μmol/L)。
土壤酶动力学参数温度敏感性的计算公式为:
Q10=eSlope×10
式中,Slope为对Vmax和Km进行对数转换,与培养温度建立线性回归方程的斜率[15]。
1.4 数据统计分析
利用SPSS 17.0软件对数据进行统计分析。采用协方差分析(ANCOVA)对不同氮添加水平和培养温度下的Cmin和βG动力学参数进行显著性检验,氮添加处理作为主影响因子,培养温度作为协变量。采用单因素方差分析(one-way ANOVA)对不同处理土壤理化性质、土壤Cmin以及βG动力学参数的温度敏感性进行显著性检验,采用Duncan法进行多重比较(P=0.05)。2017年9月采样时样地土壤温度为27 ℃,因此选择相近的30℃培养下的土壤Cmin、βG动力学参数,30—40℃培养温度下βG动力学参数的Q10值和土壤环境因子,采用Pearson法进行相关分析。利用SigmaPlot 10.0软件作图。图表中数据为平均值±标准误。
2 结果与分析
2.1 氮添加对土壤理化性质的影响

2.2 氮添加对有机碳矿化速率及温度敏感性的影响
在10—40℃培养温度范围内,不同氮添加处理的土壤Cmin随温度的增加而呈指数增加,为N2>N1>N0。协方差分析结果表明,氮添加对Cmin的影响极显著(P<0.05)。N0、N1、N2的Q10(Cmin)大小分别为1.21、1.20、1.14,但处理间均无显著差异(图1)。
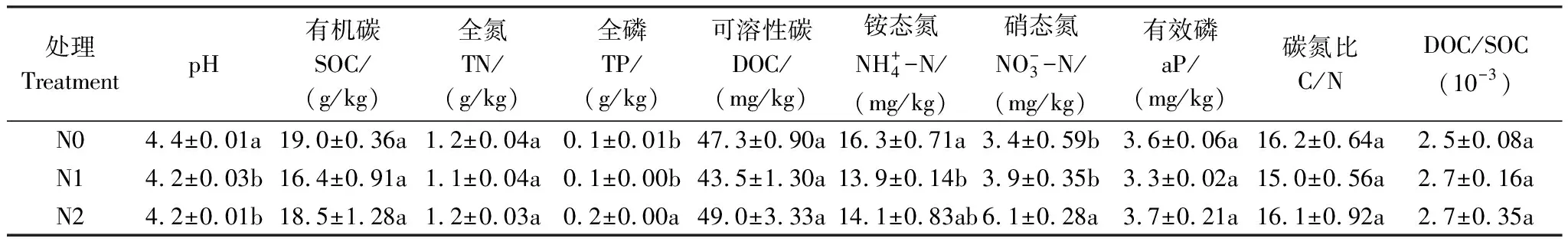
表1 氮添加对土壤理化性质的影响
每列不同小写字母表示不同处理间差异显著(P<0.05,n=3),数据表示平均值±标准误;N0(对照),N1(50 kg N hm-2a-1),N2(100 kg N hm-2a-1);SOC:Soil Organic Carbon;TN:Total Nitrogen;TP:Total Phosphorus;DOC:Dissolved Organic Carbon;aP:available Phosphorus;C/N:Carbon/Nitrogen;DOC/SOC:Dissolved Organic Carbon/Soil Organic Carbon
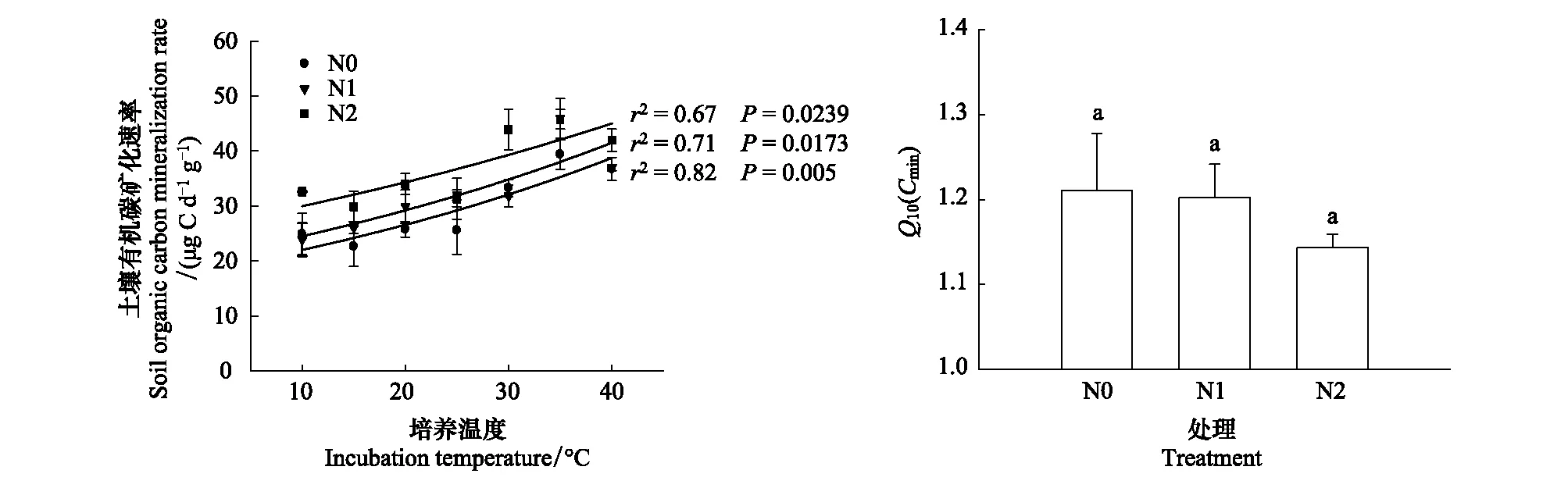
图1 不同氮添加水平土壤有机碳矿化速率及温度敏感性Fig.1 Soil organic carbon mineralization rate and their temperature sensitivity under different nitrogen additionsCmin:土壤有机碳矿化速率,soil organic carbon mineralization rates
2.3 氮添加对β-1,4-葡萄糖苷酶动力学参数及温度敏感性的影响

图2 不同氮添加水平β-1,4-葡萄糖苷酶动力学参数及温度敏感性Fig.2 Kinetic parameters and their temperature sensitivity of β-1,4-glucosidase under different nitrogen additionsVmax:最大反应速率,maximum rates of velocity ;Km:半饱和常数,half-saturation constant ;Vmax/Km:催化效率,catalytic efficiency
不同氮添加水平下的lnVmax、ln(Vmax/Km)与温度呈显著正相关,且值大小为N2>N1>N0(P<0.05)。不同氮添加水平的Q10(Vmax)和Q10(Km)的大小都表现N2>N1>N0,并且差异显著,而不同处理间Q10(Vmax/Km)无显著差异(图2)。
2.4 相关分析
表230℃土壤有机碳矿化速率、β-1,4-葡萄糖苷酶动力学参数和土壤环境因子的相关性
Table2Thecorrelationsbetweensoilorganiccarbonmineralizationrate,kineticparametersofβ-1,4-glucosidaseandthesoilenvironmentalfactorsat30℃
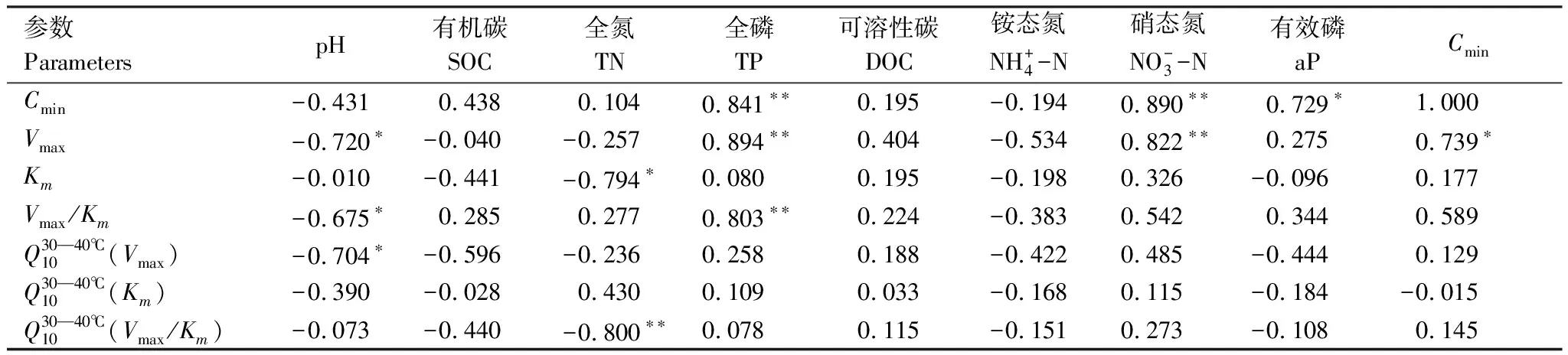
参数ParameterspH有机碳SOC全氮TN全磷TP可溶性碳DOC铵态氮NH+4-N硝态氮NO-3-N有效磷aPCminCmin-0.4310.4380.1040.841∗∗0.195-0.1940.890∗∗0.729∗1.000Vmax-0.720∗-0.040-0.2570.894∗∗0.404-0.5340.822∗∗0.2750.739∗Km-0.010-0.441-0.794∗0.0800.195-0.1980.326-0.0960.177Vmax/Km-0.675∗0.2850.2770.803∗∗0.224-0.3830.5420.3440.589Q30—40℃10(Vmax)-0.704∗-0.596-0.2360.2580.188-0.4220.485-0.4440.129Q30—40℃10(Km)-0.390-0.0280.4300.1090.033-0.1680.115-0.184-0.015Q30—40℃10(Vmax/Km)-0.073-0.440-0.800∗∗0.0780.115-0.1510.273-0.1080.145

3 讨论
3.1 氮添加对土壤理化性质的影响

3.2 氮添加对土壤有机碳矿化速率及温度敏感性的影响
氮添加量越高,土壤Cmin越高,这与Wang[13]、向元彬[41]等研究结果一致。氮添加增加了土壤有效氮、磷养分含量,促进微生物生物量增加[28],并促进微生物分泌获取能量的酶活性,增加土壤有机碳矿化速率[41]。有机碳矿化速率除与土壤养分含量有关,还受底物中元素比值的影响[42],较低的C/N表示微生物的有机碳分解作用更强,反之则较弱[43]。但本研究中氮添加对土壤C/N无显著影响表明本研究中C/N不是影响Cmin的主要因子。
土壤有机碳矿化速率的Q10值随氮添加量的升高而下降,但处理间差异不显著。Mo[2]在我国南方亚热带森林的研究也显示有机碳矿化速率的Q10值随氮添加量的升高而显著下降。Mo认为温度是影响Cmin最主要因素,但大量氮添加改变了温度对土壤呼吸速率的控制作用[2]。与之相比,本研究样地氮添加为7a,而Mo样地氮添加为15a,相对较短时间的氮添加处理可能是导致差异不显著的原因。Q10(Cmin)受多种因素影响,如有机质稳定性、底物有效性和微生物活性等[44]。根据酶动力学原理,分子结构越复杂的底物,即生物化学上越难分解的有机质,其分解所需要的活化能就越高,其Q10值就越高[14]。本研究不同氮添加处理下土壤DOC/SOC无显著差异,这也可能是造成不同氮添加处理下的Q10(Cmin)也无显著差异的原因之一。
3.3 氮添加对土壤β-1,4-葡萄糖苷酶活性动力学参数及温度敏感性的影响
不同氮添加水平βG的Vmax和Vmax/Km随温度升高而增大,这是因为温度升高,酶分子活动加剧,βG和底物反应速率增大,导致Vmax和Vmax/Km增加[21]。本研究中氮添加导致土壤氮磷含量增加,从而导致微生物能量(碳素)相对缺乏,根据微生物分泌酶的经济性原则[45-47],微生物产生更多与碳分解有关的酶(如βG),分解土壤中的纤维素、半纤维素等,提高土壤有机碳分解速率的同时也增大碳水解酶βG的活性以及酶和底物的催化效率[26],在温带森林研究结果与本研究的结果一致[15]。土壤酶Vmax和Cmin正相关表明,未来氮沉降继续增加情景下,氮添加满足微生物的养分和能量需求,微生物将分泌更多βG水解酶,进一步促进有机碳分解。
不同氮添加处理条件下,βG的Km随温度增加出现了增加、降低、不相关3种趋势。目前对于Km随增温的变化趋势的研究结果不一致[15, 20],说明温度不是影响酶与底物亲和性的唯一因素。N0的lnKm随温度线性降低,这是因为温度越高,酶与底物活动剧烈,结合更紧密,亲和性更高[42]。而N2 的lnKm随温度线性升高,表明土壤中可能存在吸附于土壤颗粒上的其他可与酶反应的物质,其温度升高会促进这些物质的解吸附作用,与底物竞争结合酶的活性中心,导致Km增加[15]。
氮添加同时增加了Vmax和Km的Q10值,导致对Q10(Vmax/Km)值无影响。亚热带地区温度较高,氮添加增加βG的动力学参数的Q10值,表明微生物可以适应当地氮沉降增加和增温条件。温带森林氮添加对酶动力学参数温度敏感性的研究显示,氮添加对所测5种酶的Q10(Vmax)无明显影响,但显著增加了木糖苷酶(βX)的Q10(Km)[15]。酶动力学参数的温度敏感性与土壤环境、底物有效性等多种因素有关[18]。本研究施氮量(50、100 kg N hm-2a-1)高于温带森林施氮量(25.2、35 kg N hm-2a-1)[15],这可能导致本试验水解酶活性对温度更为敏感。而通过分析30—40℃范围内βG的Q10(Vmax)和Q10(Vmax/Km),发现前者与pH负相关,后者与TN正相关,说明土壤环境是影响动力学参数温度敏感性的重要因素。
4 结论
氮添加增加土壤有机碳矿化速率、β-1,4-葡萄糖苷酶的最大潜在反应速率和催化效率,并且高氮处理效果更显著。氮添加对β-1,4-葡萄糖苷酶最大潜在反应速率和半饱和常数的温度敏感性有显著促进作用,且高氮处理效果更显著,但氮添加对有机碳矿化速率和β-1,4-葡萄糖苷酶催化效率的温度敏感性影响不显著。30℃培养温度下的数据相关分析表明,土壤有机碳矿化速率与土壤全磷、硝态氮、有效磷、β-1,4-葡萄糖苷酶最大潜在反应速率正相关;β-1,4-葡萄糖苷酶最大潜在反应速率与土壤总磷、硝态氮含量正相关,与土壤pH负相关;半饱和常数和全氮负相关;催化效率和pH负相关,和全磷正相关。30—40℃培养温度下,β-1,4-葡萄糖苷酶最大潜在反应速率的温度敏感性和pH负相关,催化效率的温度敏感性和全氮负相关。本研究结果表明,未来氮沉降加剧和全球变暖情景下,亚热带杉木林土壤β-1,4-葡萄糖苷酶活性和催化效率会持续增强,土壤有机碳矿化速率会增加。

