30%土霉素注射液制备工艺的研究
李双江,刘聚祥
(河北农业大学动物医学院,河北保定 071000)
土霉素(oxytetracycline,OTC)属于四环素类广谱抗生素,通过抑制细菌肽链的增长,影响蛋白质的合成而达到抑菌杀菌效果[1],同时也对附红细胞体、支原体立克次氏体及血液原虫和梨形虫等感染有特殊功效[2]。临床上一般使用土霉素的盐酸盐,即盐酸土霉素,盐酸土霉素呈淡黄色粉末状,按照土霉素的传统用法口服给药,不仅给药剂量大,扰乱正常的肠道菌群,造成各种副作用,而且由于病畜的吸收不完全、排泄物等造成严重的环境污染[3-4]。
土霉素注射液最早是由美国辉瑞制药公司开发研制。近年来,农业部也审批了10%和20%两种规格的土霉素注射液,但在考察实际应用中,还存在诸多问题[5]。在低温环境下,土霉素注射液的黏稠度高,使实际生产环节中过滤灭菌工艺无法顺利进行,并且在临床使用时不宜注射。而在高温条件下,注射液中有效成分不稳定,盐酸土霉素容易发生开环裂解,活性成分遭到不可逆的破坏。另外,国内的土霉素注射液还存在有效含量低的问题,导致药物的作用时间短,需要多次注射和大量给药,引起动物应激,造成较大的经济损失等问题。我国的产品采用的有机溶媒多为甘油缩甲醛、吡咯烷酮、二甲基乙酰胺等,这些有机溶剂价格高昂,相关产品稳定性低,在实际生产中性价比低,这也是直接导致我国土霉素注射液产品缺乏市场竞争力的原因[6]。为改善我国土霉素注射液产品质量,本试验旨在开发30%的土霉素注射液,减少多次注射行为造成的动物应激,筛选出更经济更稳定的注射溶媒,提高注射液品质;并且加入缓释剂,在注射部位形成凝胶库,延长药物的作用时间,提高生物利用度,增强药效,减少毒副作用[7]。
1 材料与方法
1.1 材料
1.1.1 试验用药 土霉素标准品,中国兽医药品监察所产品;盐酸土霉素,河北健民淀粉糖业有限公司产品;二甲基甲酰胺、聚乙二醇200、六水合氯化镁,天津市福晨化学试剂厂产品;聚乙烯吡咯烷酮-K17,青岛优索化学科技有限公司产品;甲醛合次硫酸氢钠,天津市光复精细化工研究所产品;注射用水,河北农业大学动物医学院药理实验室自制。
1.1.2 主要仪器设备 HJ-4A数显恒温磁力搅拌器,金坛市医疗仪器厂产品;Sartorius AG-T214型电子天平、Sartorius PB-21酸度计,北京德国赛多利斯仪器系统有限公司产品;高效液相色谱,日本岛津公司产品。
1.2 方法
1.2.1 土霉素注射液中有效含量的测定
1.2.1.1 液相检测方法参数 高效液相色谱仪系统由日本岛津液相色谱仪、岛津SPD-20A紫外检测器、C18的sunfire色谱柱(250 mm×4.6 mm,5 μm)组成。流动相A为乙腈,流动相B为0.01 moL/L的三氟乙酸溶液,双泵等度洗脱。洗脱条件为:35%的A流动相,65%的B流动相,流速为1 mL/min,检测波长为350 nm,进样量为20 μL,运行时间为10 min。
1.2.1.2 标准品储备液和供试品储备液的配置 电子天平称取土霉素标准品0.001 g(精确到0.000 1位),用甲醇定容到1 mL,并且充分溶解,得到1 mg/mL的标准品储备液。同样的方法用土霉素原料药制备相同浓度的供试品储备液,两者放于冰箱置-4℃保存备用。
1.2.1.3 标准曲线的建立 将标准品储备液配成1 000、2 000、5 000、10 000、20 000、50 000 ng/mL浓度待测液。用高效液相色谱法进行测定,测定顺序由低到高依次进行,并记录不同浓度下的峰面积,根据浓度和对应的峰面积,建立标准曲线。应用标准曲线,建立外标法,用于土霉素注射液浓度的检测。
1.2.1.4 回收率的计算 将供试品储备液,用流动相溶液稀释为2 000、5 000、10 000 ng/mL浓度的待测液,通过检测不同浓度下的峰面积,并记录结果,计算得出质量浓度和回收率[8]。
1.2.2 土霉素注射液有机溶媒的筛选 通过预试验,比较多种有机溶剂的溶解力和价格。筛选出二甲基甲酰胺和聚乙二醇200两种有机溶剂。为确定二者最佳浓度比例,进行了以下试验。首先,将4个10 mL的透明西林瓶编号为1、2、3、4,并在每个瓶中加入500 μL的注射用水,加入相同剂量的络合剂六水合氯化镁和氧化剂甲醛合次硫酸氢钠,在常温下充分搅拌溶解。之后,将二甲基甲酰胺和聚乙二醇200按照如下梯度剂量:1.5 mL∶1.5 mL;2 mL∶1 mL;2.5 mL∶0.5 mL;3 mL∶0 mL,在10 mL的离心管中混合,配制成不同比例浓度的复合有机溶媒。将混合后的复合有机溶媒依次倒入编号1、2、3、4的西林瓶中。最后每个样品中分别加入相同剂量的聚乙烯吡咯烷酮和1.5 g的盐酸土霉素,充分浸润,在相同的温度下,转速为1 000 r/min,搅拌溶解。待溶液充分溶解后,降至至室温,加入乙醇胺调节pH至8.0~9.0。灌装后煮沸30 min。在自然条件下存放30 d。通过对比所制土霉素注射液加速试验前后的颜色、通透性、pH及注射液中有效成分的浓度变化来筛选最佳复合有机溶媒。
1.2.3 土霉素注射液制备工艺 根据制剂中各种成分的溶解性差异,以及土霉素高温易氧化的特点,设计以下2种制备工艺:
工艺1:将六水合氯化镁和甲醛合次硫酸氢钠与处方量的注射用水溶解,为A液;在45℃的条件下,将处方量聚乙烯吡咯烷酮K17和土霉素原料药与有机溶媒混合溶解,为B液;将A液和B液充分搅拌混合。温度降至室温后乙醇胺调节pH至8.0~9.0。过滤灭菌,氮气覆盖灌装。
工艺2:将处方量的注射用水置于锥形瓶中,首先加入六水合氯化镁和甲醛合次硫酸氢钠,常温搅拌溶解,后加入处方量的有机溶媒和聚乙烯吡咯烷酮K17,充分混匀溶解,接着加入盐酸土霉素,充入氮气,在45℃的条件下,充分搅拌溶解。温度降至室温后乙醇胺调节pH至8.0~9.0。过滤灭菌,氮气覆盖灌装。
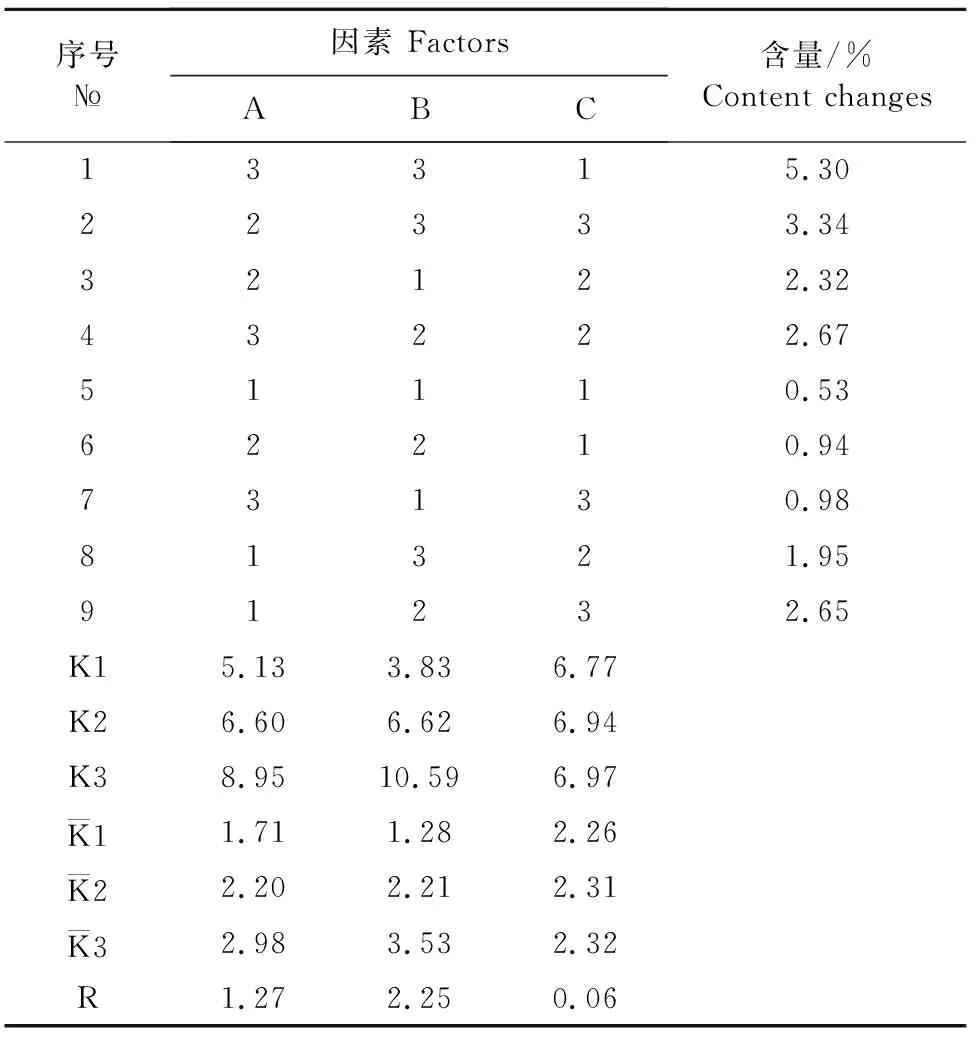
1.2.4 土霉素注射液组方筛选 通过1.2.2的试验中已经筛选出土霉素注射液中最优的有机复合溶媒,并通过预试验,确定土霉素注射液使用的稳定络合剂为六水合氯化镁,抗氧化剂为甲醛合次硫酸氢钠,缓释剂为聚乙烯吡咯烷酮K17,以及确定各个成分的范围。为了进一步确定土霉素注射液中这3个用量,通过SPSS设计一个三因素三水平的正交试验,如表1所示。并按照1.2.3中的工艺2的方法来制备土霉素注射液。以制备前后土霉素的有效含量的变化为考察因素,来讨论并确定土霉素注射液的最佳配方。

表1 正交试验表L9(33)
2 结果
2.1 样品检测方法的确定
土霉素注射液在加标样品处能有效分离出峰(图1)。并且空白对照(图2)与样品检测无干扰,显示该方法专属性良好。
根据不同浓度下,土霉素注射液的峰面积绘制的土霉素的标准曲线如图3所示。其中x表示土霉素在相应条件下的峰面积,y表示相对应的质量浓度。并根据计算得出标准曲线方程y=0.026 6x+575.45,R2=0.999 6。试验得出土霉素注射液在该检测方法下,在1 000 ng/mL~50 000 ng/mL范围内线性关系良好。
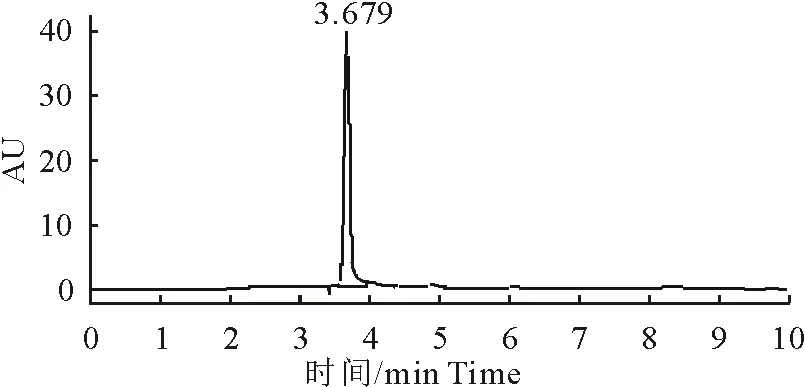
图1 土霉素标准液色谱图
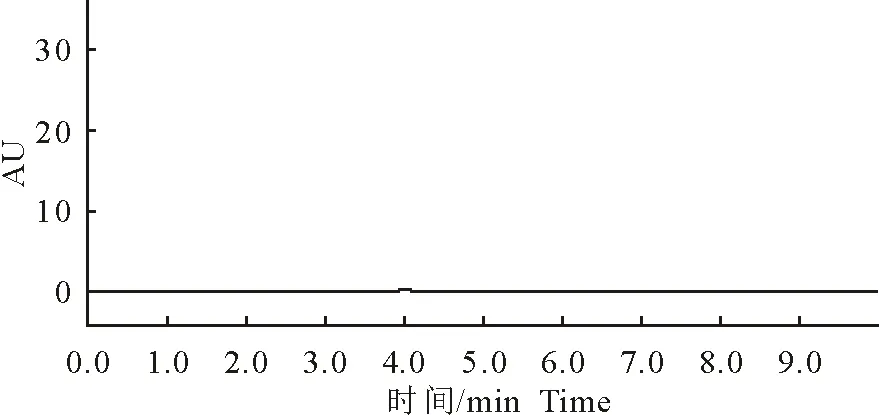
图2 土霉素注射液空白对照图

图3 盐酸土霉素的标准曲线
3个不同浓度下的供试品储备液的回收率试验结果如表2所示。结果为平均回收率为98.99%,标准偏差为2.35,变异系数为0.02%。显示该方法土霉素回收率极高,专一性良好。可以用作土霉素注射液有效含量的检测。
2.2 土霉素注射液有机溶媒的确定
在使用4个不同比例复合有机溶媒制作的土霉素注射液,经过相同的处理,静置1个月后,各项指标检测结果如表3所示。

表2 盐酸土霉素回收率试验结果

表3 不同比例有机溶媒中各项检测指标结果
根据试验结果显示,土霉素在4种不同比例复合溶媒下的颜色、澄明度、流动性及稳定性得出,土霉素注射液随二甲基甲酰胺的比例增加,土霉素注射液的稳定性也逐步升高。从图4中可得出,4个组溶媒中,第4组经过加速试验后,有效成分浓度最高。最终,选择纯二甲基甲酰胺作为土霉素注射液的溶媒,放弃聚乙二醇200。
2.3 土霉素注射液最佳配方的确定
根据表1,得出正交试验结果为表4,由极差(R)大小可以确定,C 根据试验得出的最佳配方,使用工艺1和工艺2同时制备3批注射液,比较2种工艺下土霉素制剂的外观和有效成分浓度,结果如表5。并通过spss进行独立样本t检验,结果见表6。 图4 不同比例有机溶媒下盐酸土霉素的质量浓度变化 序号№因素 FactorsABC含量/%Content changes13315.3022333.3432122.3243222.6751110.5362210.9473130.9881321.9591232.65K15.133.836.77K26.606.626.94K38.9510.596.97K11.711.282.26K22.202.212.31K32.983.532.32R1.272.250.06 注:A为甲醛贺辞硫酸氢钠,B为六水合氯化镁,C为聚乙烯吡咯烷酮K17。各因素的水平用量均参照表1添加。 Note:A. Sodium formaldehyde sulfoxylate;B.Magnesium chloride hexahydrate;C.Polyvinylpyrrolidone K17.The level of each factor is added with reference to Table 1. 表5 两种工艺制备土霉素注射液外观及含量 表6 以含量为指标进行独立样本t检验分析结果 《中国兽药典》(2015版)收录的标准溶剂为α吡咯烷酮,但是该溶剂溶解度低,黏度高,在实际生产中,多用于20%土霉素制剂的溶解,并且所制产品稳定性差。专利号为CN1156963A的土霉素注射液,利用甘油缩甲醛、聚乙二醇、氧化镁等开发出一种土霉素浓度为30%的组合物,但该组合物在低温下,虽然稳定性良好,黏稠度却高,而在高温下显示出较差的稳定性。通过大量筛选有机试剂,优选出二甲基甲酰胺作为有机溶媒。二甲基甲酰胺简称DMF,溶解力强,与水可以任意比例互溶,被称为“万能溶剂”[9]。二甲基甲酰胺应用于强力霉素、维生素B6、地塞米松和磺胺嘧啶等多种药物的有机溶剂,此外,还应用于肾上腺素、喹啉以及氨磺酰的优良溶剂[10]。该试剂作为溶媒制成的30%的土霉素注射液与其他溶媒相比较,表现出良好的流动性,并且生产成本降低[11]。 在工艺方面,通过比较2种工艺所制的土霉素注射液,外观上两组制剂无肉眼可见差异,通过检测有效成分浓度变化不显著(P>0.05)。工艺2与工艺1相比较,生产环节更简单省力,有效节约资源,故选择工艺2。 土霉素在溶液中呈游离状态,非常容易发生差向异构反应、水解反应、氧化反应和脱水反应,并且高温、酸性或碱性条件会加速这些反应[12]。我国要求的土霉素注射液的pH范围在8.0~9.0之间。为提高制剂的稳定性,本试验采用六水合氯化镁为络合剂,确定了含量为30%的土霉素注射液的使用的六水合氯化镁为11%。 在本产品中加入的聚乙烯吡咯烷酮(PVP)是一种绿色高分子产品。聚乙烯吡咯烷酮具有优异的溶解性、低毒性、化学稳定性、黏结能力等[13]。在医药工业中是一种良好的医药缓释剂和药物崩解剂[14]。土霉素注射液中应用相对分子量较小的聚乙烯吡咯烷酮 K17,一方面降低了注射液的黏稠度,另一方面在注射液注入动物肌肉时,能在注射部位,形成凝胶,使药物缓慢释放,增加药物作用时间,还能降低过高的血药浓度对动物机体造成的毒副作用[15-18]。 最终根据试验结果得出制备30%土霉素注射液的组方和工艺如下:六水合氯化镁11%,甲醛合次硫酸氢钠0.8%,注射用水5%,二甲基甲酰胺60%,5%聚乙烯吡咯烷酮K17,30%盐酸土霉素。 添加工艺为:将注射用水置于锥形瓶中,首先加入六水合氯化镁和甲醛合次硫酸氢钠,常温搅拌溶解,后加入处方量的有机溶媒和聚乙烯吡咯烷酮K17,充分混匀溶解,接着加入盐酸土霉素,充分搅拌溶解。 本试验开发的30%土霉素注射液,组方合理,添加工艺可行,用料来源广泛,价格经济,具有良好的市场应用前景。2.4 制备工艺的确定



3 讨论
3.1 添加工艺的选择
3.2 组方的确定

