二肽基肽酶-IV抑制活性酵母筛选与鉴别
王世博,李平兰,张金兰*
(中国农业大学 食品科学与营养工程学院,北京 100083)
糖尿病是慢性、全身性的代谢疾病,表现为糖代谢紊乱,可能会导致血栓、动脉硬化等血管病变[1],危害人体健康,减损寿命。糖尿病的发病率在近年来伴随着肥胖症状的增加而升高[2],2000年时全球有1.51亿糖尿病患者,2010年时达到2.85亿人[3],预计在2030年全球的糖尿病患者将达到3.66亿人[4]。二型糖尿病(type2 diabetes,T2D)也称非胰岛素依赖型糖尿病(noninsulin-dependent diabetesmellitus,NIDDM)。据推算我国的糖尿病患者中绝大部分为二型糖尿病,一型糖尿病的患者乃有不到5%[3]。
二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV)抑制剂是一类新兴的二型糖尿病治疗药物,通过抑制DPP-IV对肠泌素(incretin)的降解,维持或延长血液中肠泌素的降血糖效果,从而达到控制血糖的效果[5-6]。目前市场上已有的DPP-IV抑制药物价格昂贵,且存在一定的副作用,因此越来越多的研究着手于寻找天然食品来源(如鱼类、蛋类、乳类、大米)的DPP-IV抑制剂[7-11]。
本研究对酒醅中的酵母菌进行分离,对菌株的发酵上清液成分和胞内提取物成分的DPP-IV抑制活性进行了测定,筛选其中的DPP-IV抑制活性菌株,并对菌株进行生理生化试验和26SrDNA提取及鉴定,以期得到较高DPP-IV抑制活性的酵母菌菌株。
1 材料与方法
1.1 材料与试剂
酒醅:某酒厂提供;琼脂粉(生化试剂):北京酷来搏科技有限公司;酵母粉(生化试剂):英国Oxoid公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;酵母脱氧核糖核酸(deoxyribonucleic acid,DNA)小量提取试剂盒:美国Omega公司;DPP-IV抑制剂筛选试剂盒:美国Sigma公司;金牌 Mix(green)Golden Star T6 Super PCRMix(1.1×):北京擎科新业生物技术有限公司;琼脂糖(生化试剂):法国Biowest公司。
马铃薯葡萄糖肉汤(potatodextrosebroth,PDB)培养基:北京奥博星生物技术有限责任公司;马铃薯葡萄糖琼脂(potato dextroseagar,PDA)培养基的配制:每1L马铃薯葡萄糖肉汤培养基中加入20g琼脂粉,煮沸溶解,121℃灭菌20min,备用。
磷酸盐缓冲液-葡萄糖溶液的配制:配制磷酸盐缓冲溶液(phosphate buffer saline,PBS)(称取8 g NaCl、0.2 g KCl、1.44 g Na2HPO4和0.24 g KH2PO4溶于1 000 mL蒸馏水),每100mL磷酸盐缓冲溶液中加入2g葡萄糖,充分溶解,121℃灭菌20 min,备用。
酵母浸出物培养基、酵母浸出粉胨葡萄糖培养基(yeast extract peptonedextrose,YPD):北京奥博星生物技术有限责任公司。
1.2 仪器与设备
LEGEND MICRO 17台式高速离心机:美国Thermo Scientific公司;EF28 pH计:梅特勒-托利多仪器(上海)有限公司;MQD-S3 R恒温培养箱:上海晏泉仪器有限公司;FA1004电子分析天平:上海天平仪器厂;L9600D聚合酶链式反应(polymerasechain reaction,PCR)仪:莱普特科学仪器(北京)有限公司;Synergy HT多功能酶标仪:美国BioTek公司;BG-subMIDI多用途水平电泳仪:北京百晶生物技术有限公司;Tanon 1600全自动数码凝胶图像分析系统:上海天能科技有限公司。
1.3 方法
1.3.1 酒醅中酵母菌的分离
在无菌水中加入酒醅样品,振荡制成悬液,进行梯度稀释。选取合适稀释度涂布于PDA培养基平板,于30℃培养72 h。根据菌落形态和菌体形态挑取酵母菌单菌落,接种于马铃薯葡糖肉汤培养基,于30℃摇床培养72h。将酵母菌保存于瓷珠菌种保存管,-20℃冰箱贮存待用。
1.3.2 酵母菌发酵上清液的制备
将活化的酵母菌接种在PDB培养基中培养24 h,取菌液95℃水浴5 min灭活,4 000×g离心5 min,收集菌体,使用PBS洗涤3遍,悬浮于PBS-葡萄糖溶液,在30℃条件下培养2 h,4 000×g离心5 min,取上清液备用。
1.3.3 酵母菌胞内提取物的制备
将活化的酵母菌接种在PDB培养基中培养24 h,取菌液95℃水浴5 min灭活,4 000×g离心5 min,收集菌体,使用PBS洗涤3遍,使用超声破碎30 min(超声条件:功率30%,工作3 s停5 s),12 000×g离心5 min,取上清液备用。
1.3.4 生理生化试验
发酵糖类试验:使用杜氏管,管中加入10 mL试验糖浓度为50 mmol/L的酵母浸出物培养基(每1 L水中加入5 g酵母粉),接种100μL菌液,于25℃培养7 d。若最终杜氏管的小试管中有气体产生,则试验结果为阳性,无气体则为阴性。试验糖为葡萄糖、D-半乳糖、麦芽糖、蔗糖、乳糖、淀粉、纤维二糖。
碳源同化试验:在试管中加入10 mL使用试验碳源替换葡萄糖的YPD培养基(每1 L水中加入10 g酵母粉、20 g蛋白胨、20 g试验碳源),接种100μL菌液,于25℃培养7 d。若酵母菌能够正常生长,则试验结果为阳性,不能生长则为阴性。试验碳源为:D-半乳糖、L-山梨糖、D-核糖、D-木糖、L-鼠李糖、蔗糖、麦芽糖、纤维二糖、乳糖、菊糖、棉子糖、D-甘露糖、海藻糖、柠檬酸。
1.3.5 26SrDNA鉴定
采用酵母DNA小量提取试剂盒提取酵母基因组。提取后的DNA可直接进行PCR扩增。引物采用NL-1(5'-gcatatcaataagcggaggaaaag-3')、NL-4(5'-ggtccgtgtttcaagacgg-3')[12],PCR反应使用即用型快速PCR预混液,反应体系(50μL)为:预混液45μL、引物NL-12μL、引物NL-42μL、模板1μL。PCR反应程序为:98℃、2 min;98℃、10 s,62℃、10 s,72℃、10 s,36个循环;72℃、5 min,4℃保温。PCR产物由北京诺赛基因组研究中心有限公司进行测序,测序结果使用美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站基本本地比对搜索工具(basic local alignment search tool,BLAST)与GenBank中的数据进行比对,下载近缘物种菌株的26SrDNA序列,使用MAGA 10.0.4软件中ClustalW工具件进行匹配排列,之后利用MEGA软件绘制系统发育树[13],进而确定酵母菌株的种属。
1.3.6 DPP-IV抑制活性测定
DPP-IV抑制活性使用DPP-IV抑制剂筛选试剂盒进行测定,反应后用酶标仪测定样品的荧光值(FLU)(输出波长λex=360 nm/输入λem=460 nm)。其中样品加入DPP-IV和底物;阴性对照采用试剂盒中的缓冲液代替样品;阳性对照不加入样品同时加入DPP-IV抑制剂;空白对照采用缓冲液代替DPP-IV。各组的反应体系如表1所不。
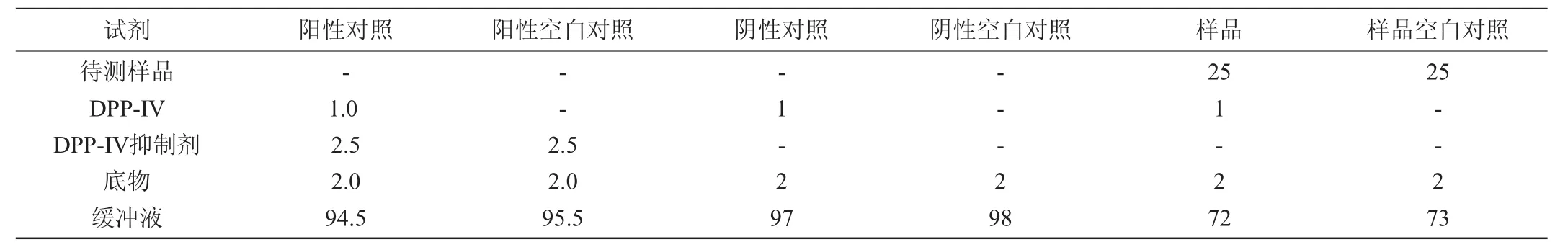
表1 DPP-IV抑制活性测定体系Table1 System of DPP-IV inhibitory activity determination μL
样品的DPP-IV抑制率计算公式如下:

式中:FLU样品为样品的荧光值,FLU样品空白对照为样品空白对照的荧光值,FLU阳性对照为阳性对照的荧光值,FLU阳性空白对照为阳性空白对照的荧光值,FLU阴性对照为阴性对照的荧光值,FLU阴性空白对照为阴性空白对照的荧光值。
2 结果与分析
2.1 不同酵母菌株DPP-IV抑制率
本实验中共检测了28株酵母菌(编号J1~J28)发酵上清液与胞内提取物的DPP-IV抑制活性。菌株的DPP-IV抑制率如表2所不。DPP-IV抑制率数值越大,表明菌株对DPP-IV的抑制活性越强;抑制率数值为负值表不该菌株非但不能对DPP-IV有抑制作用,反而会促进DPP-IV催化底物的反应。
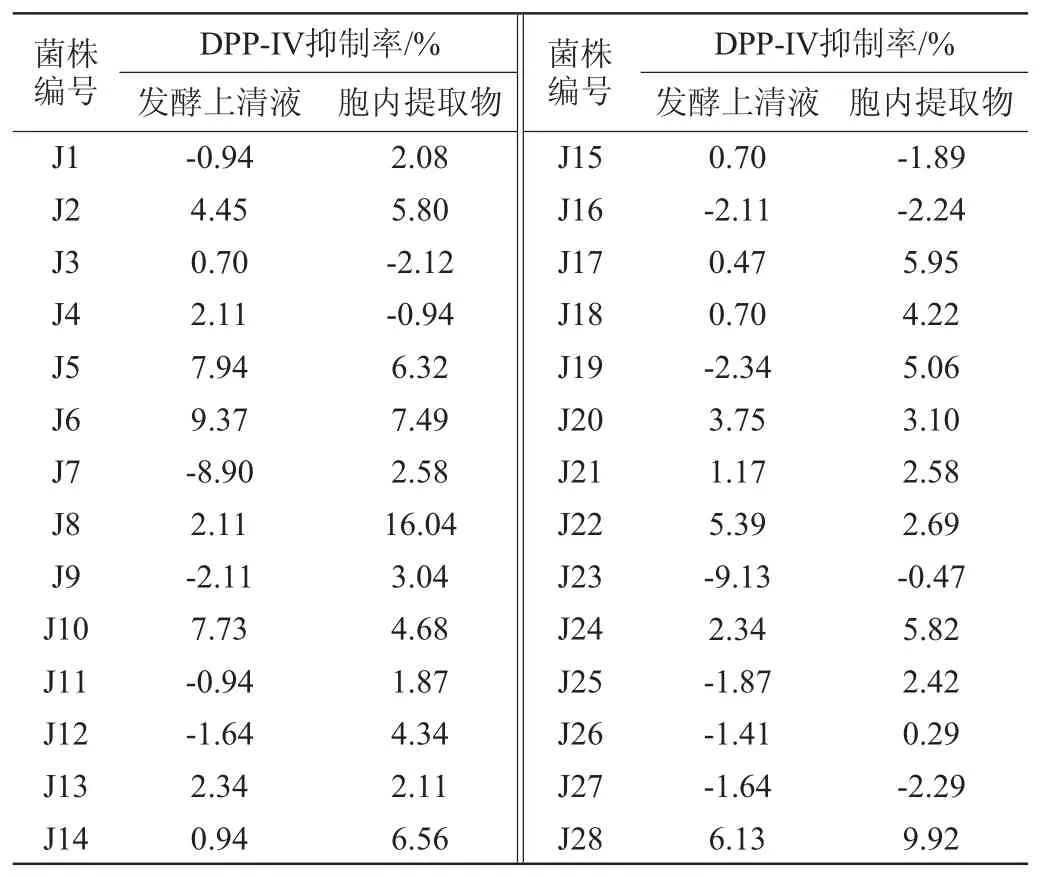
表2 不同菌株发酵上清液与胞内提取物的DPP-IV抑制活性Table2 DPP-IV inhibitory activity of the fermentation supernatant and intracellular extract from different strains
由表2可知,菌株J6发酵上清液DPP-IV抑制率最高,为9.37%;菌株J8胞内提取物DPP-IV抑制率最高,为16.04%。
2.2 菌株鉴定
菌株J6及J8的菌落形态及细胞形态见图1。

图1 菌株J6及J8的菌落形态及细胞形态Fig.1 Colony morphology and cell morphology of strain J6 and J8
由图1可知,菌株J6菌落圆形,边缘整齐,表面光滑有光泽,呈乳白色,不透明;细胞呈卵圆形。菌株J8菌落圆形,中央凸起,边缘稍呈波状,表面粗糙无光泽,成白色,边缘半透明;菌株J8菌落呈圆形,边缘整齐,呈乳白色,细胞呈卵圆形。
通过生理生化反应,菌株J6与菌株J8对不同糖类的发酵情况如表3所不,对不同碳源的同化情况如表4所不。
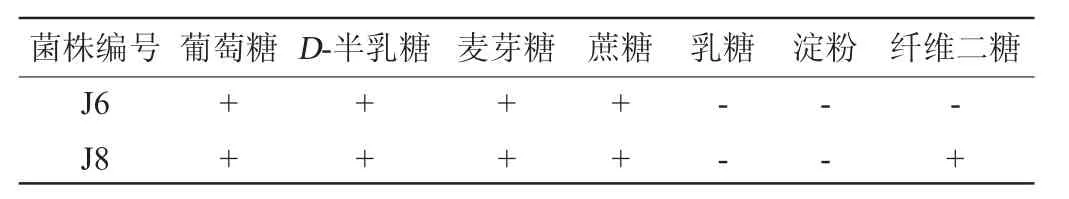
表3 糖发酵试验结果Table3 Results of sugar fermentation test

表4 碳源同化试验结果Table4 Results of carbon source assimilation test
由表3和表4的结果,根据《酵母菌的特征与鉴定手册》初步判断菌株J6为酿酒酵母(Saccharomyces cerevisiae),菌株J8属于酵母属(Saccharomyces sp.)。
通过试剂盒提取酵母菌菌株J6与J8的基因组。通过引物NL-1与引物NL-4对基因组进行PCR扩增,对扩增产物进行琼脂糖凝胶电泳,结果如图2所不。

图2 菌株J6、J8 PCR扩增产物电泳结果Fig.2 Electrophoresis results of PCR amplified products of strain J6 and J8
由图2可知,2株菌在500~750 bp之间有明显的条带,长度约为600 bp。经过测序,菌株J6的26SrDNA序列长度为618bp,菌株J8的26SrDNA序列长度为607 bp。通过BLAST比对,从GenBank获取近缘物种的26SrDNA序列,构建系统发育树,结果如图3所不。

图3 基于26S rDNA序列构建的系统发生树Fig.3 Phylogenetic tree based on 26S rDNA sequence
由图3可知,菌株J6与Saccharomyces cerevisiae strain NS-G-52、S.cerevisiae strain A48存在较高同源性(96%~97%),应同为酿酒酵母(Saccharomycescerevisiae);菌株J8与菌株Wickerhamomycesanomalus isolate HN1、W.anomalus strain H4、W.anomalus strain NS-G-34、W.anomalus strain A4存在较高同源性(95%~97%),应同为异常威克汉姆酵母(Wickerhamomycesanomalus)。
3 结论
在本研究中,得到两株对DPP-IV有抑制活性的酵母菌:菌株J6为酿酒酵母(Saccharomycescerevisiae),菌株J8为异常威克汉姆酵母(Wickerhamomycesanomalus)。在某些微生物体内,如乳杆菌[14]、双歧杆菌[15]中,也发现有天然的DPP-IV抑制剂存在,这些微生物可以作为益生菌或工程菌投入生产,开发具有降血糖作用的药物或功能食品。在本研究中,发现在酵母菌的发酵上清液与胞内提取物中存在DPP-IV抑制活性,此发现在国内外尚属首次。酵母菌在食品工业中有广泛的用途,在馒头、面包等主食、酒类、酱油、食醋等食品的生产过程有重要的作用。在近年来随着糖尿病发病率的上升,开发新型降血糖功能食品逐渐成为一种趋势[16]。在食品的生产过程中使用有DPP-IV抑制活性的酵母菌菌株作为功能性酵母进行发酵,或在食品中添加提取自酵母DPP-IV抑制活性的提取物,有助于开发有降血糖作用的功能食品[17]。
目前已有的研究表明,来自膳食中蛋白质的数种肽可以作为DPP-IV的竞争性抑制剂产生DPP-IV抑制活性[18]。在乳杆菌中,胰蛋白酶处理后的细菌上清液DPP-IV抑制活性特异性增加,表明其DPP-IV抑制活性物质是肽[19]。据此推测在酵母菌中,发挥DPP-IV抑制作用的也是肽。本研究表明,酵母菌存在DPP-IV抑制活性,菌株J6与菌株J8的抑制活性较高。在之后的研究中,将会对DPP-IV抑制活性物质进行分离纯化,研究活性物质在人体消化吸收过程中的变化,并选育具有更高DPP-IV抑制活性的酵母菌菌株,为开发具有高DPP-IV抑制活性的功能性酵母菌奠定基础。

