一株海藻酸降解菌产酶条件的优化
王艳华,丁 涓*,李帅军,景春雷
(鲁东大学 生命科学学院,山东 烟台 264000)
山东省烟台市长岛县是海带(Saccharina japonica)的大规模养殖地区之一,同时其近岸海域保持了接近原生态的环境,保有天然大型海藻组成的海藻场。在这独特的生境中分布的很多独特海洋微生物,通过分泌褐藻酸裂解酶能够分解海带细胞间质和细胞壁中的褐藻酸,这些海洋微生物大量增殖能够引起多种海带病害,并造成严重的经济损失[1-2];然而天然褐藻酸以及工业中广泛应用的褐藻酸盐,经生物酶降解后得到的褐藻寡糖具有抗肿瘤、抗凝血、抗氧化作用及抗炎症增强免疫等活性,此外能够促进多种植物的根部生长,延长植物生命周期[3]。目前已发现60多种褐藻酸裂解酶,主要来源于海洋藻类、软体动物、海洋细菌、陆生真菌及少数噬菌体和病毒[4-9]。通过富集褐藻附生菌并进行筛选是获得高产酶量新菌株的有效途径,具有重要的理论意义和明确的应用前景。本研究以长岛县近岸独特微环境中生长海带的腐烂组织作为材料,筛选出降解褐藻酸的新菌株,运用分子生物学方法鉴定其种属;并对该菌株的最优产酶条件进行了优化,以期为进一步工业化开发利用性状稳定且高产褐藻酸酶的褐藻酸降解菌提供借鉴。
1 材料与方法
1.1 材料与试剂
腐烂的海带:山东省烟台市长岛县南长山岛海滩采集,地理坐标为37°55′N,120°44′E,共计0.5 kg,用采样袋收集。
硫酸镁,氯化钠,磷酸氢二钾(分析纯):国药集团化学试剂有限公司;海藻酸钠(化学纯):天津市河东区红岩试剂厂。
筛选培养基:海藻酸钠6g/L,琼脂20g/L,NaCl 25g/L,K2HPO42 g/L,MgSO41 g/L,(NH4)2SO42 g/L,pH=7,121℃灭菌20 min。
液体培养基:海藻酸钠6g/L,NaCl25g/L,K2HPO42g/L,MgSO41 g/L,(NH4)2SO42 g/L,pH=7,121℃灭菌20 min[7]。
1.2 仪器与设备
6PX-198F生化培养箱:宁波江南仪器厂;TDL-5离心机:上海隆拓仪器设备有限公司;SW-CJ-1CU超净工作台:苏州安泰空气技术有限公司;QYC-211全温度恒温培养振荡器:金坛盛蓝仪器有限公司;Gel-Doc2000凝胶成像分析仪:美国Bio-Rad公司。
1.3 方法
1.3.1 褐藻酸降解菌的筛选
在超净工作台中,用剪刀剪去海带腐烂组织盛放于培养皿,用适量无菌水将培养皿中的样品反复清洗3次,用移液枪吸取菌液稀释10 000倍。吸取上述稀释的菌液200μL,再涂布到配制好的筛选培养基内[10]。在生化培养箱中设置22℃、27℃、32℃温度梯度,倒置培养72 h。测量得到的单菌落形成的透明降解圈直径,并记录菌落特征。选取其中透明降解圈最明显的菌株作为重点菌株进行研究。
1.3.2 16SrDNA鉴定和构建系统进化树
提取目标菌落的脱氧核糖核酸(deoxyribonucleic acid,DNA),利用通用引物27F:5'-AGAGTTTGATCCTGGCTCAG-3'和1492R:5'-TACGGCTACCTTGTTACGACTT-3'进行聚合酶链式反应(polymerasechainreaction,PCR)扩增,扩增产物送至上海生工进行测序。将测序结果进行Blast比对,获取16SrDNA基因序列同源性最高的菌群,用MEGA7.0中的邻接(neighbor-joining,NJ)法构建系统进化树,对其进行分析鉴定。
1.3.3 响应面试验设计
结合此菌的实际培养条件和之前报道的相似菌株较优的单因素结果[11-12]。采用Box-Behnken中心组合设计,以温度(X1)、转速(X2)、pH(X3)、接种量(X4)为自变量,以酶活力(Y)为响应值设计4因素3水平试验,中心组合试验方案中的因素及水平如表1所不,数据用Design-Expert 8.0进行分析[13-16]。

表1 海藻酸降解菌产酶条件优化响应面试验因素与水平Table1 Factors and levels of response surface experiments for enzyme-producing conditions optimization of alginatedegrading bacteria
1.3.4 测定方法
采用之前优化过的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法检测酶活力[11]。首先将发酵得到的菌液在4℃、12 000 r/min条件下离心10 min,取上清液即为粗酶液。将1.0 mL粗酶液与1.0 mL 0.75%褐藻酸钠溶液(用pH 7.0的磷酸缓冲液配制)混合,40℃水浴反应20 min;反应后的体系中再加入1.5 mL DNS,沸水浴反应5 min,迅速用流动水冷却;定容,测定波长540 nm处的吸光度值。
酶活力:给定温度和pH条件下,每分钟催化产生1μg还原糖所需的酶量为一个酶活单位(U)。
比活力:每毫升发酵液所含的酶活力单位[4,11-12],U/mol。
2 结果与分析
2.1 菌种筛选
经过筛选,在22℃条件下筛选得到3个菌落,菌落均成乳白色,表面光滑但无明显的透明降解圈出现;在27℃条件下得到多个菌落周围有透明降解圈产生,如图1(a)所不。在32℃条件下,无菌落产生。因此说明最适的培养温度为27℃,在该温度条件下得到了能在以海藻酸钠作为唯一碳源,分泌降解海藻酸钠的胞外酶能力较强的菌株[11,17-19]。其中菌株B2形成的菌落呈乳白色,圆形,湿润,并形成最大的透明降解圈,选取菌株B2作为重点菌株,分离单菌落并进行纯培养。

图1 27°C条件下培养产生的透明降解圈(a)和菌株B2在10×100倍油镜下的细胞形态(b)Fig.1 Transparent degradation zones(a)produced at 27℃and cell morphology(b)of strain B2 under 10×100 times oil immersion lens
由图1(b)可知,菌株B2经结晶紫染色在油镜下观察,菌体小而密集,以成对或链状排列,具圆端或方端,堆积排列,成短杆状,初步判断是杆菌。
2.2 16SrDNA鉴定及系统发育树构建
将筛选得到的菌株B2用液体培养基分别在摇床中振荡培养。培养温度设置为27℃,转速为180 r/min,培养72 h。将10 mL菌液8 000 r/min离心去上清,用试剂盒提取基因组DNA。DNA提取和PCR的电泳结果及测序结果见图2。
图2结果显不,提取的基因组DNA在每个泳道的合理位置都出现了一条清晰的条带,提取结果良好的样品可以用于下一步PCR扩增;PCR扩增出一条约1 500 bp大小的条带;PCR扩增产物经过测序得到的16SrDNA序列为1 331 bp。PCR产物序列通过美国国立生物技术信息中心(national center for biotechnology information)网站中的Blast程序进行比对,得到Ident值95%以上的菌株近40株,说明与此菌株序列相似的,并且已经发现的菌株较多,其中登录号为NR_043733的副球属菌株(Paracoccushomiensis)的相似度达到了99%。
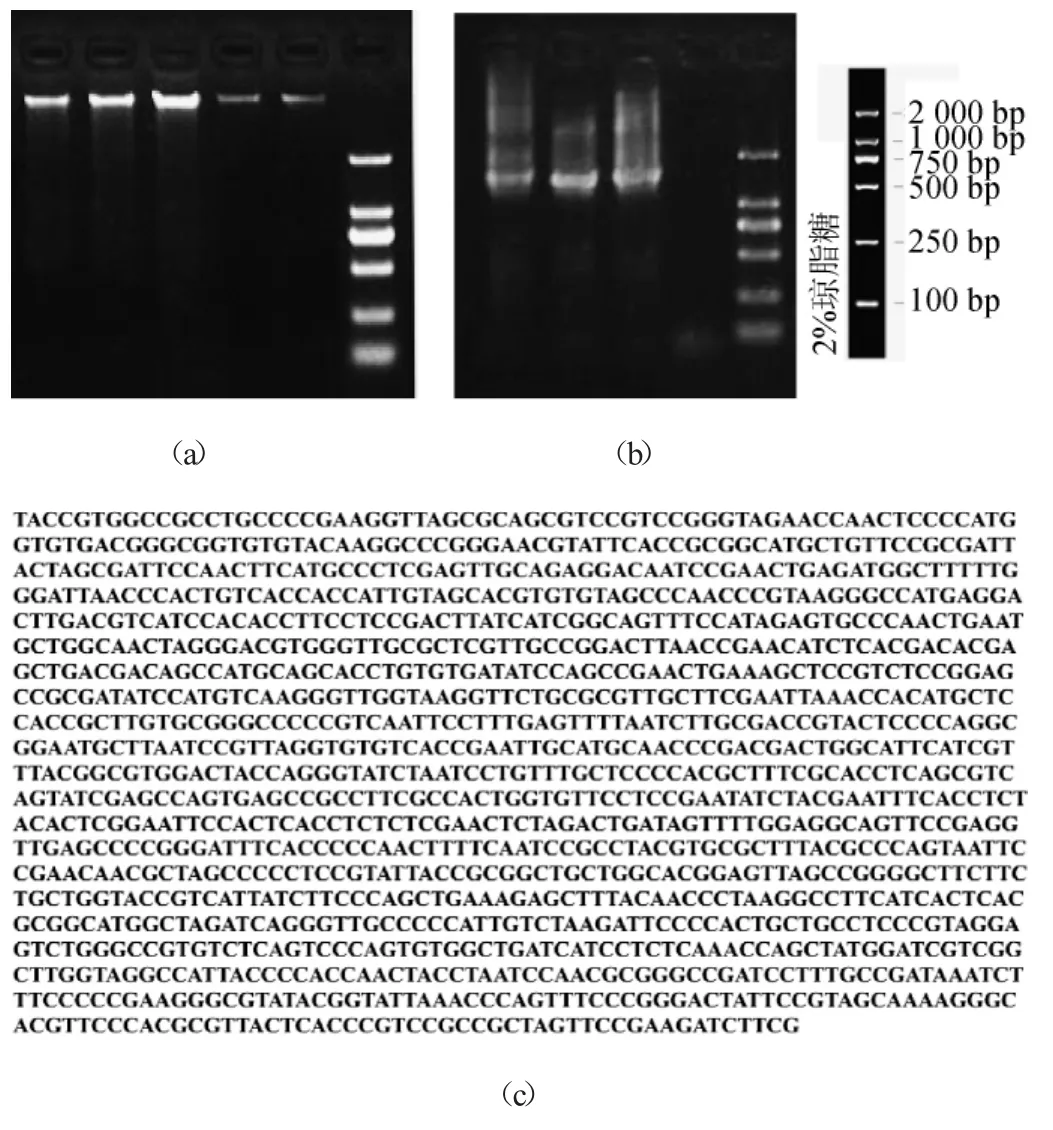
图2 菌株B2的DNA提取结果(a)、PCR扩增产物琼脂糖凝胶电泳验证结果(b)和测序结果(c)Fig.2 Results of DNA extraction,agarose gel electrophoresis verification of PCR product and sequencing of strain B2
选取19个与菌株B2同源性较高且已定名的菌株的16SrDNA基因序列信息进行序列对比,并截取高重复序列,进行系统发育分析,通过MEGA7.0的Neighbor-Joining法构建的系统进化树见图3[6,20-21]。

图3 基于16S rDNA序列分析的菌株B2的系统发育树Fig.3 Phylogenetic tree of strain B2 based on 16S rDNA sequence analysis
从图3可以看出,B2菌株和Paracoccus homiensis(NR-043733)从同一结点进化而来,说明两者同为副球属。同时菌株B2的进化分枝比Paracoccushomiensis的进化分枝长,说明菌株B2进化距离较远。Bootstrap检验值为99,说明进化树所表不的两种菌株之间的进化关系可信。对比已有的报道,Paracoccushomiensis菌株在含有海藻酸钠的液体和固体培养基中生长良好,并且产生的大量海藻酸裂解酶催化解聚海藻酸钠。根据菌株B2和Paracoccushomiensis的16SrDNA基因数据的相似性,可以进一步判断菌株B2属于副球属(Paracoccus)[22]。
2.3 响应面试验优化发酵工艺
以温度(X1)、转速(X2)、pH(X3)、接种量(X4)为考察因素,以酶活力(Y)为响应值,进行响应面试验设计,试验结果见表2,方差分析见表3。

表2 海藻酸降解菌产酶条件优化响应面试验设计与结果Table2 Design and results of response surface experiments for enzyme-producing conditions optimization of alginatedegrading bacterium
经过Design Expert软件对试验数据进行多元回归拟合,获得酶活力为目标函数的二次回归方程:Y=43.24+0.31X1+0.25X2+0.25X3+0.22X4-4.13X1X2+5.05X1X3+5.35X1X4+1.32X2X3+。对模型进行回归分析的结果见表3。模型的F=15.05,P<0.000 1,效果明显,说明该模型显著;模拟失拟项F=5.27,P=0.061 6>0.05,表明失拟项不显著;R2=0.937 7表明线性关系明显,模式调整确定系数0.875 4,证实该模型能阐述87.54%相应值得变化,总体证实响应面效果对试验吻合情况较好,试验误差小。
由图4可知,任何2个交互因素的响应面都存在最高点;由三维立体图可以看出,两两因素之间的影响均呈基本抛物线型,说明有一个最大值[15-18]。根据响应面优化结果,影响酶活力的最佳条件理论值为温度24.8℃,转速146.3 r/min,pH值为7.0,接种量8.44%,理论最高酶活力为44.2 U/mol。为方便实际操作,调整培养条件为温度25℃,转速150r/min,pH值为7.0,接种量8%,经过3次平行试验,测得褐藻酸裂解酶的酶活力为43.6 U/mol,与模型预测值的误差为1.345%,与预测值相吻合。后续将不断优化培养条件并对菌株进行改造,来进一步提高此菌株的产酶能力,使之能够满足相关产品的工业化应用要求。

表3 回归模型的方差分析Table3 Variance analysis of regression model

图4 温度、转速、pH、接种量交互作用对酶活力影响的响应面曲线及等高线Fig.4 Response surface plots and contour line of effects of interaction between temperature,rotational speed,pH and inoculum on enzyme activity
3 结论
通过对病变腐烂的海带组织上的微生物进行选择性培养基筛选,对比所产生的透明圈直径,筛选出了高效降解海藻酸的菌株B2。对此菌株的16SrDNA基因序列进行同源性比对,并通过构建系统进化树分析进化关系,确定此菌株为副球属(Paracoccus)。利用响应面试验设计优化了该菌株产酶条件。得到最佳发酵产酶条件为温度25℃,转速150 r/min,pH值为7.0,接种量8%,在此条件下,褐藻酸裂解酶的酶活力为43.6 U/mol。本研究将对褐藻寡糖以及褐藻酸降解酶制剂等海洋来源的高值化产品的开发与应用产生显著的作用。

