明胶/姜黄素纳米纤维电纺膜皮下环境构建组织工程软骨的可行性研究
KANG BO KYOUNG 陈维明 周广东 曹德君
目前,基于软骨细胞的软骨组织构建及缺损修复已在多种动物体内获得成功,但尚未能够成功应用于临床,重要的原因之一就是种子细胞来源存在问题[1-2]。自体软骨细胞仍是目前软骨再生的重要种子细胞来源,但自体软骨细胞来源有限,取材会造成新的创伤,体外扩增后易老化和去分化并丧失软骨再生能力。因此,以具有多向分化能力的干细胞为种子细胞成为研究热点[3]。但本课题组前期研究中发现,BMSC体外构建的软骨在皮下环境极易发生血管化、骨化,最终导致软骨再生失败,不利于在非关节环境中的应用(如耳、鼻、气管等部位)[4]。Pelttari等[5]发现,血管化是影响BMSC体内软骨再生稳定性的关键因素。发育生物学研究证实,软骨内骨化的关键启动因素是血管化。因此,抑制血管化是提高BMSC体内软骨再生稳定性的关键[4-9]。
姜黄素是最早由Pelletier等[5]从姜黄的根茎中分离得到的一种酚类天然药物,因其抗肿瘤谱广,不良反应小,美国国立肿瘤研究所已将其列为第3代肿瘤化学预防药物[10]。大量研究证明,姜黄素具有广泛的生理活性作用,不但能保护受损的正常细胞,也能抑制肿瘤细胞的增殖[10-16]。姜黄素具有抗肿瘤血管生成作用,可通过抑制VEGF及其对应受体,明显抑制荷瘤小鼠艾氏腹水癌模型实体肿瘤的血管形成,说明姜黄素是一种特异性血管生成抑制剂[11-12]。但能否应用负载姜黄素的支架材料,在动物皮下环境中构建软骨未见相关报道。
应用负载姜黄素的支架材料进行软骨再生构建,其主要难点是如何有效地负载姜黄素并实现缓释作用。因为姜黄素是非水溶性的物质,材料制备过程中,将其均匀地分散到材料中并实现缓释,是一个难题。电纺膜可通过油剂溶剂进行制作,并与溶脂性药物均相混合。姜黄素可以溶解到该体系中,随着材料的降解逐渐释放。因此,本研究采用电纺膜方式制备支架,以明胶支架作为载体来负载姜黄素。姜黄素均匀分散到整个电纺纤维膜上,并随着明胶材料的缓慢降解,逐步释放姜黄素以实现载药缓释的目的。
本研究的主要目标是证明负载姜黄素的支架材料能否用于软骨再生。因为干细胞诱导软骨再生过程中,有很多复杂的影响因素。所以本研究首先以软骨细胞作为种子细胞进行探讨。
1 材料与方法
1.1 实验动物
新西兰大白兔5只(甲干生物有限公司),雌雄不限,体质量4~5 Kg;裸鼠30只(中科院动物所),雌雄不限。按照动物实验保护指南进行动物实验。
1.2 实验材料
高糖DMEM培养基(Gibco公司,美国),胎牛血清(Hyclon公司,美国),Ⅱ型胶原酶(Worthington公司,美国),胰蛋白酶(Hyclone 公司,美国),姜黄素(百灵威试剂公司),明胶(阿拉丁试剂公司)。
1.3 种子细胞的获取与扩增
剪取兔耳软骨,洗净,切成1 mm×1 mm×1 mm大小,加入5倍体积的0.25%胶原酶摇床消化过夜;75 μm 孔径滤网过滤,1 500 r/min 离心 5 min,PBS漂洗2遍,以含10%FBS的高糖DMEM配成细胞悬液,按2×106个/皿(直径10 cm培养皿)接种细胞,置入5% CO2、37℃培养箱培养[1-2]。细胞达90%融合时进行传代[17]。本实验所用细胞均为第2代软骨细胞。
1.4 材料的制备及分组
将Gelatin溶于六氟异丙醇中,质量体积比12%(w/v)。PLA 溶于六氟异丙醇中,质量体积比 8%(w/v)。Gelatin溶液与PLA溶液按照10∶3的体积比混合,静电纺丝。纺丝参数:电压15 KV,推进速度3 mL/h,接受距离15 cm。EDC/NHS交联溶液配制:0.5 g EDC和0.3 g NHS溶于100 mL的95%乙醇中。将纳米纤维膜浸泡于交联液中12 h,去离子水冲洗,冷冻干燥。姜黄素溶液配制:将2 mg姜黄素溶于乙醇中(含5%冰醋酸),将纳米纤维膜浸泡于姜黄素溶液中2 h,去离子水冲洗,冷冻干燥。
单纯明胶纳米纤维电纺膜为对照组,明胶/姜黄素纳米纤维电纺膜为实验组。取对照组、实验组材料分别植入BALB/c裸鼠背部皮下,每组各2只,6周后取材行大体观察。
1.5 细胞-支架复合物的制备
用直径5 mm的角膜环钻将明胶纳米纤维电纺膜(对照组)和明胶/姜黄素纳米纤维电纺膜(实验组)处理成直径5 mm的圆形膜片,环氧消毒处理,紫外线消毒30min备用。根据本实验室的前期研究结果,用“三明治”法构建细胞-支架复合物[1-2,4]。 将第2代软骨细胞用培养液制备成100×106cells/mL浓度的细胞混悬液,用显微镊将纳米纤维电纺膜按照“电纺膜-细胞悬液-电纺膜”的方式叠加,每层约加入6 μL细胞悬液,共叠加6层;在 5%CO2、37℃培养箱中培养40 min后,小心加入含10%FBS的高糖DMEM至覆盖复合物后继续培养。每3日换液一次[1-2,4]。
1.6 扫描电镜观察
单纯材料:将明胶纳米纤维电纺膜(对照组)和明胶/姜黄素纳米纤维电纺膜(实验组)用剪刀剪切成小片(半圆形,直径5 mm),导电胶固定,喷金,在10 KV的加速电压下,扫描电镜观察静电纺纳米纤维的形貌[2]。每个试样取3个平行样品。
细胞-支架复合物:消化收集软骨细胞,将直径5 mm的明胶纳米纤维电纺膜(对照组)和明胶/姜黄素纳米纤维电纺膜(实验组)放入24孔板内,加入浓度为100×106cells/mL的软骨细胞至覆盖复合物,置于37℃、5%CO2培养箱培养2周,复合物取出后2.5%戊二醛固定,扫描电镜观察。
1.7 细胞增殖率检测
将环氧乙烷消毒的直径5 mm的圆形膜片放入24孔板中,加入6 μL浓度100×106cells/mL的软骨细胞悬液,置于5%CO2、37℃培养箱,40 min后小心加入含10%FBS的高糖DMEM培养液至覆盖复合物后继续培养。分别于第2、4、6、8天,向对照组和实验组每孔中加入10 μL的CCK-8溶液,继续孵育。4 h后将24孔板里的溶液轻轻吸除,移到96孔板中,多功能酶标仪检测450 nm处的吸光度[1-2,4]。
1.8 组织学检测
取兔耳软骨细胞,接种于单纯明胶支架 (对照组)及相同规格的姜黄素/明胶支架(实验组),体外培养1周后分别植入BALB/c裸鼠背部皮下左右两侧(左侧对照组,右侧实验组)。分别于植入后3周、12周时取出,行组织学检测(HE、番红O-固绿、Ⅱ型胶原免疫组化染色)[1-2,4]。
2 结果
2.1 材料形貌观察
SEM显示对照组电纺膜纤维分布较密集,孔隙比较小;实验组电纺膜纤维相比对照组略稀疏、孔隙较大(图 1)。
2.2 电镜下细胞在支架上的黏附情况
软骨细胞接种于两组支架材料2周后进行SEM观察,结果显示,两组支架材料上细胞分布均匀,黏附良好,均显示出良好的细胞相容性,但对照组材料表面细胞黏附程度略差于实验组(图2)。
2.3 细胞-支架复合物的细胞增殖率检测
用CCK-8试剂盒进行体外培养细胞-支架复合物的细胞增殖率检测,结果显示,对照组第3天生长曲线下降明显,第4天开始上升;实验组第3天生长曲线略有下降,第6天开始慢慢上升。实验组细胞增殖能力相比对照组略有下降,但无显著影响(图3)。
2.4 单纯材料皮下植入后大体观察
复合物皮下植入6周后行大体观察,结果显示,对照组有明显的血管化现象,而负载姜黄素的实验组周围血管化受到明显抑制,提示姜黄素具有明显的血管抑制作用(图4)。
2.5 细胞-支架复合物体内构建的大体观察
复合物体外培养1周后植入裸鼠皮下,体内培养3周、12周时,两组均形成了具有一定弹性的软骨样组织,直径、大小无明显改变,但随着体内培养时间延长,“三明治”式复合物的形态有所破坏。从外观上看,3周、12周时实验组标本均呈现淡黄色外观,提示姜黄素的缓释时间可持续12周以上(图5)。
2.6 细胞-支架复合物体内构建的组织学观察
组织学显示,3周、12周时两组均有软骨陷窝形成。体内培养3周,实验组软骨陷窝形成较对照组更为明显;体内培养12周时,两组均有成熟的软骨陷窝形成,组间明显差异,提示负载姜黄素未对皮下环境的软骨再生产生明显的不良影响(图6-7)。

图1 两组支架大体与电镜观察Fig.1 Gross view and SEM observation of the two groups

图2 两组复合物大体观与电镜观察Fig.2 Gross view and SEM observation of the cell-scaffold complex in the two groups
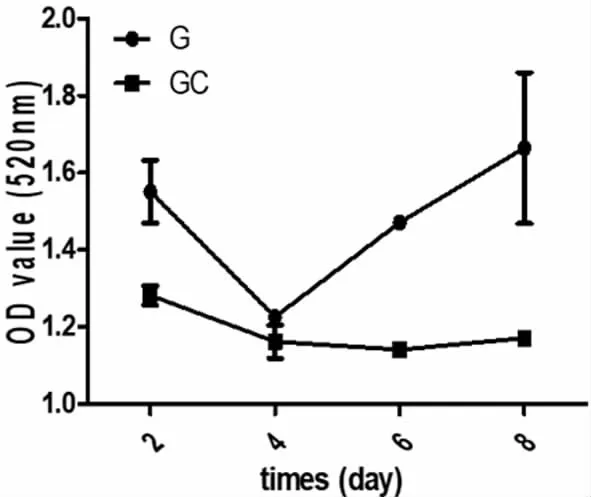
图3 两组复合物的细胞生长曲线Fig.3 Growth curve of the chondrocyts in the two groups
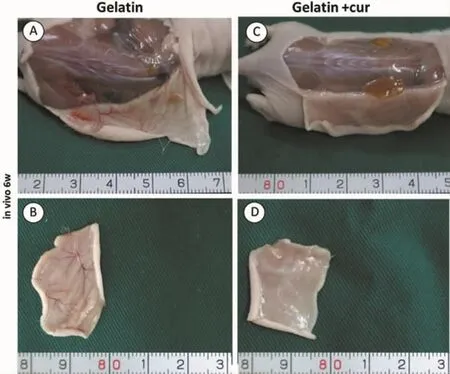
图4 单纯材料皮下植入后大体观察Fig.4 Gross observation of material after subcutaneous implantation

图5 细胞-支架复合物体外、体内构建的大体观察Fig.5 Gross view of the cell-scaffold complex cultured in vitro and in vivo

图6 体内培养3周组织学观察(标尺:500 μm)Fig.6 Histological observation in each group after cultured for 3 weeks in vivo(scale bars:500 μm)
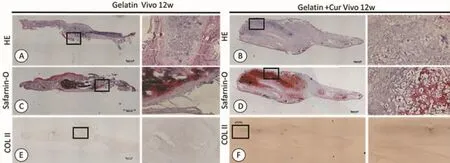
图7 体内培养12周各组组织学观察(标尺:500 μm)Fig.7 Histological observation in each group after cultured for 12 weeks in vivo(scale bars:500 μm)
3 讨论
目前,BMSC体外构建软骨在皮下环境中异位骨化是公认的难题。一般认为,异位骨化主要与血管化有关。因此,解决此难题的关键在于抑制血管化。
相关文献表明,姜黄素具有抗肿瘤血管生成作用,可通过抑制VEGF及其对应受体,明显抑制荷瘤小鼠艾氏腹水癌细胞形成实体肿瘤的血管,说明姜黄素是一种特异性血管生成抑制剂[11-12]。组织工程研究中,使用软骨细胞体外构建的软骨样组织植入皮下后可以形成稳定的软骨,很少发生骨化。但是,利用BMSC体外构建的软骨植入皮下后,却极易发生血管侵入和基质钙盐沉积,不能形成稳定的软骨组织。皮下环境不利于BMSC诱导的软骨生长,而且单纯BMSC诱导的软骨植入皮下后,其产生的抗血管化因子不足以抵抗皮下环境中的促血管化因子,造成失衡。但是,能否利用姜黄素抑制血管化来调控干细胞的异位骨化,目前没有相关的报道。本研究拟说明3个问题:其一,如何实现姜黄素的持久缓释;其二,姜黄素是否在体内环境中具有血管抑制作用;其三,负载姜黄素的支架是否适合软骨再生。
本研究表明,①姜黄素是非水溶性的物质,可采用电纺膜技术通过油剂溶剂将姜黄素均匀地分散至材料中,负载姜黄素的电纺膜支架材料通过材料的缓慢降解,逐步地释放姜黄素,以达到持久缓释的目的。本实验中,负载姜黄素的电纺膜支架材料体内植入12周内,淡黄色一直存在,说明姜黄素的缓释时间可以持续12周以上。②本研究将两种复合物植入裸鼠皮下后行大体观察。结果显示,实验组观察到明显的血管抑制现象,这对于后期进一步研究姜黄素通过抑制血管化来调控干细胞的异位骨化至关重要。③考虑到干细胞诱导软骨再生过程中有很多复杂的影响因素,本研究首先以软骨细胞进行实验,探讨姜黄素应用于皮下软骨细胞再生的可行性。电镜观察显示,负载姜黄素以后,材料细胞分布均匀,黏附良好,显示出良好的细胞相容性;细胞增殖率实验显示,实验组细胞增殖能力相比对照组略有下降,但影响不明显。组织学观察显示,3周、12周时两组复合物均有软骨陷窝形成,无明显差异,提示负载姜黄素未对皮下环境的软骨再生形成明显的不良影响。
本研究表明,姜黄素对软骨细胞生长无害,皮下环境下药物降解速度缓慢,不引起炎症反应,对软骨细胞无明显破坏。本研究结果对于未来应用姜黄素参与BMSC软骨构建,提供了重要的支持。
4 结论
通过电纺纤维技术可以实现姜黄素的持久缓释,姜黄素具有明显的血管抑制作用,而且负载姜黄素支架对软骨再生无明显不良影响。明胶/姜黄素材料可作为支架在动物皮下构建组织工程化软骨组织,是一种具有潜在应用前景的支架材料。

