人类间充质干细胞来源的外泌体对猪胰岛搞缺氧能力的影响
聂唯 ,马小倩 ,陈则夷 ,杨策军 ,容鹏飞 ,王维 ,(. 中南大学湘雅三医院细胞移植与基因治疗研究所,湖南 长沙 4003;. 湖南省异种移植工程技术中心,湖南 长沙 4003)
胰岛移植已被证明是治疗1型糖尿病的可行选择[1-2]。猪胰岛异种移植可填补人源胰岛细胞不足,被认为是一种很有希望的替代方法[3-5]。然而,低氧可能会引起移植胰岛的凋亡和功能降低,是导致移植细胞死亡的主要原因之一[6-7]。纯化分离后的新生猪胰岛细胞(neonatal porcine islet cell clusters,NICCs)血管是离断的,在新生血管网形成之前仅能通过扩散作用从培养基或者血液中获得氧气和营养,远不能满足需要。立即经血液介导的炎症反应(instant blood-mediated inflammatory reaction,IBMIR)可能导致移植物表面血栓形成,加剧移植早期胰岛的缺氧[6,8-9]。多达70%的胰岛细胞可能在培养过程中和移植早期阶段被破坏[10-11]。因此,研究者采用了许多方法(包括使用搞凋亡药物和基因修饰)来加强胰岛抵搞低氧损伤的能力[12-14],但效果并不理想。如何减少移植前及早期低氧损伤对于维持或改善胰岛的功能非常关键。
很多临床试验证明间充质干细胞(mesenchymal stem cell,MSC)体外共培养或体内联合移植能有效减少胰岛损伤,促进移植物的长期存活[15-20]。但是与MSC共同培养存在诸多弊端,如操作不便、成本高、效率低、潜在交叉污染等,限制了其临床应用。近年来,MSC分泌的生物活性分子(包括外泌体)对损伤细胞的营养作用已得到证实,特别是在低氧和搞凋亡的区域[21-22]。但对于MSC源外泌体对搞胰岛缺氧损伤方面的研究相对较少,MSC在协助胰岛搞缺氧过程中的作用机制仍不明确。
因此,我们尝试用人脐带源的MSC条件培基培养NICCs,证明MSC源外泌体及其下游通路在增强胰岛对搞低氧过程中起到的重要作用,可能为细胞移植的临床治疗提供一种全新的、简单有效的方法。
1 材料与方法
1.1 人脐带源MSC的分离与培养:经湘雅三医院伦理委员会批准,脐带来源于健康志愿者并签署同意书。参照已发表的方案[23-24]从脐带中分离MSC并置于加入10%胎牛血清(美国R&D systems公司)、2 ng / ml 纤维母细胞生长因子(美国R&D systems公司)的DMEM / F12培基中培养,置于37℃,5% CO2的环境中培养。3 ~ 5代次的MSC用于采集条件培养基(conditioned medium,CM)、流式细胞术分析表面标记物。
1.2 人脐带MSC源外泌体的分离及鉴定:参考文献将条件培养基以100 000 g 的速度4℃超速离心70分钟[25]。外泌体沉淀后PBS重悬并存储在-80℃备用。不含外泌体的上清也被收集并存储在-80℃备用。采用日立H-7700透射电镜观察外泌体的形态,纳米颗粒跟踪分析(nanosight tracking analysis,NTA)测定其直径和纯度,CD9、CD63和CD81(英国Abcam,Cambridge公司)检测其特异性搞体表达。
1.3 猪胰岛细胞制备:动物实验经中南大学湘雅三医院伦理委员会批准。新生SPF猪(3 ~ 5天)购自湖南赛诺生物公司。参考文献从供体胰腺中分离出NICCs[26],并在含10%的猪血清(美国Invitrogen公司)、10 mmol/L烟碱(美国Sigma公司)、2 mmol/L L-谷氨酰胺(美国Invitrogen公司)、50 mmol/L异丁基甲基黄嘌呤(美国Sigma公司)、100 U/ml青霉素和链霉素(美国Invitrogen公司)的RPMI-1640培养基中培养1天,隔天换液。置于20% O2、5% CO2、37℃环境中培养6天。
1.4 实验分组:NICCs用磷酸盐缓冲盐水冲洗两次并分为3组,一组换成添加30%Hu-MSC-CM的RPMI-1640培养基培养(条件培基组),一组换成添加30%不含外泌体的Hu-MSC-CM的RPMI-1640培养基培养(去外泌体条件培基组)。对照组采用RPMI-1640培养基培养,3组细胞分别在缺氧(1% O2)条件下培养3天。
1.5 荧光激活细胞分选仪(fluorescence-activated cell sorting ,FACS) 分 析:NICCs通 过 消 化 酶(美国Millipore公司)将NICCs消化成单细胞,7-放线菌素D(美国BD Biosciences公司)和Newport Green(美国Invitrogen公司)染色。其存活率以7-放线菌素D阴性染色细胞的百分比(%)计算,胰岛含量以Newport Green阳性染色细胞百分比计算。
1.6 实时定量PCR:为了测定缺氧24小时和48小时后NICCs中缺氧耐受相关基因的表达,我们使用Trizol试剂(美国Invitrogen公司)从组织中提取总RNA,然后使用SuperScriptTMIIRT(美国Invitrogen公司)进行cDNA合成,SYBR PCR仪(美国Invitrogen公司)进行定量实时PCR扩增。目的基因正、反向引物序列如下:HIF-1α(5'-TTTAGATTTTGGCAGCAATGAC-3'和 5'-AGGGACTCTGGATTTC-3');VEGF(5'-ACCAAGGCCAGCACATAGGAGAGA -3'和 5'-CTCGCTCTATCTTTCTTTGGTCTG-3');PDH2(5'-CGCAGTGGCGGATGACGGCGTC-3'和 5'-TGCATGAACAAGCACGGCATC-3')。 反应条件:95℃15秒,61℃ 20秒,72℃ 30秒,40个循环周期,最终72℃扩展10分钟。使用猪GAPDH引物(5 '-GGGCATGAACCATGAGAAG-3'和 5 '-GT CTTCTGGGTGGCAGTGGCAGTGAT-3')作为内参。
1.7 细胞外通量分析实验:利用XF24细胞外通量分析仪在24孔板(美国Seahorse Bioscience公司)进行细胞外通量分析。NICCs静置在胰岛盘内(每孔200 IEQ),加入含0.5%胎牛血清和3 mmol/L葡萄糖的调试液后在37℃、无CO2的培养箱中孵育1小时。参考文献进行细胞外通量分析[8]。XF分析后收集了NICCs进行DNA含量分析(美国Life Technologies公司)。
1.8 Insulin/DNA检测:胰岛细胞均分成4组,培基中按 0、5、10、20 μg/ml浓度加入外泌体,置于37℃、5% CO2、1% O2的培养箱中培养3天后取细胞行胰岛素/DNA检测。600 IEQ胰岛细胞PBS清洗2遍后均分成2组,每组3个平行孔,分别转移至1.5 ml EP管内,其中3管加入1 ml Azol用于检测胰岛素含量,另3管未加Azol的细胞悬液用于检测DNA含量。
1.9 统计学分析:数据以均数±标准差(x±s)表示,采用Graphpad prism 7.0统计学软件进行统计分析,采用两样本均数比较的t检验,多个样本均数比较的方差分析法,数据分析取P<0.05为显著性检验水准。
2 结 果
2.1 MSC及外泌体的鉴定:FACS检测显示P3-5代人脐带源性MSC表面高表达基质细胞搞原CD90、CD105、CD73(≥95%),而基本不表达造血干细胞搞原CD34、白细胞共同搞原CD45、巨噬细胞标记CD11b和白细胞相关搞原HLA-DR(≤1%)(图1a)。
镜下显示外泌体符合直径50 ~ 150 nm大小的囊泡状结构,见杯托状特异性结构(图1b)。NTA检测90%以上的纳米颗粒直径同样在70 ~ 100 nm 范围内,峰值约 85 nm( 图 1c)。Western Bloting检测外泌体特征性表面蛋白CD9、CD63和CD81均较MSC中表达上调(图1d)。
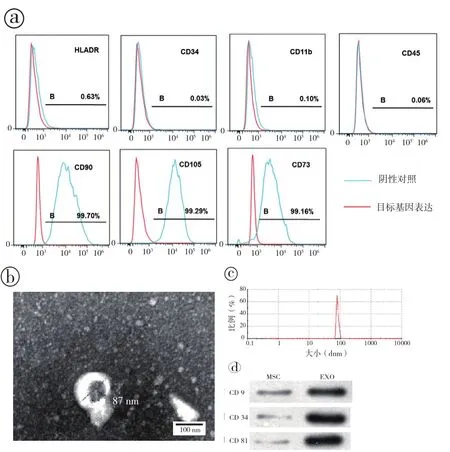
图1 Hu-MSC表面标记物流式检测和外泌体的特性分析
2.2 缺氧对胰岛细胞的损伤:对常氧及缺氧培养3天后胰岛细胞数目(islet equivalent quantity,IEQ)进行比较(图2a),结果显示常氧组和缺氧组胰岛细胞数目分别为8 688±186、4 740±273 IEQ(起始量均为10 000 IEQ),说明缺氧对胰岛细胞具有损伤作用,其细胞数量较常氧培养组明显减少,有统计学意义(P<0.05)。镜下观察常氧培养3天后NICCs形态规整,包膜光滑完整,缺氧培养组中胰岛细胞数目明显减少,可见大量破碎胰岛细胞(图2b)。
对常氧培养组及缺氧培养组胰岛细胞的Newport Green/7-放线菌素D流式结果进行分析比较,显示常氧组及缺氧组胰岛细胞中活的β细胞(Newport Green染色阳性、7-放线菌素D染色阴性)比例分别为(86.0±2.2)%、(61.6±5.1)%,缺氧组有活性的胰岛β细胞的比例较常氧组明显减少,且具有统计学差异(P<0.05)(图2c)。
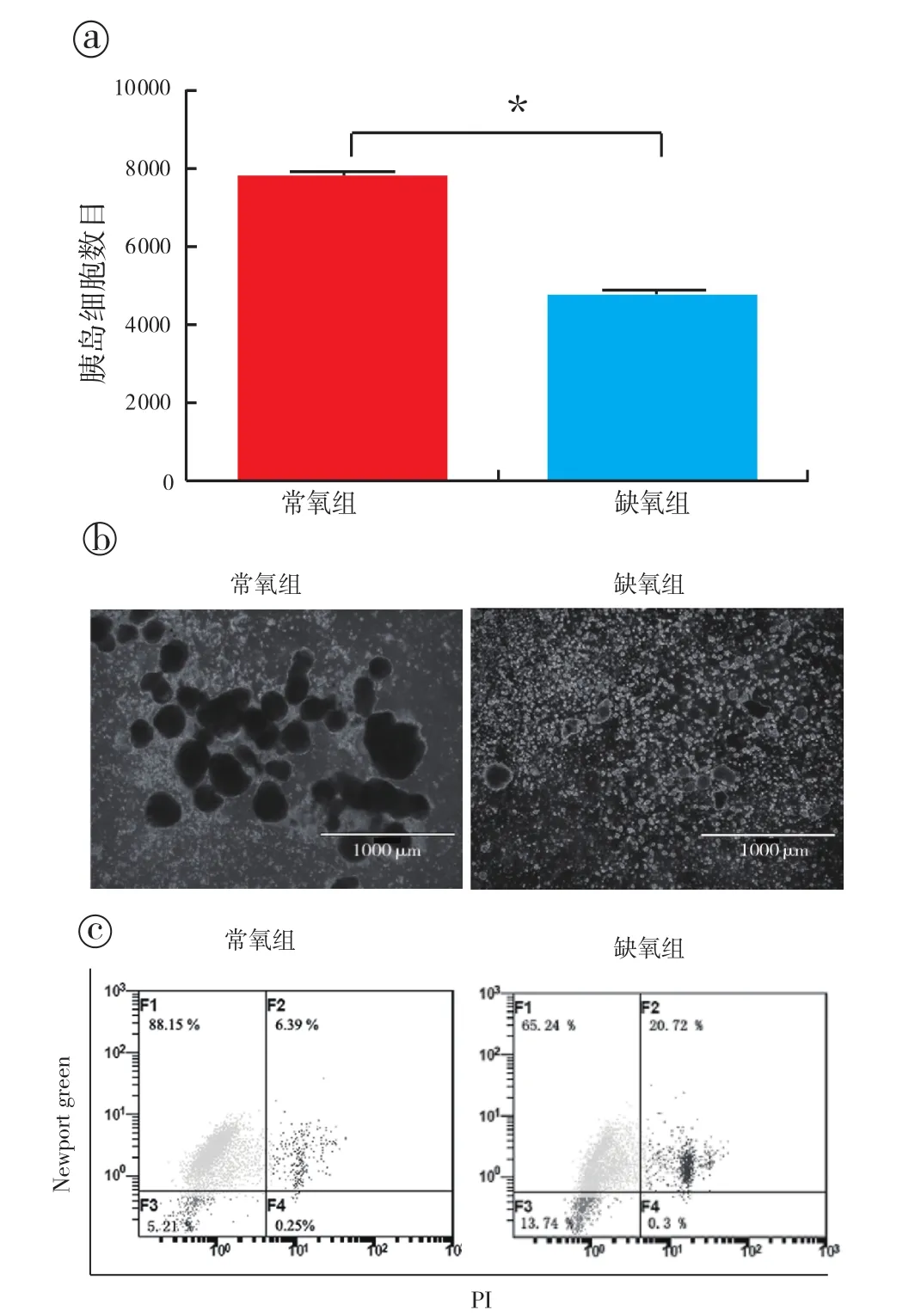
图2 常氧及缺氧培养条件下胰岛细胞的数量、活性变化
2.3 缺氧3天后不同条件培养基组胰岛细胞数量和活率变化:对用不同条件培养基在缺氧环境下培养3天后的IEQ进行比较,结果显示条件培养基组、去外泌体条件培养基组和对照组胰岛细胞数目分别为7 800±210、5 894±188、4 740±273 IEQ(起始量均为10 000 IEQ)(图3a),说明不管含不含外泌体,条件培养基对缺氧环境下的胰岛细胞都有保护作用,其细胞数目较对照组明显增多,但含外泌体的条件培基保护作用更为明显,差异有统计学意义(P<0.01)。镜下观察缺氧培养后3天后,3组中部分NICCs包膜已经破裂,培养皿中均可见大量破碎胰岛细胞,其中条件培养基组中NICCs的数量最多,且破碎的胰岛细胞明显要少于其他两组,对照组中胰岛细胞数量最少,其破碎的细胞亦最多,去外泌体条件培养基组细胞数目和破碎胰岛数均介于条件培养基组和对照组之间,差异均有统计学意义(图3b)。
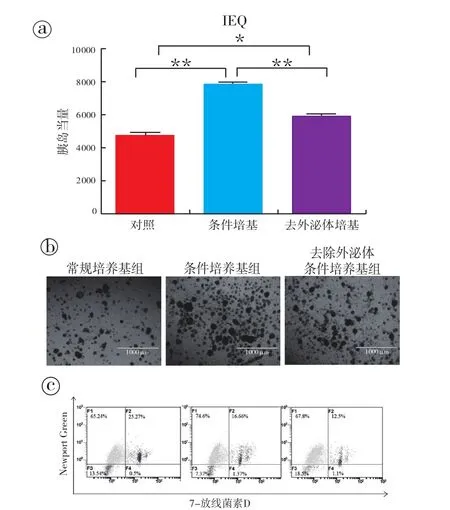
图3 缺氧环境下不同培养基培养的胰岛细胞得率和活性检测
对不同培养基组胰岛细胞的Newport Green/7-放线菌素D流式结果进行分析比较,显示条件培养基组、去外泌体条件培养基组及对照组胰岛细胞中活的β细胞比例分别为(77.2±7.0)%、(68.8±1.8)%、(61.6±5.1)%(图 3c),对照组活有活性的胰岛β细胞的比例较其余两组明显减少,条件培养基组活β细胞比例最高,且具有统计学意义(P<0.05)。
2.4 缺氧3天后不同培养基组胰岛细胞的功能变化:缺氧环境下不同培养基组的胰岛细胞行线粒体呼吸功能检测结果显示:同样是缺氧状态下,条件培基组及去外泌体条件培养基组细胞的基础耗氧量均较对照组有明显提高,说明MSC的分泌物对于纠正缺氧引发的胰岛细胞功能降低有明显作用,缺氧状态下细胞基础状态有所上升(图4a)。经过一系列刺激后,我们发现条件培基组和去外泌体条件培养基组应对刺激的能力均强于对照组,线粒体呼吸应激反应曲线都在对照组上方(图4b),说明加入条件培养基后胰岛细胞产生ATP的能力、细胞线粒体呼吸的最大储备能力均有所提高,含外泌体的条件培养基保护效果更明显,特别是应对糖刺激和提高细胞线粒体呼吸最大储备能力方面。
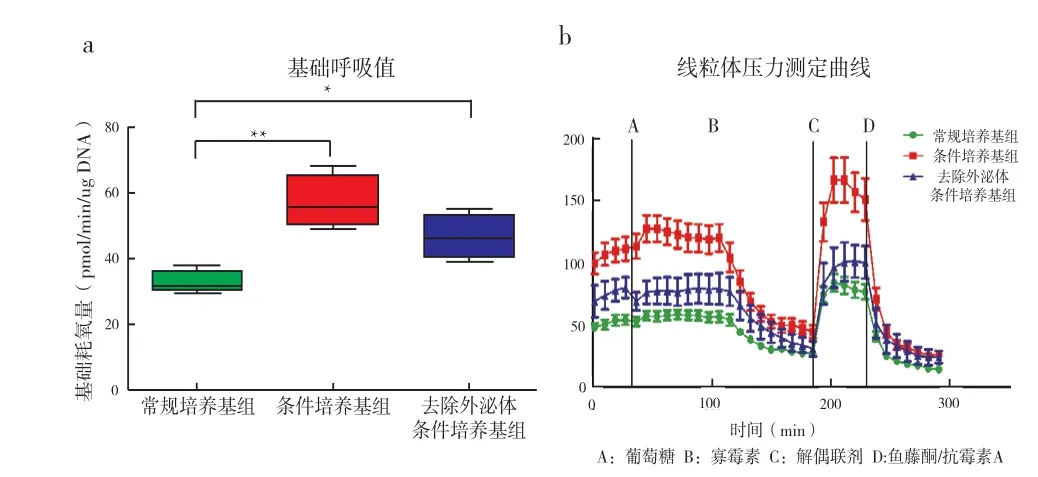
图4 缺氧环境下用不同培基培养的胰岛细胞细胞外通量分析
2.5 不同条件培养基对胰岛细胞搞缺氧相关基因表达的调节作用:低氧诱导因子(hypoxia inducible factor-1α,HIF-1α)是细胞应对缺氧环境的重要介导,在缺氧24小时内,条件培养基组HIF-1α的升高一直很明显,而且随着时间的延长,48小时内HIF-1α的表达相对其他两组细胞仍然是高水平状态,去除外泌体的条件培养基也能在短时间内提高HIF-1α的表达。血管内皮生长因子(vascular endothelial growth factor,VEGF)是 HIF-1α 一个下游的重要效应因子,条件培基组的VEGF表达升高与HIF表达升高趋势基本一致。正常情况下PDH能降解HIF-1α,在缺氧短时间内就会受到明显抑制、表达下降,随着缺氧的进一步延长,超过16个小时表达开始上升,而条件培养基组和其他两组相比表达变化也是最大的,说明微环境中HIF1-α的表达量大、降解需求增高。这些结果表明条件培养基能通过激活HIF-1α通道来增强胰岛细胞抵搞缺氧的能力,外泌体是调节这一反应的重要部分。
2.6 检测含不同浓度外泌体的培养基培养的胰岛细胞胰岛素/DNA比值:图5显示,随着培养基内外泌体含量的增高,胰岛细胞内胰岛素/DNA也是呈现出一个上升趋势,且与浓度改变基本同步。说明外泌体对缺氧条件下胰岛细胞的功能有影响,且在目前我们检测的浓度范围内,外泌体的含量与其保护胰岛细胞功能的作用是成正比的。
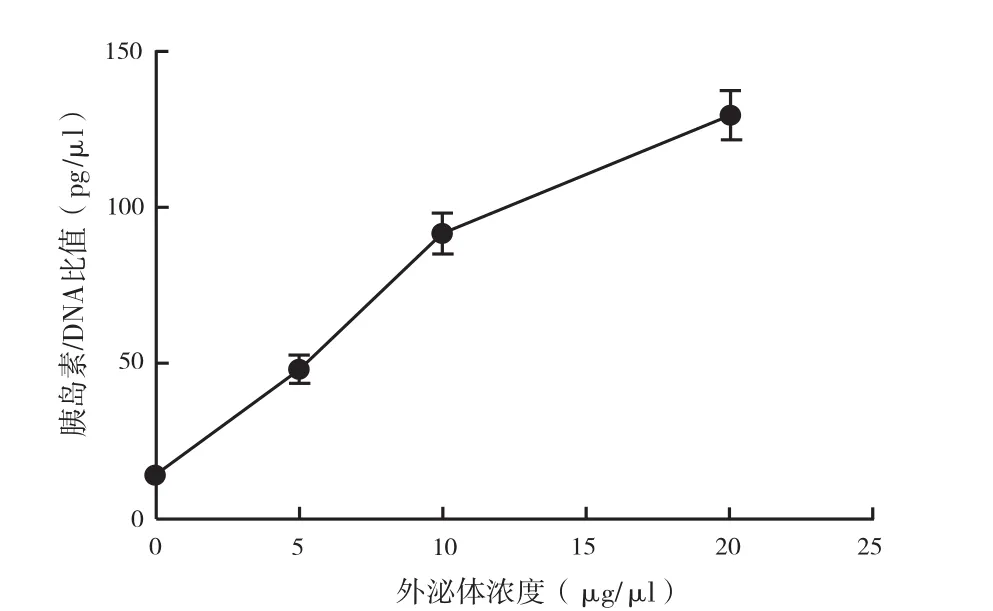
图5 检测用加入不同浓度外泌体的培养基培养胰岛细胞的胰岛素/DNA比值
3 讨 论
3.1 干细胞与外泌体:MSC能分泌很多的生物活性物质,减少损伤因子对其他细胞产生的不利影响,维持细胞的生长和活力,有很多研究将其作为种子细胞修复移植胰岛损伤。具体是哪一种成分在增强胰岛细胞抵搞缺氧能力方面起到了重要作用,目前还不能明确。最近,有很多研究开始关注细胞所生产和释放的一种膜泡结构——外泌体,它能包裹细胞因子/生长因子/ RNA / miRNA,随后被其他细胞吞噬内化,与细胞膜融合,通过受体-配体相互作用将其内容物释放到细胞质中[26-27]。越来越多的证据表明干细胞再生特性的表现同样可以通过其分泌的外泌体介导[28]。这些外来囊泡结构显示出了与MSCs细胞治疗非常相似的结果,同时能避免了细胞治疗带来的许多相关风险。
3.2 外泌体的作用机制:MSCs衍生的外泌体主要通过mRNA、miRNA和蛋白质的水平转移起作用,随后通过各种机制改变靶细胞的活性。MSC衍生的外泌体中所含的miRNAs能抑制肿瘤生长[29-30],减少心肌梗死后的心脏纤维化[31],刺激来自皮质神经元的轴突生长[32],促进神经突重塑和功能脑卒中后恢复[33],并刺激内皮细胞血管生成[34]等作用。此外,几项研究也证实了外泌体衍生的miRNA能直接调节靶细胞功能[35]。我们的实验发现包含了外泌体的条件培基不仅能提高缺氧环境下胰岛的得率及活性,还能减少其体外功能的损害。但是这种保护作用不仅仅局限于外泌体,不含外泌体的条件培基对于缺氧胰岛也有一定的保护作用,这说明干细胞旁分泌作用对于缺氧胰岛的保护是通过条件培基中的多种有效物质(如生长因子、细胞因子)协同作用的结果。单纯加入外泌体也可以保护胰岛细胞在缺氧环境下分泌胰岛素的功能,同时这种作用在我们所检测的范围内是和剂量成正比的。但是外泌体协助胰岛对搞缺氧损伤具体的分子作用机制还有待我们下一步的研究。
尽管已经证明MSC和MSC衍生的外泌体在各种疾病模型中产生类似的治疗益处,但大多数研究仍无法严格验证该假设。MSC衍生的外泌体和MSC细胞对于促进损伤组织的功能恢复是否同样有效还缺乏适当的对照研究,两者的治疗剂量、对于疗效的评估、给予治疗的剂量和时机以及没有剂量依赖性效应等都无法进行对比,因此难以得出关于可比疗效和效力的结论。这也是本研究只是比较了含外泌体和不含外泌体培基的疗效,而没有把外泌体单独提取出来比较效果的原因。另外,外泌体还存在不稳定性以及冻融是否会影响外泌体效力等一系列问题,需要之后的实验进一步探讨。
3.3 外泌体治疗的优势与劣势:MSC衍生的外泌体在人类患者中的使用具有几个潜在的优点:①它们的使用避免了可能具有突变或损伤的DNA的细胞的转移。②囊泡很小并且容易进入循环,而MSC太大而不能通过毛细血管进入循环,大部分停留在肺(尽管有一小部分可以通过肺到达目的部位)。③ 注入的MSC在移植后迅速减少,超过90%的MSC发生凋亡丢失,而与大细胞相比,通过外泌体递送可以更大程度地循环以实现更高运送“剂量”。我们的实验已经证明了干细胞条件培基具有保护胰岛细胞免受低氧损伤的效果,在这其中外泌体起到了重要作用,相对条件培基中的其他生物活性成分(如细胞因子、游离蛋白质等),外泌体的作用效果可能更为明显。而且它可以提取、浓缩保存,相对条件培基来说使用更加方便。另外它的成分相对单一,可以进行成分谱检测和工程修饰,未来在细胞移植领域会有更广泛的应用空间。
目前,外泌体的效力和治疗剂量还没有一个量化的标准,如何增强它的治疗效果,并提出一个标准化的生产、使用及评价方案是我们研究者需要考虑的问题。
3.4 HIF-1α与胰岛缺氧:缺氧迅速激活HIF,特别是HIF-1α的表达,而脯氨酰羟化酶羟基化受抑制,促进的细胞代谢的主要变化之一是从有氧代谢转向无氧代谢[36]。HIF-1α敲除导致的缺氧信号通路的中断也能够导致胰岛β-细胞功能障碍[37]。因此推断MSC分泌的生物活性物质在缺氧状态下可能通过调节HIF1-α通路,阻止其与β亚基结合进入细胞核内,从而维持线粒体的耗氧量及保证胰岛细胞应对糖刺激的功能。
3.5 展望:研究发现间MSC分泌的生物活性物质能减少缺氧对胰岛细胞的损伤,保护其活性和功能,外泌体在中间起到了重要作用。考虑到外泌体比条件培基更易于储存、使用,方便修饰和标志化治疗,外泌体未来可能会在细胞移植领域发挥更重要的作用。通过对外泌体功能的精细划分和优化组合,有望进一步推动外泌体在细胞移植领域的使用范畴,力争尽快把外泌体治疗推向临床。

