紫椴腋芽增殖途径快繁的影响因子分析研究
张建瑛,吕跃东,李 京,张海峰
(黑龙江省林业科学研究所,黑龙江 哈尔滨 150080)
紫椴(TiliaamurensisRupr.)为椴树科椴树属乔木,主要分布在我国东北、山东、河北、山西等省区;朝鲜、俄罗斯远东地区也有分布。紫椴在1999年被评为国家Ⅱ级保护植物[1-3],作为我国东北林区珍贵阔叶树种之一。就目前的市场来看,根据紫椴的木材特性、着色性能等优点,市场上可以利用该木材生产出优良的胶合板[4];作为一种泌蜜植物,紫椴提供的椴树蜜为一等蜜,群众称为特级蜜,深受国内外消费者的欢迎[5];紫椴花蕾阴干后可以药用,能够清热解表,治疗感冒发热、口腔炎、肾盂肾炎等[6]。同时,紫椴具有空气净化的功能,能够被引入城市绿化环境建设中,可美化环境[7]。但由于紫椴为深休眠种子,造成了在播种繁殖时,紫椴种子的发芽率低、出苗率不齐,这给苗期管理、抚育管理带来了一定的困难。有关研究表明:紫椴扦插繁殖比较困难,尽管很多学者开展了系统的研究,但是有关其生根率、生根情况还有待加强[7]。
目前,关于紫椴组织培养方面的研究相对较少,仅祁永会等[4-10]对紫椴的组织培养进行了研究。在紫椴组织培养过程中的诱导培养和增殖系数等方面都有待进一步探索和研究。在前人研究的基础上,本文就紫椴腋芽的诱导、增殖系数等方面进行了试验研究,旨在为其工厂化育苗的生产、优良无性系的选择利用和基因工程等的研究奠定一定的物质基础。
1 材料与方法
1.1 试验材料
2015年取材于黑龙江省林业科学研究所内2年生紫椴盆栽苗。
1.2 试验方法
1.2.1 诱导阶段基本培养基的筛选 采用MS、1/2WPM和WPM作为基本培养基,分别加入BA 2.0 mg/L+NAA 0.01 mg/L+蔗糖30 g/L+琼脂6.0 g/L,pH值调为6.0。每处理重复10瓶,每瓶内接种10个带腋芽的茎段。
培养条件:温度22~25 ℃,光照时间15 h/d,光照强度2000 lx,室内相对湿度30%左右。接种培养30 d后,观察腋芽生长状况。以下试验条件均与此相同。
1.2.2 诱导阶段不同取材时间的确定 根据枝条不同阶段的萌发状态进行取材,确定紫椴腋芽诱导的最佳时间,培养方法同1.2.1。
1.2.3 增殖阶段激素组合的筛选 将带腋芽的茎段接种到含不同浓度BA(0、0.05、0.1、0.2 mg/L)和NAA(0、0.01、0.02 mg/L)组合的WPM培养基上,共12个处理;在确定激素组合后,附加不同浓度的GA3(0、0.5、1.0、2.0 mg/L),观察分化芽生长情况。
1.2.4 增殖阶段蔗糖浓度的筛选 在WPM+BA 0.05 mg/L+NAA 0.01 mg/L+琼脂6.0 g/L(pH值5.8)的培养基中分别添加15、20、30、60 g/L蔗糖,共4个处理。
1.2.5 增殖阶段培养基pH值的调整 将增殖培养基(WPM+BA 0.05 mg/L+NAA 0.01 mg/L+GA32.0 mg/L+蔗糖20 g/L+琼脂6.0 g/L)的pH值分别调节为5.5、5.8、6.0、6.5,共4个处理。
1.2.6 增殖阶段光强的确定 将增殖培养基(WPM+BA 0.05 mg/L+NAA 0.01 mg/L+GA32.0 mg/L+蔗糖20 g/L+琼脂6.0 g/L)的光强分别调节为0 lx(暗培养)、1000 lx、2000 lx共3个处理。
2 结果与分析
2.1 不同基本培养基对紫椴腋芽诱导的影响
经消毒灭菌处理后的外植体接种在MS、1/2WPM、WPM(附加BA 2.0 mg/L、NAA 0.01 mg/L)3种不同元素含量的基本培养基上,诱导结果如表1所示。不同基本培养基虽然都能诱导腋芽萌发,但诱导情况差异很大(表1)。其中WPM基本培养基外植体在5~7 d芽苞开始膨大,个别开始抽出叶片,长势良好,启动率较快;而MS和1/2WPM基本培养基经过25 d左右腋芽才开始有变化,一直处于膨大状态,不再进一步发育。为此WPM可作为诱导紫椴腋芽萌发的启动培养基。同样经多重比较,3种培养基的启动率差异显著,WPM培养基的启动率显著高于其他基本培养基,这表明基本培养基对紫椴初代培养具有一定的要求。
2.2 不同接种时间对紫椴腋芽诱导的影响
针对紫椴枝条萌发过程,分别在不同时间采集外植体,发现取材于不同发育阶段的腋芽外植体,其污染率和诱导率都存在显著差异(除枝条休眠期和萌动期的差异不显著外)。由表2可知,5个不同时间段的取材,其中以6月中、下旬(枝条抽叶期)的污染率最低,为10.1%,且诱导率最高,为100%;从外观性状上看,腋芽抽梢伸长的速度也较快。其次是7月初、中旬(枝条展叶期)的诱导效果也较理想,但是与上个时期污染情况相比明显增高,高2.64倍。等到了8月初、中旬(枝条木质化期),腋芽内的营养物质随之被消耗,再启动进行腋芽诱导也较困难,因此诱导率下降。

表1 基本培养基对腋芽诱导培养的影响
注:同列数字后的小写字母表示在0.05水平上的差异显著性,字母相同则差异不显著,不同则显著。下同。

表2 不同取材季节对紫椴腋芽诱导的影响
2.3 植物激素浓度对紫椴腋芽增殖的影响
将诱导出伸长的腋芽剪成茎段,分别转入不同的增殖培养基中,30 d后进行统计调查,试验结果见表3。不同浓度的激素组合对紫椴腋芽增殖系数的影响是显著的。在各处理中,BA 0.05 mg/L+NAA 0.01 mg/L的腋芽增殖系数最高,其增殖系数为5.6,叶片数量多、浓绿,与其他处理间差异显著。而单独使用NAA不能很好地增殖培养,增殖系数低,BA与NAA组合使用能够增加腋芽的增殖系数。
在试验过程中发现(表4),添加了BA和NAA的激素组合,虽然提高了增殖效果,但是紫椴组培苗的长势情况并不好,苗木不抽茎、矮小、纤细。为此在试验中添加了GA3来促进已分化的腋芽伸长生长,结果表明:不同浓度的GA3对紫椴腋芽伸长生长有一定的作用,随着浓度的提高,苗木变得粗壮、叶子变大、数量增多,当GA3浓度为2.0 mg/L时,苗高达1.7 cm,比不添加GA3的高1.7倍;苗基径为0.56 mm。
2.4 蔗糖浓度对紫椴增殖的影响
由表5可知,蔗糖质量浓度对紫椴腋芽的增殖系数是有影响的。其中以20 g/L蔗糖处理的腋芽增殖系数为最高,达5.6,其组培苗生长正常,茎秆粗壮、叶片大;其次是30 g/L蔗糖处理,其增殖系数达到4.7,苗生长正常,叶子大但是茎秆有些纤细;20 g/L蔗糖处理与30 g/L蔗糖处理的差异不显著,与剩下其他处理间差异显著;15 g/L蔗糖处理与60 g/L蔗糖处理的增殖系数都比较低,表现为苗生长迟缓、叶小发黄、叶片萎蔫等。这说明过低、过高蔗糖浓度都会影响紫椴的增殖培养,结合外观性状和成本预算考虑,20 g/L蔗糖处理更符合紫椴增殖培养。

表3 激素浓度对紫椴腋芽分化的影响
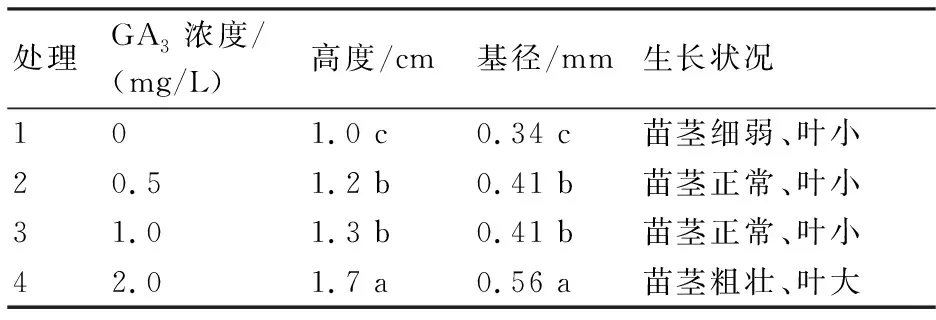
表4 GA3对紫椴腋芽发育的影响

表5 蔗糖浓度对紫椴腋芽分化的影响
2.5 pH值对紫椴增殖的影响
根据紫椴播种育苗的经验来看,紫椴幼苗喜欢微酸性的土壤,为此在组培过程中,对培养基pH值也进行了调整。研究发现:培养基的pH值对紫椴腋芽增殖系数的影响显著(表6)。在各处理之间,呈现抛物线的形式,在pH值为6.0时达到峰值。培养基pH值为5.5的处理的腋芽增殖系数最低,为1.3;pH值为5.8的处理次之,增殖系数达2.1;当培养基pH值为6.0时,腋芽增殖系数最高,为5.6;pH值为6.5处理的增殖系数下降,为4.4。培养基pH值为6.5处理的增殖系数高于pH值为5.5处理4.3倍。
从生长状态上来看,当培养基pH值在6.0~6.5之间时,生长情况良好,新增生的腋芽饱满,萌发的叶片大。当pH值为5.5时,培养基呈酸性,叶片变得细长,增殖系数明显下降。因此,在紫椴腋芽增殖培养中,微酸性环境更适合腋芽的增殖培养。

表6 pH值对紫椴腋芽分化的影响
2.6 光强对紫椴增殖的影响
由图1所示,在各处理中,光强为1000 lx处理的腋芽增殖系数最高,为5.6,与其他2个处理相比差异不显著;光强为2000 lx处理的腋芽增殖系数为5.3;光强为0 lx处理(暗培养)的腋芽增殖系数为5.1。这说明在紫椴的增殖培养中,光强对提高增殖系数影响不大,也符合紫椴幼苗幼树较耐阴的特性。

图1 光强对紫椴腋芽分化的影响
3 结论与讨论
在植物组织培养过程中,外植体取材母株的生理状态(生理年龄等),新梢萌发季节(腋芽、茎芽等生育状态)对萌发有很大的影响[11]。通过试验发现,紫椴腋芽萌发过程中,由于芽鳞包被着不易脱落,导致接种时容易受到污染,同时腋芽呈卵形,不易抽茎,在春天4~5月份枝条萌发时间并不适合紫椴接种,这与绝大多数学者认为春季萌发效果好的研究结果有所不同。当进入6月份之后,枝条抽叶进入了加快的阶段,植物体内各种营养物质比较活跃,而且枝条还没有进入木质化阶段,这个时期接种进行组织培养是最合适的。同时在枝条休眠与萌动时期,接种后出现了污染率高的情况,基部接种培养基部位产生的细菌类型比较严重,限制了腋芽诱导。这与Murashige的理论相吻合,即植株增长速度和再生植株品质的最关键决定因素是起始的外植体[12-14]。
植物激素组合不同配比对植物组织培养增殖效果有很大不同[15]。本研究中,不添加细胞分裂素BA时,外植体不分化,腋芽有轻微膨胀的现象且长时间不会发生进一步的变化;不添加生长素NAA时,外植体分化率很低,且分化时间长,说明生长素与细胞分裂素的配合使用是必要的。本研究发现,紫椴在诱导阶段BA与NAA的适量范围较宽,一般都能诱导腋芽萌发;在增殖阶段,BA与NAA的激素组合绝对浓度不宜过高,增殖系数随着BA浓度的增加而提高,在BA浓度大于1.0 mg/L、NAA浓度大于0.02 mg/L时,其分化情况不好,植株生长出现迟缓、枯萎死亡现象。为此,BA与NAA的适量配合使用才能够达到诱导腋芽分化的目的。本试验表明:WPM培养基附加BA 0.05 mg/L+NAA 0.01 mg/L的配比的外植体分化最好。
由于紫椴幼苗幼树属于较耐阴、深根性树种,喜温凉、湿润气候,根据这样的特性,笔者在研究工作中对培养基的酸碱度、外界环境的光照等进行了试验,结果发现,通过不同的调整,紫椴腋芽离体快繁在偏酸性的培养基上诱导效果好于酸性,光强对紫椴增殖影响不大,这也符合紫椴的生长特性。

