具广谱抗菌活性桔青霉PA-33的诱变育种
倪 赛, 刘银春, 李 健, 李肖鹤, 朱向东
(江西农业大学生物科学与工程学院,江西南昌 330045)
微生物产品被广泛应用在医药生产、环境修复、日常用品等各方面。为满足人类大量需求,研究新的微生物品种已成为微生物应用的关键[1]。由微生物产生的抗生素类药物是微生物诱变育种技术在制药领域中的重要应用[2]。面对抗生素的产生很难通过单个编码基因或表达调控因子的改变而达到理想的效果这一现状,传统的诱变育种技术可以通过简便快速的诱变及适当的筛选手段而获得生产性能优良的工业菌株。因此,传统的诱变育种技术在目前抗生素产生菌的选育过程中具有不可取代的地位[3]。除此之外,诱变育种技术对产抗生素微生物而言具有提高产量、提高纯度、改进发酵工艺和产生新抗生素等优点[4]。直接从自然界中分离得到的野生型菌株性状不稳定,容易退化,无法满足实际需求,这就须要利用育种方法对它们进行改造[5]。微生物诱变育种通过改变微生物的遗传结构和功能,筛选出优良的突变型微生物。这种育种方式使微生物变异速度快、效率高,是食品加工和医药生产等工业的首选[6]。目前,微生物诱变技术在制药中的研究主要以获得高产突变株为目的,通过诱变使酶活性极大提高,被广泛应用于临床诊断、生物农药及食品化妆品等方面[2]。在霉菌中,因其种类繁多、分布广泛,又有菌丝和孢子等独有特性,故诱变育种具有比较独特的特点[7]。除此之外,多种物理诱变和化学诱变方法的结合使用,在霉菌中产生了很好的效果,特别是物理诱变方法中的紫外线诱变和化学诱变方法中的氯化锂诱变相结合的运用较多[2]。如张建勇等分别采用紫外线单因子诱变、紫外线-LiCl复合诱变处理藤黄灰链霉菌,致使其新型抗生素藤黄灰链霉菌素产量提高1.2倍[8]。此外,曹燕妮等以豌豆根瘤菌为出发菌株,利用紫外-LiCl-超声波复合诱变,以期获得高产辅酶Q10菌株[9]。
目前,人工诱变的育种方式主要包括物理诱变、化学诱变和生物诱变[7],在微生物育种中较常见的为物理诱变和化学诱变。此外应用较多的还有复合诱变,通常仅采用一种方法进行诱变,会使微生物产生抗性,从而降低突变率,复合诱变具有补充不同诱变方法之间缺陷的优势[6]。本研究主要运用紫外诱变、紫外-LiCl复合诱变、紫外-亚硝酸复合诱变、微波诱变以及微波-超声波-3%硫酸二乙酯(diethyl sulfate,简称DES)复合诱变等技术对桔青霉(Penicilliumcitrinum)PA-33菌株孢子进行诱变育种,由此获得高产抗生素突变菌株,以期为桔青霉PA-33菌株工业化应用提供依据。
1 材料与方法
1.1 供试菌株
桔青霉PA-33;病原菌:大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、苏云金芽孢杆菌(Bacillusthuringiensis)。以上菌株保存于江西农业大学生物科学与工程学院实验室。
1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g/L、葡萄糖 20 g/L、水1 L、琼脂15~20 g/L,pH值自然。
马铃薯葡萄糖液体培养基(PDB):马铃薯200 g/L、葡萄糖20 g/L、水1 L,pH值自然。
1.3 菌株桔青霉PA-33诱变育种
1.3.1 孢子悬液的制备 将菌株PA-33活化后加入适量无菌生理盐水,洗下孢子,用无菌脱脂棉过滤除去菌丝体和培养基残渣,装入带有玻璃珠的100 mL锥形瓶中,并置于摇床上振荡30 min,使孢子充分分散,调整孢子悬液浓度为 106个/mL,备用。
1.3.2 紫外诱变处理 (1)在9个放置有无菌磁棒的培养皿中分别加入8 mL孢子悬液;(2)将培养皿放置在事先预热20 min的15 W紫外灯下,照射距离为24 cm;(3)在磁力搅拌器上打开皿盖,分别照射0 s、30 s、60 s、90 s、2 min、4 min、6 min、9 min、15 min;(4)吸取处理后的孢子悬液1 mL依次进行10倍稀释,吸取10-2、10-3、10-4等3个梯度孢子悬液 0.2 mL 涂平板,重复3次,28 ℃恒温培养3~5 d,根据菌落数计算致死率,选择致死率为90%左右的条件作为紫外诱变的最适条件;(5)诱变菌株初筛:采用致死率为90%的条件诱变,挑取菌落生长速度快且菌落直径大的单菌落,进行复筛;(6)将初筛的菌株分别接种至PDB培养基中,置于28 ℃、150 r/min 的摇床上培养7 d,以大肠杆菌为指示菌,以原始菌株PA-33为对照,采用管碟法测定各突变菌株发酵液的抑菌圈直径,根据抑菌圈直径增加的大小确定最佳突变菌株。
1.3.3 紫外-LiCl复合诱变处理 将紫外诱变致死率为90%的孢子悬液依次稀释10倍,选取10-2、10-3、10-4稀释度的孢子悬液200 μL涂布于含LiCl浓度为0、0.3%、0.6%、1.0%、1.5%、2.0%的PDA平板中,每组重复3次,参照“1.3.2”节方法确定最佳突变菌株。
1.3.4 紫外-亚硝酸复合诱变处理 (1)将菌株PA-33参照紫外诱变致死率为90%的条件处理;(2)在每个试管中分别加入1 mL 0.2 mol/L NaNO2溶液、2 mL孢子悬液、1 mL pH值为4.5的醋酸缓冲液,充分混匀后,置于27 ℃水浴锅中分别处理0、5、10、15、20、30、45、60 min,并加入2 mL 0.07 mol/L pH值为8.6的Na2HPO4溶液,每组重复3次。参照“1.3.2”节方法确定最佳突变菌株。
1.3.5 微波诱变处理 (1)火力强度的确定:分别吸取8 mL菌株PA-33孢子悬液于3个培养皿中,在不加盖条件下,分别用额定功率700 W、频率22 kHz的低火、中火、高火处理 20 s,吸取处理后的孢子悬液1 mL进行10倍稀释,吸取10-2、10-3、10-43个稀释度的孢子悬液200 μL涂布于盛有PDA的平板中,重复3次,28 ℃恒温培养3~5 d,记录菌落数确定微波诱变火力强度。(2)致死率试验:使用最合适的火力强度进行微波诱变试验,分别吸取8 mL孢子悬液至平板中,微波炉中分别低火处理0、5、10、15、20、25、30、40、60 s,每组重复3次。参照“1.3.2”节方法确定最佳突变菌株。
1.3.6 微波-超声波-3%硫酸二乙酯(diethyl sulfate,简称DES)复合诱变处理 (1)在50 mL锥形瓶中分别加入16 mL pH值为7的磷酸缓冲液、4 mL 突变菌株WB-6孢子悬液和0.6 mL DES(DES终浓度为3%),并在200 W、22 kHz超声波冰水浴条件下分别处理0、3、6、9、15、25、40、60 min,每组重复3次。参照“1.3.2”节方法确定最佳突变菌株。
1.3.7 突变菌株遗传稳定性试验 将各突变菌株连续传代6代,测定其发酵液的抗菌活性。
1.3.8 突变菌株抗菌活性测试 利用管碟法,以大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和苏云金芽孢杆菌为指示菌,测定突变菌株发酵液的抗菌活性。
2 结果与分析
2.1 菌株桔青霉PA-33紫外诱变
2.1.1 紫外诱变致死率试验 由图1可知,在紫外灯功率15 W、照射距离24 cm条件下,随着诱变时间的增加,紫外诱变致死率逐渐增大,在1.5 min时,致死率为76.92%,在 2 min 时,致死率为96.70%,诱变时间超过9 min时,致死率超过99.00%。因此,选择紫外诱变条件为紫外灯功率15 W、照射距离24 cm、照射时间2 min。

2.1.2 紫外诱变突变菌株筛选 从平板上挑取44个菌落进行复筛,结果显示,紫外线对菌株PA-33诱变效果较差,仅有8个突变菌株的抑菌圈直径增大,正向突变率仅为18.18%,其中突变菌株UV-22抑菌圈直径最大,活性提高率却仅为12.55%(表1)。
2.2 菌株桔青霉PA-33紫外-LiCl复合诱变
2.2.1 菌株PA-33紫外-LiCl复合诱变致死率试验 由图2可知,菌株PA-33在紫外灯功率15 W、照射距离24 cm、照射时间2 min的诱变条件下,随着LiCl浓度的增加,其致死率整体增大,在LiCl浓度为0.6%时,致死率为88.12%,LiCl浓度继续增加到1.5%时,致死率达100%。因此,确定紫外-LiCl复合诱变条件为紫外灯功率15 W、照射距离24 cm、照射时间2 min、LiCl浓度为0.6%。
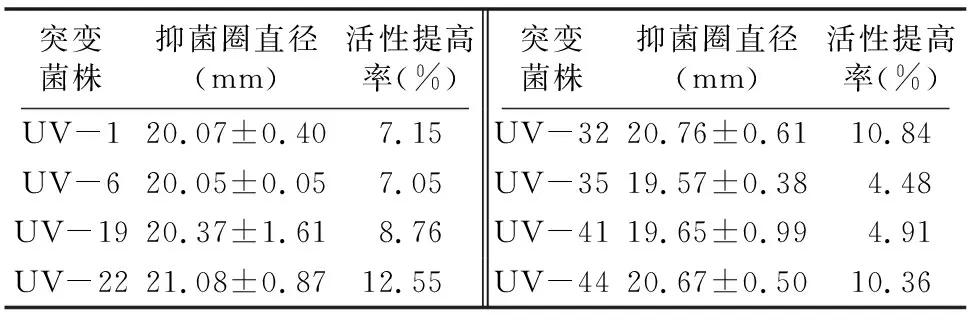
表1 紫外诱变复筛菌株及其抗菌活性
2.2.2 紫外-LiCl复合诱变突变菌株筛选 从平板上挑取28个菌株进行复筛,6个突变菌株抗菌活性增强,正向突变率为21.43%。由表2可知,突变菌株Li-1的抑菌圈直径最大,为26.13 mm;活性提高率最大,为39.51%。突变菌株 Li-13、Li-17、Li-19、Li-27、Li-28活性提高率分别为7.47%、3.58%、6.03%、11.05%、9.08%,其中突变菌株 Li-17 活性提高率最低,仅为3.58%。

表2 紫外-LiCl复合诱变复筛菌株及其抗菌活性
2.3 菌株桔青霉PA-33紫外-亚硝酸复合诱变
2.3.1 菌株PA-33紫外-亚硝酸复合诱变致死率试验 由图3可知,菌株PA-33在紫外灯功率15 W、照射距离 24 cm、照射时间2 min诱变的基础上,进行亚硝酸诱变,亚硝酸浓度为0.2 mol/L条件下,随着诱变时间的增加,其孢子致死率逐渐增大,当诱变时间为30、45、60 min时,孢子致死率分别为76.47%、91.18%、94.12%。因此,确定紫外-亚硝酸复合诱变条件为紫外灯功率15 W、照射距离24 cm、照射时间 2 min、0.2 mol/L亚硝酸作用时间45 min。
2.3.2 紫外-亚硝酸复合诱变突变菌株筛选 从平板上挑取41个突变菌株进行复筛,其中11个突变菌株抗菌活性增强,正向突变率为26.83%。由表3可知,突变菌株H-14和 N-25抑菌圈直径最大,分别为26.27、26.07 mm,活性提高率分别为40.26%、39.19%。
2.4 菌株桔青霉PA-33微波诱变
2.4.1 微波诱变火力强度确定 将菌株PA-33孢子悬液分别经微波低火、中火和高火处理20s,结果(表4)显示,低火处理组存活的菌落数为6.5×104个/mL,而中火和高火处理组无存活菌落数,因此选用低火作为微波诱变的火力强度。

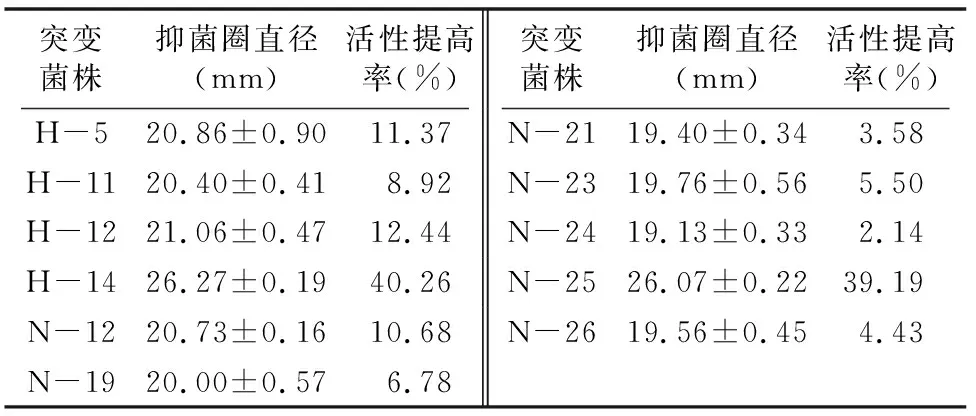
表3 紫外-亚硝酸复合诱变复筛菌株及其抗菌活性

表4 微波火力强度对菌株PA-33孢子存活能力的影响
2.4.2 菌株PA-33微波诱变致死率试验 由图4可知,菌株PA-33的孢子悬液经功率为700 W、频率22 kHz的微波低火处理时,随着处理时间的延长,其孢子致死率逐渐增加,处理时间为25 s时,致死率为85.88%,处理时间为30 s时,致死率已达到90.40%,处理60 s时,致死率已接近97%。因此,确定微波诱变菌株PA-33的条件为微波炉功率700 W,频率22 kHz,低火处理30 s。

2.4.3 菌株PA-33微波诱变突变菌株筛选 从平板上挑取39株突变菌株进行发酵,抑菌活性测试结果见表5。共有24株突变菌株发酵液抑菌圈直径增强,正向突变率为 61.54%,其中突变菌株WB-6抑菌圈直径为25.40 mm,抗菌活性提高率最高,为32.29%。
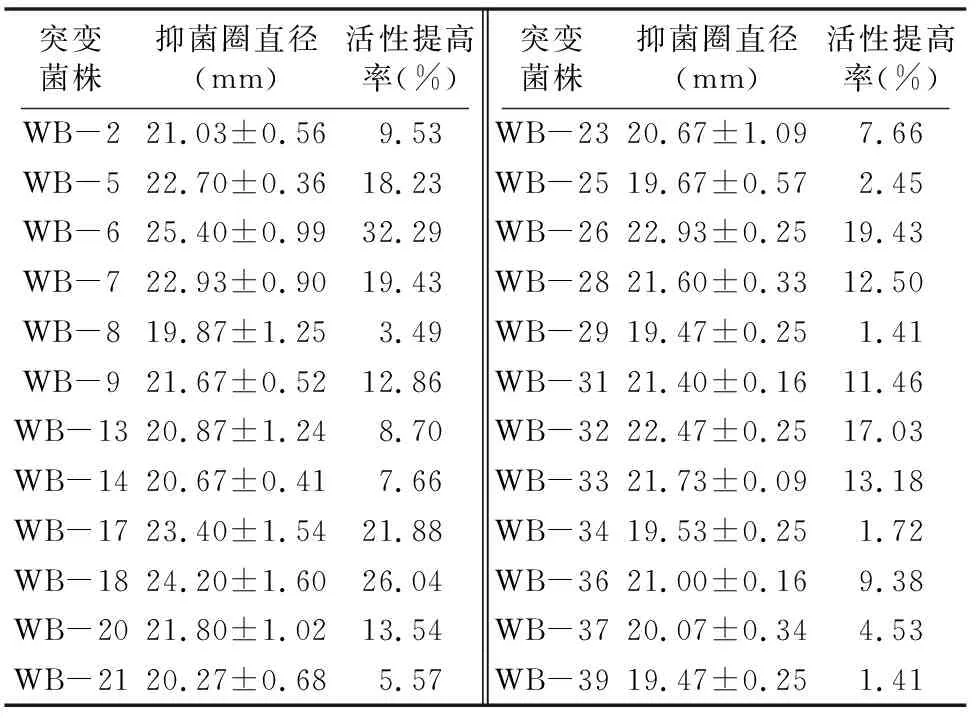
表5 微波诱变复筛菌株及其抑菌活性
2.5 菌株桔青霉PA-33微波-超声波-3%DES复合诱变
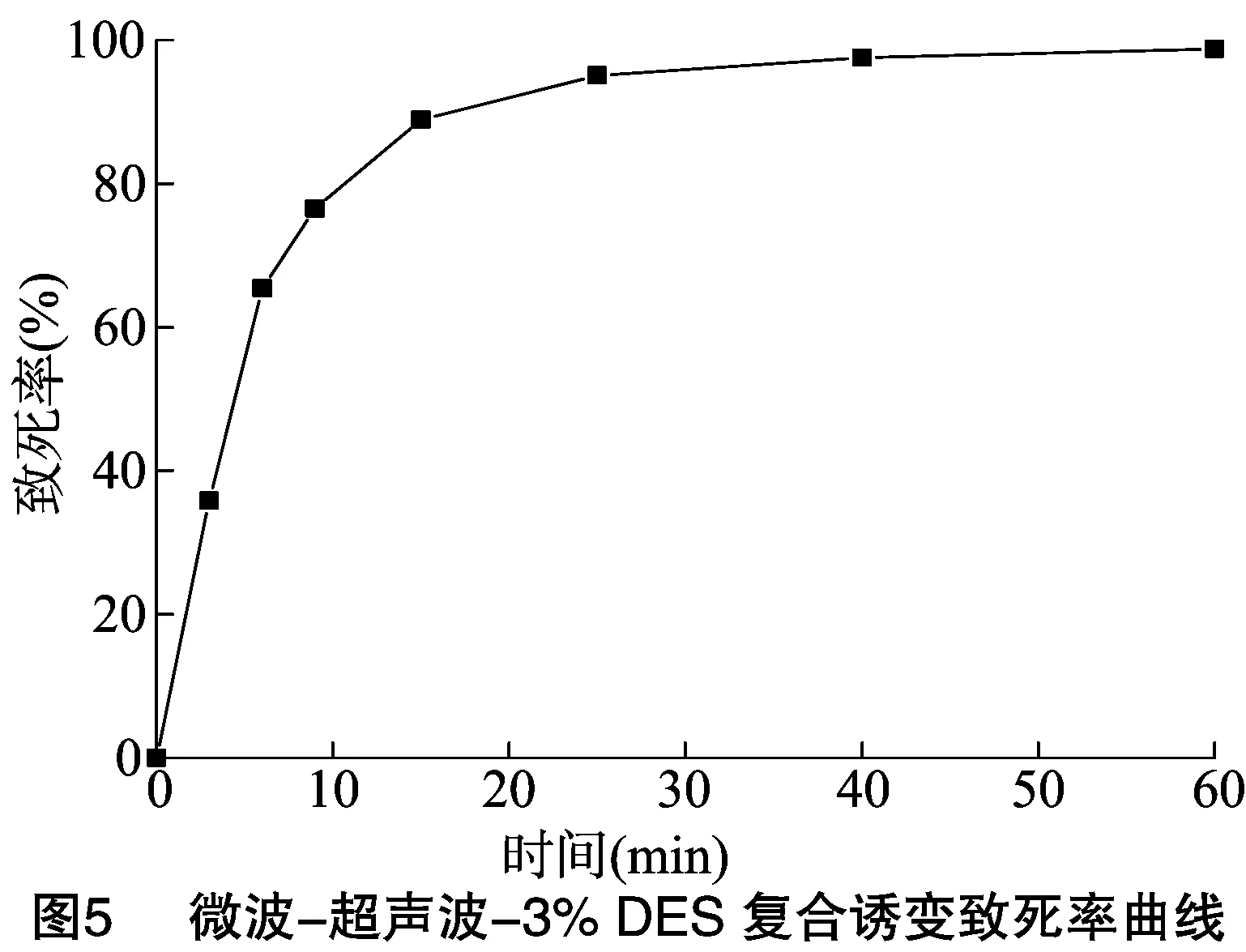
2.5.1 微波-超声波-DES复合诱变致死率试验 微波诱变突变菌株WB-6孢子悬液经超声波联合3%DES诱变处理不同时间。由图5可知,随着诱变时间的延长,其孢子悬液致死率不断增加。当处理时间为15 min时,致死率已达到88.89%;当处理时间为60 min时,致死率达到98.77%。因此,确定超声波-3%DES诱变条件为200 W、22 kHz超声波强度、3%DES处理15 min。
2.5.2 微波-超声波-3% DES复合诱变突变菌株筛选 挑取29株突变菌株用于抗菌活性测试,由表6可知,共有18株突变菌株发酵液抗菌活性增强,正向突变率为62.07%,其中突变菌株D-11抑菌圈直径为23.20 mm,抗菌活性提高率最大,达到20.83%。
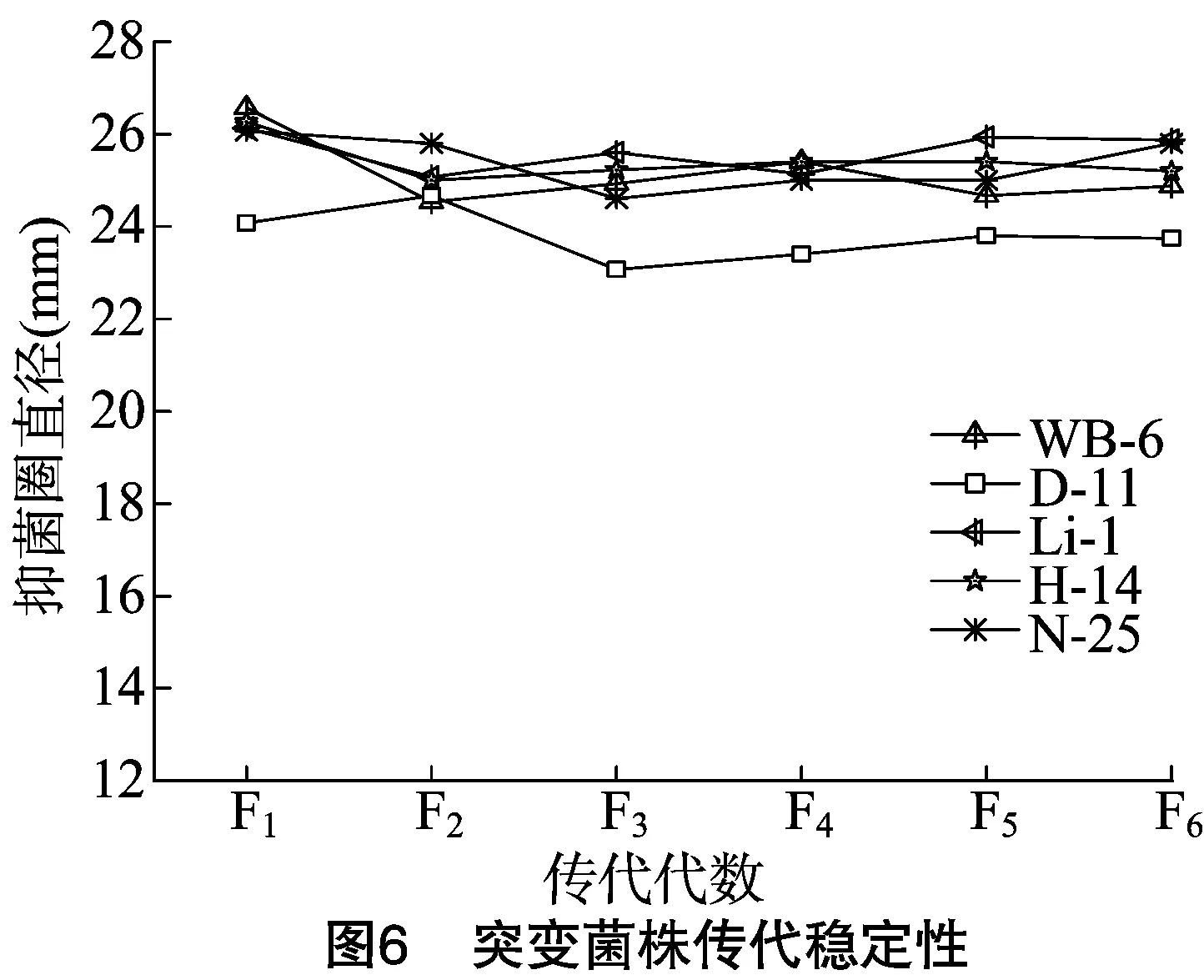
2.6 突变菌株传代稳定性测试
由图6可知,突变菌株Li-1、H-14、N-25的传代稳定性较好,传代至6代抗菌活性基本稳定。突变菌株WB-6、D-11的传代稳定性较差, 发酵液抑菌圈直径总体呈下降趋势,突变菌株WB-6抗菌活性提高率维持在30.97%~32.29%,突变菌株D-11的抗菌活性提高率变化区间为 23.17%~28.51%。综上,突变菌株Li-1、H-14、N-25是传代稳定性较好的菌株,突变菌株WB-6、D-11传代稳定性较差。

表6 微波-超声波-3% DES复合诱变复筛菌株及其抑菌活性
2.7 突变菌株抗菌活性测试
与原始菌株PA-33发酵液抗菌活性相比,突变菌株 Li-1对金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌、大肠杆菌的抑菌圈直径分别增加5.53、9.80、6.53、7.40 mm;突变菌株H-14对金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌、大肠杆菌的抑菌圈直径分别增加4.66、7.54、5.20、7.54 mm;突变菌株N-25对金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌、大肠杆菌的抑菌圈直径分别增加4.33、9.07、5.73、7.34 mm;突变菌株WB-6对金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌、大肠杆菌的抑菌圈直径分别增加4.13、6.27、6.06、6.67 mm;突变菌株D-11对金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌、大肠杆菌的抑菌圈直径分别增加3.23、4.67、3.33、5.34 mm。其中突变菌株Li-1抗菌活性最大,突变菌株H-14、N-25、WB-6次之,D-11抗菌活性最小(表7)。

表7 突变菌株抗菌活性测试
3 结论与讨论
分别采用紫外诱变、紫外-LiCl复合诱变、紫外-亚硝酸复合诱变、微波诱变以及微波-超声波和3%DES复合诱变菌株PA-33,分别筛选得到抗菌活性提高最大的突变菌株 Li-1、N-25、H-14、WB-6、D-11,它们对大肠杆菌的抗菌活性分别提高39.51%、39.19%、40.26%、32.29%、20.83%。通过传代稳定性测试,突变菌株Li-1、H-14、N-25是传代稳定性较好的菌株,突变菌株WB-6、D-11传代稳定性较差。紫外单因子诱变突变菌株的活性提高率最高仅为12.55%,而在紫外诱变基础上,进行LiCl诱变后,抗菌活性明显增强,最高活性提高率增至 39.51%;同时在紫外诱变基础上进行亚硝酸诱变后,得到突变菌株N-25、H-14的抗菌活性明显增强,活性提高率分别增至39.19%、40.26%。紫外诱变对菌株PA-33的诱变效果较差,可能是因为紫外线主要阻碍碱基间的正常配对和妨碍双链的解开而使菌株发生变异,其引起的突变单一[10],形成的突变体类型较少。而在紫外诱变基础上进一步进行LiCl和亚硝酸诱变使得菌株PA-33产生高比例点突变和低比例的染色体畸变,从而使诱变效果增强。朱峰等分别使用3种复合诱变方法处理Snea253-GL 8菌株,筛选出高杀虫活性和稳定高产的突变株[11]。韩娜应用亚硝酸结合消泡剂诱变选育得到的9S-189菌株,该菌株能显著提高对消泡剂的耐性并能够更适应高消泡剂的环境[12]。Xu等将StreptomycespristinaespiralisCGMCC 0957菌株经紫外线诱变结合耐自身产物抗性筛选,获得普纳霉素高产菌株[13]。刘明志等以产紫杉醇内生真菌葡萄座腔菌菌株J11为出发菌,经甲基磺酸乙酯和制霉菌素复合诱变,得到诱变菌株J11-8,产紫杉醇量提高66.5%[14]。胡丹东等以产核酸酶P1桔青霉050421为出发菌株,经紫外线诱变处理,其突变菌株050421-A产酶活性比出发菌株提高了约68.1%,同时将此菌株再经过化学试剂LiCl处理,得到遗传稳定性较好的菌株050421-A-AB,其产酶活性在紫外诱变基础上提高了40.05%,比原始出发菌株050421提高了约138.88%[15]。
微波诱变以及微波-超声波-3% DES复合诱变效果相对较好,其中微波-超声波-3% DES复合诱变效果明显低于微波单因子诱变效果,突变菌株D-11的抗菌活性提高率明显低于突变菌株WB-6,微波单因子诱变效果明显,原因可能是以下3个方面[16]:(1)微波是一种电磁波,可使单孢子内DNA分子氢键和碱基对及化学力受损,最终引起分子结构发生变化,导致遗传变异;(2)微波极强的穿透效应,使细胞壁内外的水分子产生剧烈运动,从而改变细胞壁通透性,使胞内物质被释放出来;(3)微波所产生的瞬时热效应,易引起酶失活,从而造成细胞的生理、生化变异和微生物的动态代谢平衡发生紊乱,从而改变其代谢途径。鲍勇阳等采用微波-DES复合诱变,以产淀粉酶黑曲霉为出发菌株,得到的突变株再经发酵优化后,其α-淀粉酶的酶活性最高达到 6 011 U/g[17]。苏龙等以产核酸酶P1桔青霉为出发菌株,通过微波诱变,得到1株产核酸酶较高的生产菌SL5,其产生的核酸酶P1酶活性提高了84.00%[18]。田利飞等以YC34菌株为出发菌株,通过紫外诱变、微波诱变、LiCl诱变3种方式依次进行复合诱变处理后,获得突变株YC34-1,其初发酵液的酶活性增加了183.3%[19]。

