miRNA-497过表达对人结肠癌细胞放疗敏感性的影响
白桦,张松,肖鹏,栗敏郑州人民医院肿瘤内科,郑州450000
2郑州大学第一附属医院放疗科,郑州4500000
微小RNA(microRNA,miRNA)作为一类非编码RNA,通过调节基因转录后过程调控器官形态及细胞增殖和凋亡.50%的miRNA位于肿瘤相关的基因组区域或者脆弱位点[1],一些miRNA通过调控原癌基因和抑癌基因的表达,从而在恶性肿瘤的发生、发展及预后中发挥重要作用[2-5].miRNA也可能作为肿瘤诊断和治疗的靶向标志物[6].miRNA表达与肿瘤细胞化疗和放疗敏感性的相关性引起了越来越多的关注[7-10].在胆管上皮癌细胞中,miRNA-21和miRNA-200b增加了吉西他滨的放疗敏感性[11].在人胃癌细胞中,miRNA-34也增加了放疗的敏感性[12].Caco2细胞作为一种人直肠癌细胞系,其结构和功能类似于人小肠上皮细胞,并含有与小肠刷状缘上皮相关的酶系,具有相对简单、重复性较好、应用范围较广的特点,因此本研究采用该细胞系作为放疗敏感性研究的体外模型.以往研究表明,miRNA-497过表达能抑制胰岛素样生长因子1受体(insulin-like growth factor-1 receptor,IGF-1R)3'端非翻译区的活性,抑制结直肠癌细胞中内源性IGF-1R的表达,提示下调miRNA-497的表达可以使IGF-1R的表达水平升高,从而导致结直肠癌的发生[13].然而,miRNA-497在结肠癌放疗敏感性中的作用及其机制尚未研究.本研究探讨miRNA-497过表达对人结肠癌细胞放疗敏感性的作用及对IGF-1R信号通路的调控作用,旨在为结肠癌的临床治疗提供依据,现报道如下.
1 材料与方法
1.1 细胞和试剂
人结肠癌细胞系Caco2购自中国科学院上海生命科学院细胞库,含有miRNA-497核苷酸序列的过表达载体pGV208慢病毒购自上海吉凯生物化学技术有限公司,IGF-1RsiRNA购自上海英俊生物技术有限公司,DMEM培养基、胎牛血清、胰蛋白酶和青链霉素均购自美国Gibco公司,RNA提取试剂Trizol购自Invitrogen公司,逆转录试剂盒购自Promega公司,蛋白质印迹(Western blot)显色剂购自Pierce公司,一抗购自Cell Signalling Technology公司,二抗购自Santa Cruz公司,噻唑蓝(methylthiazoletetrazolium,MTT)试剂、甲醛和姬姆萨染料购自Sigma公司.
1.2 细胞培养
使用DMEM培养基(含有10%胎牛血清、1000U/ml青链霉素)培养人结肠癌Caco2细胞,置于37℃、5%CO2的恒温培养箱内,每2~3天更换培养液,待细胞融合至80%左右,使用胰蛋白酶消化细胞,进行传代培养.
1.3 细胞转染
转染含有miRNA-497核苷酸序列的慢病毒至Caco2细胞作为miRNA-497转染组,转染含有一段无义寡核苷酸序列的重组慢病毒至Caco2细胞作为阴性对照组,以不作处理的Caco2细胞作为空白对照组.
1.4 miRNA-497半定量检测
由于载体pGV208含有增强型绿色荧光蛋白,转染72 h后显微镜下可观察到细胞有明显荧光表达.收集转染成功的miRNA-497转染组细胞及阴性对照组和空白对照组细胞,应用Trizol提取总RNA.使用M-MLV逆转录酶对目的基因和内参基因U6进行逆转录.miRNA-497逆转录引物:5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAAAC-3';U6逆转录引物:5'-CGCTTCACGAATTTGCGTGTCAT-3'.再将转录后的cDNA采用SYBR Green荧光染料,以U6RNA作为内参,进行荧光定量聚合酶链反应(polymerase chain reaction,PCR),每个样品重复3次.miRNA-497上游引物为5'-GTGCAGGGTCCGAGGT-3',miRNA-497下游引物为5'-TAGCCTGCAGCACACTGTGGT-3';U6上游引物为5'-GCTTCGGCAGCACATATACTAAAAT-3',U6下游引物为5'-CGCTTCACGAATTTGCGTGTCAT-3'.对3次重复实验的数据进行半定量分析.
1.5 细胞克隆形成实验
釆用Varian 2300EX直线加速器6MV-X线垂直辐射结肠癌细胞(上盖1 cm有机玻璃填充物),剂量率为3.2 Gy/min,源皮距(source skin distance,SSD)为100 cm.将放射处理后的对数生长期细胞用0.25%的胰蛋白酶消化后制成单细胞悬液,细胞计数后接种于细胞培养皿中培养10~14天.待出现集落时终止培养.弃培养液,甲醛固定15 min,姬姆萨染色10 min,统计细胞数>50个的集落数.对应照射剂量为0、2、4、6、8 Gy,每孔所接种的细胞数为600、1000、2000、5000、10 000.每个剂量做3个平行复孔.根据单靶多击模型拟合细胞存活曲线,并计算放射增敏比.
1.6 MTT法检测细胞增殖抑制率和存活率
将照射后的细胞经0.25%的胰蛋白酶消化,按每孔1X103个细胞均匀接种于96孔培养板,每个条件设3个复孔,培养4天后,每孔加入20 μl MTT,37℃继续孵育4 h,加入DMSO后在570 nm波长下测定光吸收值A,计算细胞增殖抑制率和存活率.细胞增殖抑制率=(对照组A值-实验组A值)/实验组A值X100%,细胞存活率=实验组A值/对照组A值X100%.
1.7 Western blot检测蛋白表达
收集待测细胞,加入细胞裂解液提取总蛋白后,参照BCA蛋白定量试剂盒说明书对所提取的总蛋白进行定量.将定量合格的蛋白样品与等体积上样缓冲液混合后,置于沸水浴中变性5 min.将变性后的蛋白样品以每孔50 μg上样至10%十二烷基硫酸钠-聚丙烯酰胺凝胶孔中,电泳2 h后电转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上.将含有蛋白样品的PVDF膜浸泡入含5%脱脂奶粉的封闭液中封闭2 h.封闭液洗膜10 min,3次后,与1∶1000稀释的特异性一抗4℃反应24 h,以1∶2000稀释的辣根过氧化物酶标记的二抗常温孵育1 h.封闭液再次洗膜后,加入化学发光剂,暗室内显影曝光,凝胶成像系统扫描分析.
1.8 IGF-1 R siRNA转染实验
为验证miRNA-497是否通过IGF-1R调节Caco2细胞的放射敏感性,以转染IGF-1RsiRNA的Caco2细胞作为IGF-1RsiRNA转染组,以未转染的Caco2细胞作为空白对照组.采用荧光定量PCR和Western blot检测IGF-1R的表达水平,采用MTT实验检测细胞存活率.
1.9 统计学分析
采用SPSS 19.0软件对-数据进行统计分析,计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义.
2 结果
2.1 miRNA-497表达水平的比较
miRNA-497转染组的miRNA-497表达水平为(6.45±0.62),高于阴性对照组的(1.18±0.25)和空白对照组的(1.00±0.08),差异均有统计学意义(P<0.05).阴性对照组和空白对照组的miRNA-497表达水平比较,差异无统计学意义(P>0.05).
2.2 克隆形成率和存活率的比较
照射剂量为2、4、6、8 Gy时,miRNA-497转染组细胞的克隆形成率均低于空白对照组,差异均有统计学意义(P<0.05)(表1);照射剂量为2、4、6、8 Gy时,miRNA-497转染组细胞的存活率均低于空白对照组,差异均有统计学意义(P<0.05)(表2).采用单击多靶模型进行曲线拟合,放射增敏比=1.533.
表1 空白对照组和miRNA-497转染组应用不同剂量 X射线照射后细胞的克隆形成率(%,±s)

表1 空白对照组和miRNA-497转染组应用不同剂量 X射线照射后细胞的克隆形成率(%,±s)
注:*与空白对照组比较,P<0.05
组别空白对照组miRNA-497转染组74.5±6.2 63.4±2.6 48.6±5.3 25.6±3.1*30.6±3.7 5.4±1.1*14.7±1.7 1.3±0.3*6.3±0.3 0.3±0.0*0 Gy 2 Gy 4 Gy 6 Gy 8 Gy
表2 空白对照组和miRNA-497转染组应用不同剂量 X射线照射后细胞的存活率(%,±s)

表2 空白对照组和miRNA-497转染组应用不同剂量 X射线照射后细胞的存活率(%,±s)
注:*与空白对照组比较,P<0.05
组别空白对照组miRNA-497转染组0 Gy 100.0±0.0 100.0±0.0 2 Gy 92.3±6.7 74.8±5.8*4 Gy 58.1±4.9 15.8±1.0*6 Gy 27.9±3.2 3.8±0.5*8 Gy 12.0±0.1 0.9±0.2*
2.3 细胞增殖抑制率的比较
MTT检测结果显示,随着照射剂量的增加,各组细胞的增殖抑制率逐渐升高.照射剂量为2 Gy时,miRNA-497转染组细胞的增殖抑制率高于空白对照组,差异有统计学意义(P<0.05);照射剂量为4、6、8 Gy时,miRNA-497转染组细胞的增殖抑制率均明显高于空白对照组,差异均有统计学意义(P<0.01).照射剂量为2、4、6、8 Gy时,阴性对照组与空白对照组细胞的增殖抑制率比较,差异均无统计学意义(P>0.05).(图1)
2.4 细胞存活率的比较
采用4 Gy/min剂量率垂直辐射Caco2细胞后,观察72 h后的细胞存活率,结果显示3组细胞的存活率均随处理时间的延长而下降.处理24、48、72 h后,miRNA-497转染组的细胞存活率均低于空白对照组,差异均有统计学意义(P<0.05);但阴性对照组与空白对照组细胞的存活率比较,差异均无统计学意义(P>0.05).(表3)
表3 不同时间点 3组细胞存活率的比较(%,±s)

表3 不同时间点 3组细胞存活率的比较(%,±s)
注:*与空白对照组比较,P<0.05
组别空白对照组阴性对照组miRNA-497转染组100.00±7.55 96.48±5.24 65.75±3.26*88.95±5.22 82.05±6.38 37.58±3.36*79.08±6.85 75.16±3.28 34.28±2.72*24 h 48 h 72 h
2.5 IGF-1 R、p-AKT、AKT蛋白表达水平的比较
Western blot结果显示,miRNA-497转染组的IGF-1R和p-AKT蛋白表达水平均低于空白对照组,差异均有统计学意义(P<0.05).(表4)
表4 不同组别IGF-1 R、p-AKT、AKT蛋白表达水平的比较(±s)
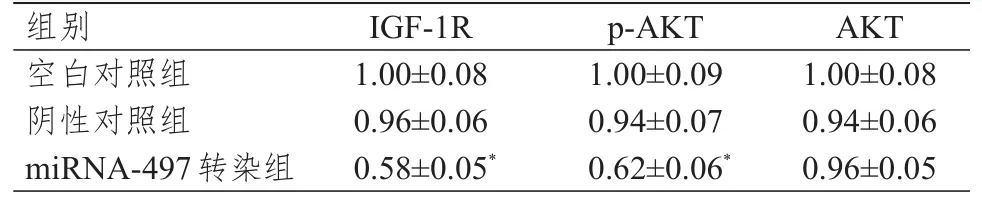
表4 不同组别IGF-1 R、p-AKT、AKT蛋白表达水平的比较(±s)
注:*与空白对照组比较,P<0.05
组别空白对照组阴性对照组miRNA-497转染组IGF-1R 1.00±0.08 0.96±0.06 0.58±0.05*p-AKT 1.00±0.09 0.94±0.07 0.62±0.06*AKT 1.00±0.08 0.94±0.06 0.96±0.05
2.6 转染IGF-1 R siRNA对IGF-1 R表达水平及细胞存活率的影响
IGF-1RsiRNA转染组中IGF-1R的mRNA和蛋白表达水平分别为(0.58±0.05)和(0.26±0.03),均低于空白对照组的(1.00±0.08)和(0.65±0.05),差异均有统计学意义(P<0.05).4 Gy/min剂量率垂直辐射Caco2细胞后,观察处理48 h后的细胞存活率,MTT检测结果显示,IGF-1RsiRNA转染组的细胞存活率为(63.52±5.05)%,低于空白对照组的(89.06±6.22)%,差异有统计学意义(P<0.05).
3 讨论
结直肠癌是最常见的恶性肿瘤之一,其发病率居所有恶性肿瘤的第3位,在中国其发病率与病死率均呈逐年上升趋势,发生远处转移的结直肠癌患者的5年生存率仅为6%~8%[14],但是关于结直肠癌发生的分子机制目前尚未明确.
miRNA作为一类普遍存在于细胞中的长度为21~24个核苷酸的内源性非编码小RNA,参与了基因表达的转录后调节过程,通过结合靶向mRNA转录子的互补位点调节基因表达水平[15].miRNA在肿瘤的发生、发展、转移和侵袭等过程中发挥着重要的调节作用[16-17].miRNA直接参与结直肠癌的发生和发展,其通过调节抑癌基因信号通路,在结直肠癌的发生过程中发挥重要作用.研究表明,miRNA-135a、miRNA-135b和miRNA-122a能使腺瘤性结肠息肉(adenomatous polyposis coli,APC)抑癌基因及其介导的信号通路失活[18-20];在APC突变的小鼠模型中,miRNA-31、miRNA-137和miRNA-215不同程度地影响结直肠癌的发生,表明这些miRNA通过调节APC信号通路参与了结直肠癌的早期发生过程.miRNA-34、miRNA-145和miRNA-107分别通过调节p57参与了肿瘤细胞的生长、增殖及血管生成[21].因此,miRNA通过调节APC信号通路参与结肠癌的发生过程,而通过调节p57信号通路参与肿瘤的侵袭过程,并且近年来的研究表明,miRNA参与了结直肠癌的转移[22-23].
miRNA-497是近年研究的热点,它可以通过调控细胞周期而参与细胞凋亡,其在肿瘤组织中呈现过表达,而且与肿瘤的发生发展密切相关.miRNA-497属于miRNA-15/16/195/424/497家族成员,通过靶向结合CDK6、CARD10和CDC27基因调控结肠癌细胞的增殖[24].在不同的细胞系中,该家族的miRNA通过靶向调节Bcl-2促进细胞凋亡[25-26].然而到目前为止,miRNA-497与结肠癌放疗敏感性的关系暂无相关报道.为此,本研究利用慢病毒构建了miRNA-497过表达的Caco2细胞系,并以其为研究对象利用不同方法观察miRNA-497对放疗敏感性的影响.细胞克隆形成实验结果表明,miRNA-497转染组细胞的放射抗拒性明显降低,结肠癌细胞的克隆形成率明显降低.MTT实验结果表明,miRNA-497转染组与空白对照组相比,经放射处理后细胞存活率明显下降,并且细胞存活率随着处理时间的延长而下降,提示miRNA-497过表达可以提高结肠癌对放射线的敏感性.
miRNA通过调节AKT相关信号通路从而影响肿瘤细胞的放疗敏感性.miRNA-21、miRNA-26、miRNA-221/222、miRNA-216a/217和miRNA-486共同通过调节抑癌基因PTEN的表达,进一步调控AKT酶的活性.miRNA-155、miRNA-205和miRNA-375分别通过调节SHIP和PDK1基因的表达,激活AKT酶的活性.miRNA-126和miRNA-320通过调控磷脂酰肌醇3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)的表达,影响下游三磷酸磷脂酰肌醇和AKT酶及其磷酸化水平[27-28].MyoD和MRTF-A通过结合于miRNA-486的启动子区域激活了该miRNA的转录,成熟的miRNA-486直接抑制PI3K/AKT信号通路中两个重要的负调节因子PTEN和Foxo1a,从而激活AKT信号通路.miRNA-221和miRNA-222靶向作用于PTEN蛋白,从而调节肿瘤细胞的生长、增殖、凋亡、侵袭、转移和放疗敏感性[27].研究显示,IGF-1R蛋白是miRNA-497调控的关键靶分子[15].本研究结果表明,Caco2细胞中过表达miRNA-497抑制了AKT的磷酸化水平,从而降低AKT酶的活性.表明miRNA-497可能通过抑制AKT的磷酸化水平和IGF-1R蛋白表达,从而增强Caco2细胞的放疗敏感性.因此推测miRNA-497增强结肠癌细胞的放疗敏感性可能是通过PI3K/AKT信号通路而实现的.作为威胁人类健康最重要的恶性肿瘤之一,结直肠癌的早期诊断和早期治疗越来越受到人们的重视.在治疗方面,手术治疗是结直肠癌的首选治疗方法,在手术基础上辅以化疗、放疗等一系列综合治疗手段,已成为结直肠癌治疗的研究热点.本研究结果表明,miRNA-497增强了结肠癌细胞的放疗敏感性,为结肠癌的临床辅助治疗提供了依据.然而,在肿瘤细胞的增殖、分化、侵袭和转移过程中,往往存在多种基因网络或信号通路的共同参与.miRNA-497不仅可以调控PI3K/AKT信号通路,在肿瘤细胞中还可以调控其他蛋白的表达[16-17],因此还需要对结肠癌的放疗敏感性调控网络进行深入研究.
本研究对miRNA-497在结肠癌放疗敏感性中的作用进行了初步阐明,并对其调控机制进行了研究,过表达miRNA-497可通过靶向抑制PI3K/AKT通路增加Caco2细胞的放疗敏感性,这为miRNA-497作为靶向药物提供了有价值的实验证据.

